富含乳酸菌的脱腥海参肽粉的制备
汪韬,温运启,于娇,薛勇,薛长湖
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
海参作为我国“海产八珍”之一,具有高蛋白、低脂肪和低糖的特点,其富含人体所需的氨基酸、维生素、脂肪酸和微量元素等营养物质[1]。同时,海参中含有的海参多糖、海参皂甙具有抗肿瘤、增强免疫等功效[2-5]。目前,海参的加工方法主要有盐渍、盐干、糖干、淡干和冻干等。由于传统干制海参存在泡发工艺复杂、耗时长等问题[6],因此研究人员基于方便、速食和大众化的优点开发出多种海参速食产品,例如即食海参、海参果冻、海参胶、海参口服液等[7-9]。
海参肽的腥味是影响海参肽类产品接受度的重要因素,其腥味去除方法主要包括吸附、掩盖、包埋等物理方法。尽管,这一类方法能够对海参腥味发挥一定作用,但仍有不足。其中,吸附法会造成一定的海参原有风味的缺失以及海参多肽17.51%~50.81%的损失[10],掩盖法和包埋法会使得海参成分占比较低,且产品贮藏一段时间后存在返腥现象[11-12]。研究表明,乳酸菌发酵法对牡蛎的去腥和风味提升具有良好的效果[13],同时乳酸菌具有调节免疫力、降低胆固醇以及改善肠道等功效[14-15]。因此,本文探究了乳酸菌发酵法对海参酶解液去腥和风味的影响,并通过冷冻干燥技术制备了富含乳酸菌的海参肽粉制剂,旨在为海参的精深加工和产品开发提供一定的理论依据和科学参考。
1 材料与方法
1.1 材料与试剂
盐渍海参,青岛市南山水产市场;鼠李糖乳杆菌、嗜酸乳杆菌,中国工业微生物菌种保藏管理中心;MRS肉汤、MRS琼脂,青岛海博生物科技有限公司。
NaCl、NaOH(均为分析纯),蔗糖、脱脂乳粉、谷氨酸钠、VC、食用甘油(均为食品级),国药集团化学试剂有限公司。
1.2 仪器与设备
超净工作台,苏州苏泰净化设备工程有限公司;GHP-9270恒温培养箱,苏州国飞实验室仪器有限公司;料理机,小熊电器股份有限公司;IKA涡旋混合器,德国IKA有限公司;Agilent 7980A GC气相色谱-质谱联用仪,安捷伦科技有限公司;Delta1-24 LSC plus冷冻干燥器,德国Marin Christ公司。
1.3 实验方法
1.3.1 海参酶解液的制备
将盐渍海参洗净,用去离子水浸泡脱盐,置于4 ℃条件下,每12 h换1次水,浸泡3 d。去除海参的沙嘴,洗净,斩拌,加入去离子水至固形物含量为15%。煮沸10 min,杀灭初始微生物。加入20 mg/g枯草杆菌蛋白酶,在50 ℃下,酶解5 h。然后用60目筛网过滤,滤液在90 ℃水浴10 min灭酶,然后急速冷却至4 ℃灭菌。得到灭菌海参酶解液。
1.3.2 发酵液的制备
将鼠李糖乳杆菌和嗜酸乳杆菌分别用MRS肉汤培养24 h,活化2代,然后第3代培养48 h。第3代在4 ℃,8 000 r/min条件下离心10 min。沉淀用无菌生理盐水清洗2次,然后菌液沉淀用灭菌酶解液配制成浓度为107CFU/mL的发酵液,4 ℃条件下备用。
1.3.3 乳酸菌发酵单因素实验
通过单因素实验,以风味感官得分为评价指标,考察发酵时间、蔗糖添加量、接种量对发酵液的影响。
1.3.4 正交试验
按照因素的影响程度,选择发酵时间、蔗糖添加量及接种量为主要影响因素,进行正交试验。其他条件为鼠李糖乳杆菌和嗜酸乳杆菌接种比例为3∶1,乳粉添加量为3%(质量分数),发酵温度为37 ℃。
1.3.5 冻干和贮藏
在酶解液中加入质量分数为0.5%的谷氨酸钠、0.5%VC和1%食用甘油复合使用作为冻干保护剂[16-17],进行冻干得到粉剂,测定冻干样品的乳酸菌浓度,以未加冻干保护剂的样品为对照,按照公式(1)计算存活指数。将制得的粉剂分别常压塑封和真空塑封,包装好的粉剂分别于4 ℃和25 ℃条件下贮藏。即得到4 ℃常压、4 ℃真空、25 ℃常压和25 ℃真空这4种贮藏条件下的样品,每2个月测定样品中乳酸菌浓度。
(1)
式中:Y,乳酸菌存活指数;k0,对照组样品中乳酸菌浓度,CFU/g;k1,冻干样品中乳酸菌浓度,CFU/g。
1.3.6 风味感官评定
由8位感官评定员组成,主要以样品的组织状态、腥味、风味和口感为评价指标。去掉每种样品的最高分和最低分,取平均分作为样品的感官值[18],如表1所示。
1.3.7 理化指标测定
酸度(吉尔捏尔度)按照鲜乳的检验中酸度的测定方法测定[19];菌落计数按照GB4789.35——2016中方法测定乳酸菌含量[20]。

表1 感官评价表Table 1 Sensory evaluation form
1.3.8 顶空固相微萃取结合气质联用分析挥发性成分
样品前处理:取海参酶解液发酵前后的样品置于20 mL顶空瓶中,于60 ℃下平衡5 min后,用固相微萃取针萃取40 min。
气相色谱-质谱联用条件:色谱柱为HP-INNOWAXS毛细管柱子(30 m×0.25 mm×0.25 μm);载气为He,流速1 mL/min,分离比5∶1;进样温度为250 ℃;升温程序为起始温度40 ℃,保持5 min,以8 ℃/min升至250 ℃,保持5 min。
质谱条件:EI电离源,能量70 eV;离子源温度230 ℃,四极杆温度150 ℃,接口温度250 ℃,扫描范围30~500m/z。
2 结果与分析
2.1 海参酶解液发酵单因素实验
以感官值为判定指标、酸度值为参考指标,探究发酵时间、加糖量和接种量对海参发酵液的影响。由图1-a可知,随着发酵时间的延长,感官值呈先上升后下降的趋势,在发酵时间为7 h时达到最大值,且酸度值随着发酵时间的延长而升高。这表明发酵是一个持续产酸的过程,在发酵7 h时糖酸比达到一个较优值。而持续发酵因产酸过多,使得感官值降低。由图1-b可知,随着加糖量的增加,感官值和酸度值都呈现先上升后下降的趋势,感官值在加糖量为3%达到最高。这表明加糖量在一定范围内有利于乳酸菌的发酵,产生较好的风味,而加糖量过高时,会对乳酸菌的生长有一定的抑制作用,使得产酸不够,样品偏甜,感官值下降。由图1-c可知,随着接种量的增加,感官值和酸度值先上升后下降,感官值在接种量为4%时最高。这表明在一定的接种量条件下,乳酸菌在指数生长期内产酸量和糖分达到了一个较好的糖酸比,使得感官值较好。而接种量过高时,由于乳酸菌在指数增长期内的大量繁殖使得产酸量过高,从而降低感官值[21]。

a-发酵时间;b-加糖量;c-按种量图1 发酵时间、加糖量和接种量对发酵感官值的影响Fig.1 Effects of fermentation time, sugar content and inoculation amount on sensory value
2.2 海参酶解液发酵工艺正交试验
根据单因素实验结果,选择发酵时间(A),蔗糖添加量(B),接种量(C)为3因素,设置3水平,以感官评价值为指标,采用正交试验进行发酵条件优化,根据极差分析法来确定发酵最佳条件。实验结果如表2所示,通过极差分析可知,各因素对海参酶解液风味提升的影响大小依次为蔗糖添加量>发酵时间>接种量。由K值可知,最佳组合为A2B3C2。由表2感官评价值可知,最佳组合为A3B3C1。经验证,组合A2B3C2的感官评价值为83.62分,高于组合A3B3C1的得分(81.75分)。故发酵最优组合为A2B3C2,即发酵条件为发酵时间7 h,蔗糖添加量为4%(质量分数),菌液接种量为3%。
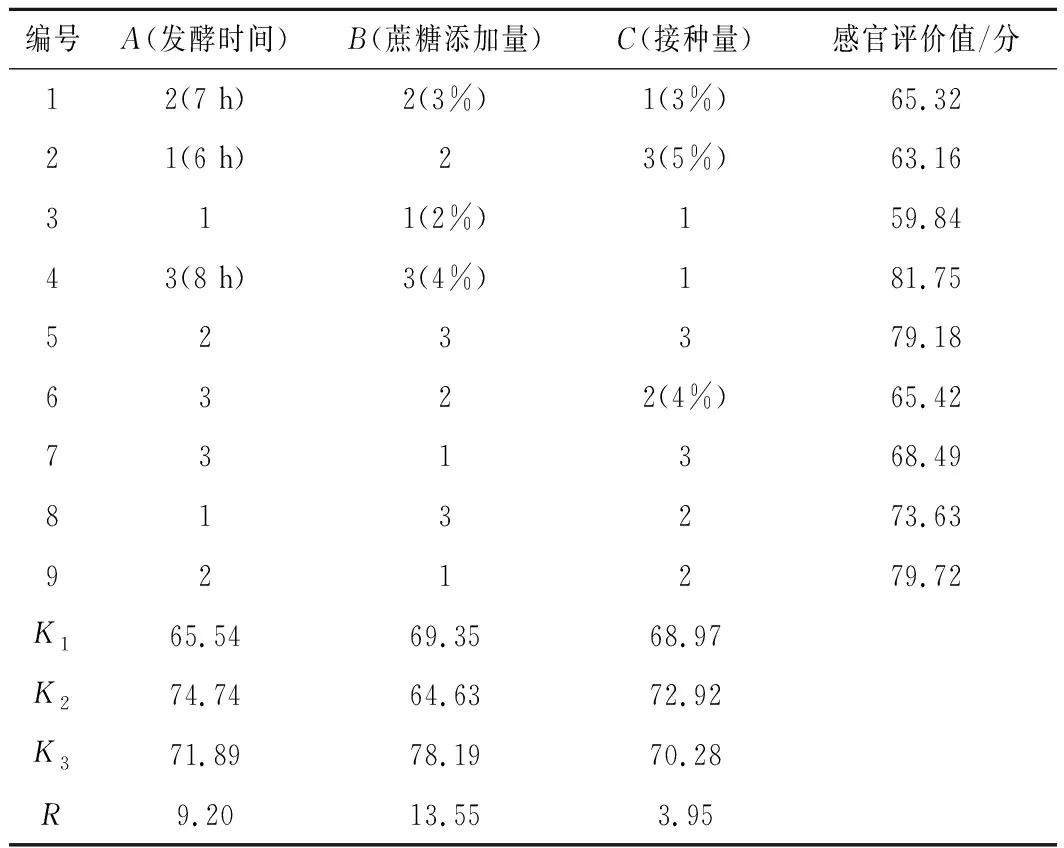
表2 正交试验表Table 2 Orthogonal test table
2.3 海参酶解液发酵前后风味成分分析
经过正交试验优化后的发酵工艺制得的海参酶解发酵液,通过感官值可知其腥味较海参酶解液明显降低,且有益风味有了明显提升。本研究采用顶空固相微萃取法结合气质联用法测定发酵前后海参液的挥发性风味成分及变化。表3为发酵前后挥发性化合物的归属、占比及气味特点。采用顶空固相微萃取结合气质联用法对发酵前后的海参酶解液进行风味分析。结果表明,发酵前和发酵后的挥发性化合物分别为28种和39种。且发酵前后,海参酶解液中挥发性风味成分总相对含量分别为44.12%,50.39%。发酵前呈不愉快气味的挥发性化合物有10种,占总挥发性风味成分相对含量为12.65%,呈愉快气味的挥发性化合物有18种,占总挥发性风味成分相对含量为31.46%。发酵后呈不愉快气味的挥发性化合物有6种,占总挥发性风味成分相对含量为6.36%,呈愉快气味的挥发性化合物有33种,占总挥发性风味成分相对含量为44.03%。经过对比,呈不愉快气味的挥发性化合物占比由发酵前的12.65%降低为发酵后的6.36%。呈愉快气味的挥发性化合物占比由发酵前的31.46%上升为发酵后的44.03%。其中,经过发酵还产生了辛酸、癸酸、棕榈酸、己醛、庚醛、反-2-辛烯醛等15种呈愉快气味的挥发性化合物[22],并且2-氨基丙烷、十五烷、2,6,10,14-四甲基十五烷、2,5-二叔丁基酚和吡啶这5种呈不愉快风味的挥发性化合物经过发酵后消失[23]。

表3 海参酶解液发酵前后挥发性化合物的归属、峰面积比例及气味特点[22-24]Table 3 Attribution, peak area ratio and odor characteristics of volatile compounds before and after fermentation of sea cucumber enzymatic hydrolysate
2.4 海参酶解发酵液的冻干及贮藏
将海参发酵液加入冻干保护剂冻干后,以未加冻干保护剂的发酵液作为对照,测定乳酸菌的存活率及乳酸菌浓度,并测定贮藏期间海参冻干粉中的乳酸菌浓度。由图2可知,相对于未加冻干保护剂,添加冻干保护剂的海参发酵液经过冻干后乳酸菌含量为对照组的1.9倍。冻干后得到的粉剂中乳酸菌浓度为6.54×1010CFU/g、海参质量分数为54%的粉剂。且该冻干粉剂初始乳酸菌含量和市售益生菌固体饮料基本一致。将添加保护剂的冻干粉剂分别置于4种不同条件下贮藏。由图3可知,粉剂的活菌数在贮藏期呈下降趋势,且不同贮藏条件之间存在显著差异。采用4 ℃真空贮藏的活菌存活率在3个月后降为67.58%,为最优贮藏条件,且贮藏3个月后活菌数仍远高于企业标准中的1×106CFU/g[25]。
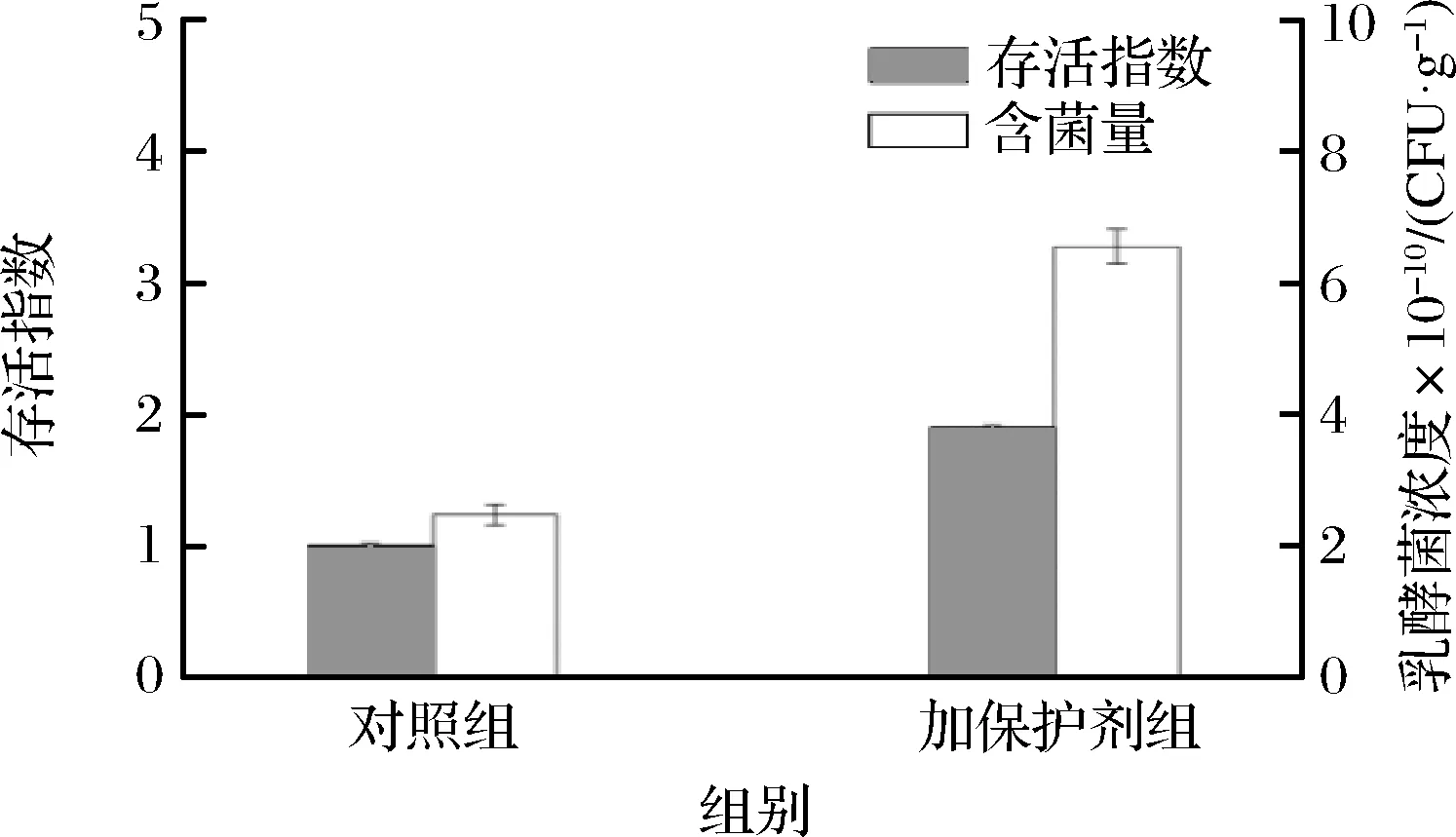
图2 添加冻干保护剂后冻干效果对比Fig.2 Comparison of lyophilization effect after adding lyophilization protection agent
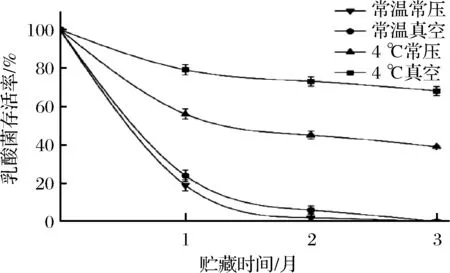
图3 海参肽冻干粉贮藏过程中乳酸菌存活率Fig.3 Survival rate of lactic acid bacteria during storage of sea cucumber peptide lyophilized powder
3 结论
综上研究可知,通过乳酸菌发酵海参酶解液可以很好去除海参酶解液的腥味,同时提升风味。在发酵时间7 h,蔗糖添加量4%(质量分数),菌液[V(鼠李糖乳杆菌)∶V(嗜酸乳杆菌)=3∶1]接种量3%时达到最佳发酵效果,此时海参发酵液风味最佳。且顶空固相微萃取结合气质联用结果表明,海参酶解液中呈不愉快气味的化合物占比由发酵前的12.65%降为发酵后的6.36%,呈愉快气味的化合物占比由发酵前的31.46%上升为发酵后的44.03%。这表明乳酸菌发酵减少了海参酶解液的不良风味物质,还能产生风味良好的物质。通过冻干制得的海参粉剂含海参质量分数为54 %,乳酸菌浓度为6.54×1010CFU/g,且乳酸菌活性较好。该粉剂能同时满足消费群体对海参和乳酸菌的摄入,且风味较好。因此,该海参发酵液制备的粉剂具有开发为富含乳酸菌的海参固体饮料的潜力,也可用于咀嚼片、海参酸奶发酵剂等产品中。

