热化疗诱导损伤相关分子模式表达增强口腔鳞状细胞癌细胞免疫原性的研究
孙巧珍 石凡 罗丹 徐婷 王升志
1.青岛大学口腔医学院,青岛 266003;2.青岛大学附属烟台毓璜顶医院口腔颌面外科,烟台 264000
患者自身肿瘤细胞免疫原性较弱,免疫细胞较少浸润肿瘤组织,加之免疫抑制微环境的存在,使得免疫治疗仍面临单独治疗疗效不理想,患者响应率低等诸多问题[1-4]。因此,寻求更多增强肿瘤细胞免疫原性的方法与途径,有助于提高肿瘤治疗的疗效[5]。近年来的研究[2,6-10]发现,部分特定的化疗药物、紫外线、γ 射线及光热治疗,在诱导肿瘤细胞发生凋亡的同时,会促使其表达与释放一系列损伤相关分子模式(danger associated molecular patterns,DAMPs),可作为一种内源性危险信号,增强肿瘤细胞免疫原性,并进一步介导抗肿瘤免疫反应。热疗(hyperthermia,HT)与化疗联合应用时的协同增敏作用已在多种类型癌症治疗中得到验证[11-13]。既往的研究[14-15]证实,热化疗可提高荷瘤宿主及口腔癌患者体内细胞毒性T淋巴细胞(cytotoxic T lym-phocyte,CTL)和自然杀伤细胞(natural killer cell,NK cell)的数目及活性,白细胞介素-2 (interleukin-2,IL-2)和肿瘤坏死因子(tumor necrosis factor,TNF)的活性水平,并促进热休克蛋白(heat shock protein,HSP)70在肿瘤细胞特异性的高表达等。本研究选取3株口腔鳞状细胞癌不同细胞系,探讨热化疗诱导口腔鳞状细胞癌细胞表达DAMPs,从而增强免疫原性的作用,以期为热化疗与免疫疗法联合治疗口腔鳞状细胞癌提供思路。
1 材料和方法
1.1 材料
口腔鳞状细胞癌CAL27、SCC-15和Tca8113细胞(烟台毓璜顶医院中心实验室、青岛市立医院实验室提供);1640培养基及胎牛血清(Biological Industries BI公司,以色列);胰蛋白酶、DMSO等(Gibco公司,美国);CCK-8试剂(上海碧云天生物技术有限公司);Anti-Calreticulin antibody(Ab-cam公司,英国);FITC Annexin V Apoptosis Detec-tion kit Ⅰ(BD Biosciences公司,美国);注射用盐酸平阳霉素(pingyangmycin,PYM)(吉林敖东药业集团延吉股份有限公司)。
1.2 方法
1.2.1 细胞培养 将保存于液氮罐中的口腔鳞状细胞癌CAL27、SCC-15和Tca8113细胞取出置于37 ℃水浴锅快速解冻,然后以1 000 r·min-1速度离心5 min后收集细胞,用含10%胎牛血清的1640培养基,在37 ℃、5%CO2培养箱中培养。每2~3 d传代一次,待细胞生长状况稳定、呈对数生长期时,收集细胞用于实验。
1.2.2 CCK-8实验检测PYM对细胞的半数抑制浓度(inhibiting concentration,IC50) 收集对数生长期的细胞,以每孔100 μL(104个细胞)接种于96孔板,置37 ℃、5%CO2培养箱孵育过夜。待细胞贴壁后,弃上清,分别加入100 μL浓度为80、40、20、10、5、2.5 μg·mL-1的PYM溶液,每种浓度设置5个复孔,并设置空白孔(无细胞培养孔)与对照孔(未加药物处理的细胞培养孔)。药物干预24 h后,每孔加入100 μL CCK 8溶液(含10%的CCK-8),2 h后于酶标仪上检测各孔在450 nm处的光密度(optical den-sity,OD)值。细胞抑制率(%)=(实验组OD值-对照组OD值)/对照组OD值×100%,计算IC50。
1.2.3 热疗 将处理组细胞培养瓶分别于39、42、45 ℃恒温培养箱孵育60 min后,放回至37 ℃、5%CO2培养箱复温孵育。
1.2.4 细胞分组 细胞分组如下。1)对照组:常规培养细胞,不经任何处理;2)化疗组:工作浓度(IC50)PYM处理细胞24 h,37 ℃恒温培养;3)热疗组:将细胞分别于39、42、45 ℃培养箱处理60 min后,放回至37 ℃复温培养24 h;4)联合组(HT+PYM):工作浓度PYM处理细胞并于不同温度培养箱培养60 min后,放回至37 ℃复温培养24 h。
1.2.5 膜联蛋白V(Annexin V)/碘化丙啶(propi-dium iodide,PI)联合染色以及流式细胞术检测细胞凋亡 不同组细胞经热疗、化疗及热化疗联合处理后,分别消化收集各组细胞(包括上清液中的细胞),洗涤2次后1 200 r·min-1离心5 min,弃上清,Buffer重悬细胞并计数。取100 μL细胞悬液(密度为每毫升1×106个),离心弃上清,100 μL 1×Binding Buffer重悬,加入5 μL FITC Annexin V吹打混匀后,再加入5 μL PI混匀,置室温(20~25 ℃)避光孵育15 min,洗涤2遍离心后,加入400 μL 1×Binding Buf fer重悬上流式细胞仪检测。
1.2.6 流式细胞仪检测细胞表面钙网蛋白(calreticu-lin,CRT)表达率 不同组细胞经热疗、化疗及热化疗联合处理后,分别消化收集各组细胞,洗涤2次后1 200 r·min-1离心5 min,弃上清,Buffer重悬细胞并计数。取100 μL细胞悬液(密度为每毫升1×106个),滴加2 μL Anti Calreticulin antibody吹打混匀后,置室温避光孵育30 min,洗涤2遍离心后,加入500 μL Buffer重悬上流式细胞仪检测。
1.2.7 酶联免疫吸附试验(enzyme-linked immunosor-bent assay,ELISA)检测细胞上清中高迁徙率族蛋白B1(high-mobility group box 1,HMGB1)分泌情况 不同组细胞经热疗、化疗及热化疗联合处理后,分别收集各组细胞上清液,1 200 r·min-1离心20 min,取上清检测,具体步骤按照ELISA试剂盒说明书进行,当标准孔出现明显浓度梯度后,终止反应,并立即于酶标仪检测450 nm波长下的OD值。
1.3 统计学处理
采用SPSS 20.0统计软件对实验数据进行分析,结果以均数±标准差表示,多组间细胞凋亡率、CRT膜表达率及HMGB1分泌量差异比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PYM工作浓度的确定
PYM作用24 h对CAL27、SCC-15细胞的IC50为5 μg·mL-1,对Tca8113细胞的IC50为20 μg·mL-1,选定为工作浓度,进行后续实验(表1)。

表 1 CCK-8法检测PYM作用24 h时细胞的增殖抑制情况Tab 1 Cell inhibitation after 24 h chemotherapy of PYM was detected by CCK-8 assay %
2.2 不同温度热疗对口腔鳞状细胞癌细胞CRT膜表
达比例及HMGB1分泌的影响
流式细胞术及ELISA试验检测不同温度热疗处理3株口腔鳞状细胞癌细胞系后,CRT膜表达比例及HMGB1分泌的改变(图1)。结果显示:1)CAL27细胞及Tca8113细胞中,随温度升高,CRT膜表达比例及HMGB1分泌量均增加,39 ℃组、42 ℃组与对照组相比,CRT膜表达比例的升高无统计学意义(P>0.05),HMGB1分泌量的增加有统计学意义(P<0.01);而45 ℃组与对照组相比,CRT膜表达比例及HMGB1分泌量的差异均有统计学意义(P<0.01);且45 ℃组与39 ℃组和42 ℃组间两两比较,差异均有统计学意义(P<0.01)。2)SCC-15细胞热疗处理后,CRT膜表达比例随温度升高而增加,但无论是热疗组与对照组比较还是温度组间两两比较,差异均无统计学意义(P>0.05)。
2.3 热化疗对口腔鳞状细胞癌细胞CRT膜表达比例及HMGB1分泌的影响
进一步检测热化疗对3株细胞CRT膜表达比例及HMGB1分泌量的影响,结果见图2。CAL27和Tca8113经热化疗联合处理后,CRT膜表达率升高明显,差异具有统计学意义(P<0.05);而SCC-15细胞在经PYM及热化疗联合处理后,CRT膜表达率也升高,但差异无统计学意义。3株细胞经PYM处理后HMGB1分泌均增多,且热化疗组HMGB1分泌量较单纯PYM化疗组升高明显,差异具有统计学意义(P<0.05)。
2.4 热化疗对口腔鳞状细胞癌细胞凋亡的影响
Annexin V/PI联合染色及流式细胞术检测热化疗处理3株细胞后细胞凋亡比例的改变。结果显示:各组细胞凋亡比例较处理前均升高,差异有统计学意义(P<0.05);其中联合组(PYM+45 ℃)与对照组及其他处理组两两比较,差异有统计学意义(P<0.01),其晚期凋亡率(Annexin V+PI+)显著增多,而早期凋亡(Annexin V+PI-)较其他处理组减少(图3)。
3 讨论
目前,口腔鳞状细胞癌主要采取以手术为主的综合序列治疗。热疗作为继手术、放疗、化疗及生物免疫治疗之后的第五大肿瘤治疗手段,以其提高患者生存质量的独特优势已经成为综合治疗的有效治疗方式之一。热疗常与化、放疗联合应用以增强肿瘤对化、放疗的敏感性[11-13]。传统观点认为,热化疗联合应用时疗效的增强主要是通过热诱导细胞凋亡、化疗药物的细胞毒作用以及热化疗联合应用时的协同作用。而近来研究显示,与单一治疗方式相比,热化疗联合应用不仅对原发肿瘤更为有效,而且可激活抗肿瘤免疫效应,抑制远端转移瘤的生长[16]。这提示,热化疗联合应用不仅可增强肿瘤对化疗的敏感性,而且具有免疫刺激作用。
部分特定的化疗药物、紫外线、γ 射线及光热治疗,在诱导肿瘤细胞发生凋亡的同时,会促使其表达与释放DAMPs,增强肿瘤细胞免疫原性,并进一步介导抗肿瘤免疫反应。CRT、HSP70、HMGB1以及三磷酸腺苷(adenosine triphosphate,ATP)是此过程中重要的DAMPs,这些分子信号在细胞内主要为非免疫原性,但释放至细胞外后则可发挥免疫原性作用。细胞表面暴露的CRT,会向机体免疫系统发出“吃我”信号,通过与树突状细胞(dendritic cells,DCs)和其他抗原呈递细胞(antigen-presenting cells,APCs)上的CD91受体结合,促进肿瘤抗原的识别与吞噬;细胞外分泌的HMGB1可向机体免疫系统发出“危险”信号,通过与DCs上的toll样受体4(toll-like receptor 4,TLR4)相结合,从而活化该受体介导的信号通路,诱导DCs的成熟,并且促进抗原的加工与提呈,从而介导抗肿瘤免疫反应[2,6-10]。

图 1 口腔鳞状细胞癌细胞经热疗处理24 h后CRT膜表达比例变化及HMGB1分泌情况Fig 1 Changes of the percentages of CRT membrane expression and the secretion of HMGB1 after 24 h hyperthermia
本研究先是应用流式细胞术及ELISA试验检测不同温度(39、42、45 ℃)处理3株口腔鳞状细胞癌细胞系后,CRT膜表达比例及HMGB1分泌的改变。结果显示,CAL27细胞及Tca8113细胞中,随温度升高,CRT膜表达比例及HMGB1分泌量均增加,其中,39、42 ℃组与对照组相比,CRT膜表达比例的升高无统计学意义;而45 ℃组CRT膜表达率的升高,较其他组两两比较,差异具有统计学意义(P<0.01)。这与Adkins等[17]的研究结果相一致,即:高温热疗可诱导肿瘤细胞表达DAMPs。Adkins等[17]随后将经高温热疗处理后的肿瘤细胞与DCs共培养,发现肿瘤细胞被依赖于细胞表面CRT的树突状细胞有效吞噬,并诱导了更高水平的CD8+T细胞的活化与增殖,发挥抗肿瘤作用。然而,SCC-15细胞经热疗处理后,CRT膜表达比例虽随温度升高而增加,但无论与对照组比较还是温度组间两两比较,差异均无统计学意义,这是否与该细胞株热敏感性较差相关,仍需进一步探讨研究。
本研究结果中,随着温度升高,CRT膜表达比例以及HMGB1分泌量均增加,但并非温度越高越好、时间越长越好。热疗后肿瘤细胞会以不同的方式死亡,死亡方式的不同受温度、热处理时间、肿瘤细胞类型和细胞周期阶段等影响。大量的研究证实,当温度大于44 ℃时,细胞以晚期凋亡为主,且坏死细胞数目显著增多。临床常用的也是被广泛认可的基础热疗有效温度是43 ℃,本研究仅作体外细胞系探讨,当应用于体内实验时,过高的温度和过长的作用时间,由于不可避免的热扩散,会严重损害周围的健康组织,给患者带来极大的不适。值得关注的是,随着近年来光热疗法及磁热疗法等前沿热疗手段的持续发展,高温热疗的临床应用已成为可能。
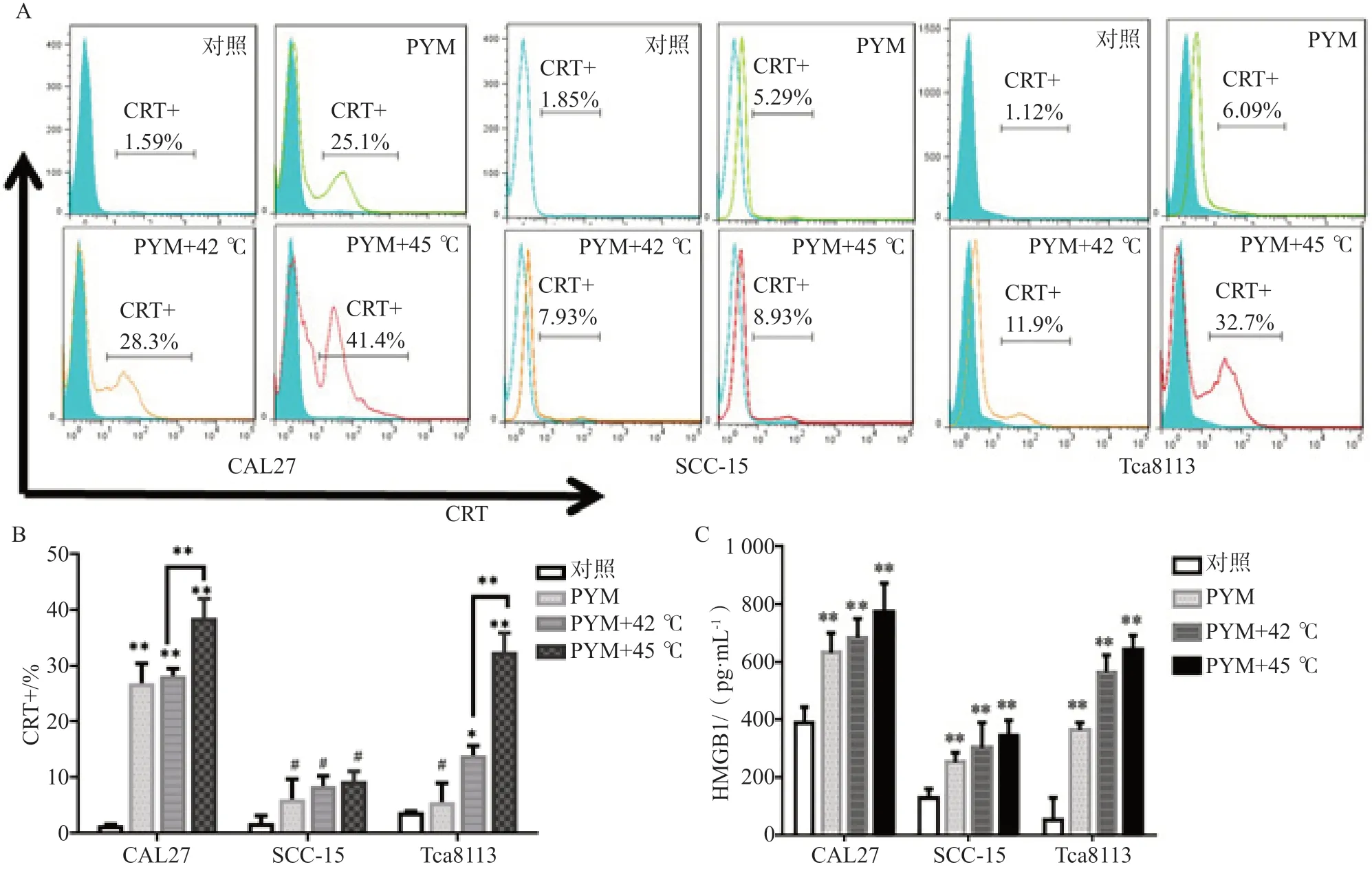
图 2 口腔鳞状细胞癌细胞经热化疗处理24 h后CRT膜表达比例变化及HMGB1分泌情况Fig 2 Changes of the percentages of CRT membrane expression and the secretion of HMGB1 after 24 h thermo-chemotherapy

图 3 口腔鳞状细胞癌细胞经热化疗处理24 h后凋亡细胞比例变化Fig 3 Changes of the percentages of apoptotic cells after 24 h thermo-chemotherapy
研究进一步探讨了热化疗对细胞凋亡、CRT膜表达及HMGB1分泌的影响。结果证实了热化疗联合在诱导CRT膜表达及HMGB1分泌方面的作用明显优于单纯化疗组,热化疗联合应用在诱导免疫原性调强方面可能具有协同作用。
通过查阅文献,笔者分析认为,热化疗对CRT膜表达及HMGB1分泌的影响较单纯化疗组更为显著,可能与以下途径相关。1)内质网应激通路:CRT与HMGB1共同参与内质网应激PERK/EIf2α/ATF4通路,HMGB1通过介导内质网应激的PERK/EIf2α/ATF4信号通路诱导细胞凋亡[18];而EIf2α激酶的磷酸化是CRT由内质网至细胞膜表面转位的必要条件[19]。由此,本实验中,热化疗后CRT膜表达的增多以及HMGB1分泌的增多,可能是由热化疗启动PERK/EIf2α/ATF4信号通路所调控。
2)凋亡途径:热化疗后Bcl-2、Bax、Bak及caspase[20-21]等凋亡相关蛋白表达发生改变,并可能通过影响EIF2α酶的磷酸化,进而影响CRT由胞内至细胞膜表面的转位以及HMGB1的分泌。结合本实验研究结果,热化疗后CRT膜表达的增多以及HMGB1分泌的增多,可能是由于热化疗后凋亡蛋白表达上调间接引起内质网应激所致。
3)JNK-CRT-依赖途径:Chang等[22]在其研究中发现Norch信号可以调控CRT的的表达,其主要是通过JNK-CRT-依赖途径发挥作用;而王琳等[23]的研究曾发现,热化疗可以激活JNK信号通路。由此推论,热化疗后CRT膜表达的增多以及HMGB1分泌的增多,可能与热化疗激活JNK-CRT-依赖途径有关。
综上所述,热疗、PYM化疗及热化疗联合均能在诱导口腔鳞状细胞癌细胞凋亡的同时促使DAMPs表达从而增强口腔鳞状细胞癌细胞免疫原性,热化疗联合应用在凋亡诱导及诱导DAMPs表达方面效果均明显优于单纯化疗。这为增强口腔鳞状细胞癌细胞免疫原性提供了一种新的方法,也为免疫治疗联合热化疗治疗口腔鳞状细胞癌提供了新的思路。然而,要证实热化疗可通过增强口腔鳞状细胞癌细胞免疫原性的途径介导抗肿瘤免疫反应,后续仍需通过与DCs共培养等方式检测其对免疫细胞成熟的影响,并通过进一步动物实验及体内实验,验证其介导抗肿瘤免疫应答的能力。
利益冲突声明:作者声明本文无利益冲突。

