岩原鲤仔稚鱼生长发育过程中消化酶活性的变化
王垂瑾,王 尧,孙悦佳,高煜杰
(海南大学 海洋学院,海南 海口 570228)
岩原鲤(Procyprisrabaudi)属鲤形目Cypriniformes、鲤科Cyprinidae、原鲤属,俗称岩鲤巴、岩鲤,其主要分布于长江中上游的干流或支流水系,尤其以嘉陵江和岷江盛产,是长江中上游重要的名贵经济鱼类和特有鱼类[1-2].岩原鲤肉质细嫩、味道鲜美,无肌间刺,具有较高的食用价值,市场前景广阔.然而,岩原鲤生长缓慢,性成熟周期长,且由于受到过度捕捞、水域环境污染以及自然栖息地丧失等因素的影响而导致其种质资源急剧下降,现已被《中国濒危动物红皮书》列为易危物种[3-4].因此,建立高效的苗种培育技术体系对于恢复岩原鲤种群数量以及发展此优质品种的养殖产业具有重要意义.
岩原鲤仔稚鱼主要以浮游动植物为食,然而浮游生物通常不足以帮助其顺利度过生长周期的初始阶段.对于营养需求而言,仔鱼仍然要依赖卵黄囊的储备,待卵黄耗尽后,仔鱼必须开始摄取外部食物以满足其生长所需能量,鱼体摄食饵料的效率取决于其消化能力以及摄入养分的吸收转化效率[5-6].鱼体消化酶的活性分析是一种简单而可靠的生化方法,通过其活性可以初步判断鱼体对饵料的消化能力,并且在一定程度上还可反映出鱼体对营养素的需求状态[7-8].因此,测定分析仔稚鱼早期生长发育阶段的消化酶变化情况,有助于确定适宜的投喂策略和饵料配方,从而提高仔稚鱼的成活率[9].
由于目前尚未有关于岩原鲤仔稚鱼生长发育和消化酶活性变化的研究报道,因此,本文主要研究了岩原鲤仔稚鱼发育过程中的生长情况以及消化酶活性的变化趋势,旨在为解决仔稚鱼培育阶段成活率不高的瓶颈问题以及提高岩原鲤苗种人工培育的效率奠定理论基础.
1 实验材料与方法
1.1 实验材料岩原鲤亲本暂养于四川金沙江溪洛渡向家坝水电站的珍稀特有鱼类增殖放流站,排卵前投喂人工配合饲料并适量补充水蚯蚓等生物饵料进行营养强化,繁殖期间水温为18.5~20.0 ℃.岩原鲤的繁殖采用的是人工授精方式,挤压经催产的雌鱼腹部,使其排卵于预先准备好的容器内,随后立即将所采集的雄鱼精液加入盛有鱼卵的容器内进行授精.受精卵经人工脱粘后用锥形桶孵化器进行孵化,孵化密度约为600~800粒/L,采用曝气微流水培育,日换水量约为10%~20%.岩原鲤仔鱼开口阶段采用轮虫进行投喂,密度约为5~6个/mL,于稚鱼阶段采用枝角类或桡足类的幼体投喂,密度约为2~3个/mL,每日投喂3次,其中,饥饿组不投喂饵料;养殖期间水温约为(24±0.5)℃,溶解氧在5 mg/L以上,pH 7左右.
1.2 样本采集分别在岩原鲤仔稚鱼培育的1,2,3,4,5,6,7,9,11,13,17,21,25,30,35,40 d进行取样,取样前24 h停止投喂.每个实验桶随机选取30尾仔稚鱼,用电子游标卡尺测量鱼体全长,以电子天平测量体重,用解剖显微镜观察鱼体的发育情况和形态特征,并依据公式SGR=100×(lnFBW-lnIBW)/T计算特定生长率,其中 FBW为个体终末体重(g),IBW为个体初始体重(g),T为培育时间(d).在每个养殖桶中另取30尾于MS-222(质量浓度为10 mg/L)溶液中麻醉.养殖前期取全鱼样本,后期个体较大时去除头部、尾部和背部多余肌肉,保留躯干部,样本置于1.5 mL无菌离心管中,立即放入液氮速冻,随后转至-80 ℃的冰箱中以用于消化酶活性的测定.
1.3 消化酶活性的分析用生理盐水润洗岩原鲤仔稚鱼,准确称量后加入9倍体积的PBS溶液的冰浴匀浆,于4 ℃以3 500 r/min离心10 min,转移上清液至离心管后保存于-80 ℃,待测.匀浆液的蛋白含量是采用南京建成试剂盒并依据BCA法进行测定;胰蛋白酶、脂肪酶、α-淀粉酶和碱性磷酸酶的测定是分别参照上海酶联生物技术有限公司的鱼胰蛋白酶活性试剂盒(ml064285)、鱼脂肪酶活性ELISA试剂盒(ml652113)、鱼α-淀粉酶ELISA试剂盒(ml036449)和鱼碱性磷酸酶ELISA试剂盒(ml036436)的操作说明书进行,在多功能酶标仪上读取相应的OD值并计算相应的结果.
1.4 数据统计分析数据用平均值±标准差(x±SD)来表示,并使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),当差异显著时(P<0.05)进一步用Duncan来进行多重比较和分析.
2 实验结果
2.1 岩原鲤仔稚鱼的生长情况经过40 d养殖实验后,岩原鲤仔稚鱼的生长情况如图1所示.结果显示,岩原鲤仔稚鱼的体重由2.44 mg增长至67.1 mg,特定生长率为8.29 %;全长由8.11 mm增长至23.05 mm.在仔稚鱼的生长发育过程中,体长和体重均呈现指数增长模式,拟合方程分别为y= 8.076e0.0261x(R2=0.981),y=2.749e0.0806x(R2=0.973).在生长初期(1~11 d)体长和体重变化较为平缓,生长后期(12 d)鱼体增长速度显著增加.饥饿组岩原鲤仔稚鱼的体长和体重逐渐下降,在养殖第12天时全部死亡.

图1 岩原鲤仔稚鱼的体长和体重变化
2.2 岩原鲤仔稚鱼消化酶活性的变化情况岩原鲤仔稚鱼消化酶活性的变化如下图2所示,结果显示,在岩原鲤仔稚鱼孵化的初始阶段均能够检测出胰蛋白酶、脂肪酶、淀粉酶和碱性磷酸酶的活性,其中,胰蛋白酶活性在孵化后的1~9 d呈现出显著上升趋势(P<0.05),而后在10~17 d开始显著下降,20 d后开始显著上升,直至35 d时达到峰值(P<0.05),随后40 d时又显著下降至57.33 U/mg.岩原鲤仔稚鱼的脂肪酶活性在开口前4 d无显著变化(P>0.05),从5 d至21 d有缓慢升高的趋势,而后在25~30 d时极显著增加并达到峰值(P<0.05),随后又开始显著下降,在40 d时下降至较低水平.岩原鲤仔稚鱼淀粉酶活性在开口前3 d有下降趋势,随后上升(5 d)至初始孵化水平,至17 d时总体变化并不显著(P>0.05),25 d后开始显著上升(P<0.05),直至30 d时达到峰值,并维持到35 d,而后开始显著下降,到40 d时淀粉酶活性依旧高于前期(1~25 d)生长发育阶段的淀粉酶活性.岩原鲤仔稚鱼的碱性磷酸酶活性在生长发育前期(1~25 d)的变化不显著(P>0.05),25 d后开始显著上升(P<0.05),在35 d时达到峰值,而后在40 d时下降到初始水平.
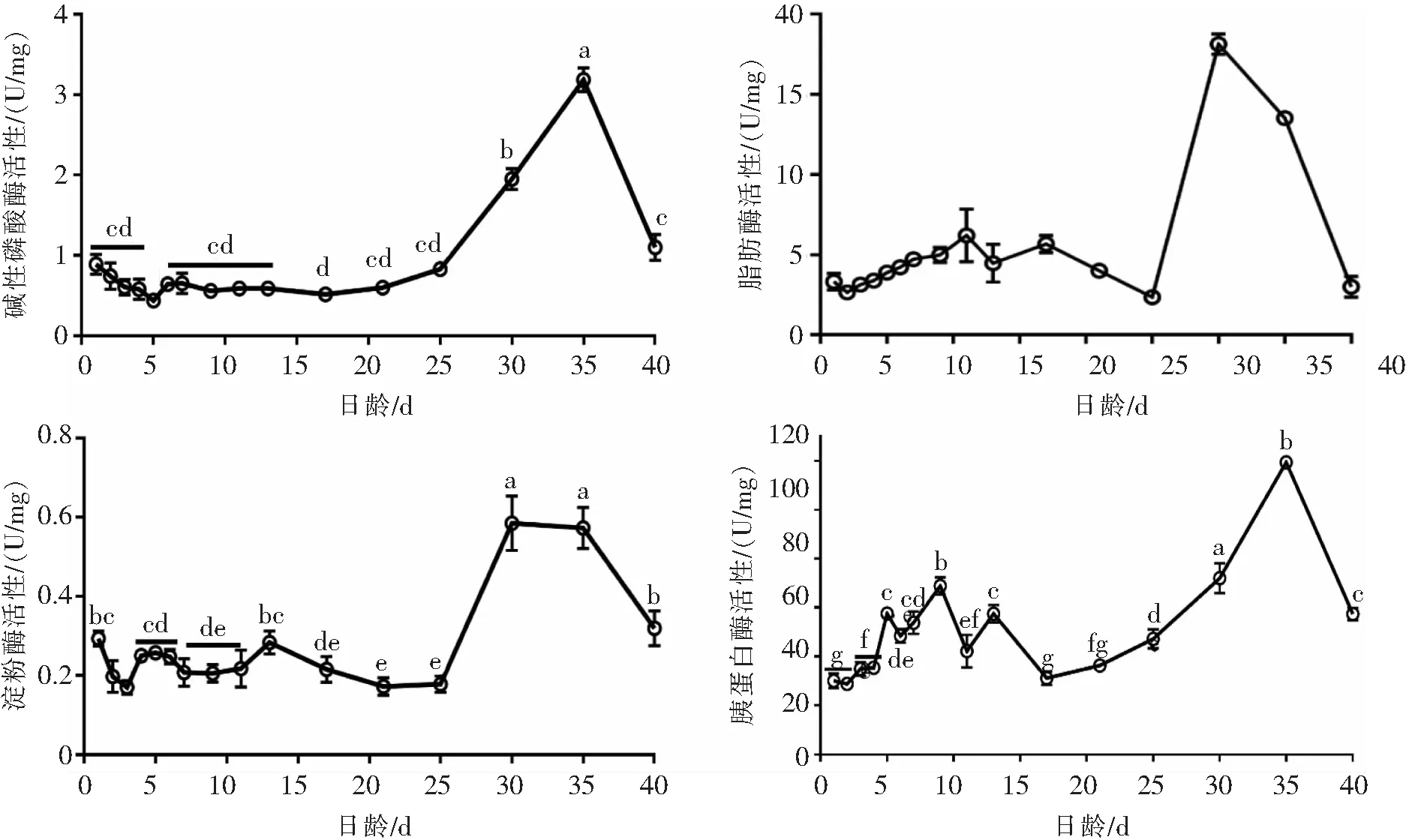
图2 岩原鲤仔稚鱼在不同生长阶段的消化酶活性变化
2.3 饥饿对岩原鲤仔稚鱼消化酶活性变化的影响如图3所示,与投喂组相比,岩原鲤仔稚鱼胰蛋白酶和脂肪酶的活性受饥饿状态的影响最为显著(P<0.05),而淀粉酶和碱性磷酸酶活性虽在饥饿状态下低于投喂组的淀粉酶和碱性磷酸酶活性,但差异并不显著(P>0.05).在饥饿情况下,岩原鲤仔稚鱼胰蛋白酶活性在5~11 d期间呈显著下降的趋势,且在9 d和11 d时显著低于投喂组的胰蛋白酶活性(P<0.05);在饥饿情况下,脂肪酶活性在5~11 d期间呈现出先上升后下降的趋势,在11 d时显著低于对照组(P<0.05)的脂肪酶活性.
3 讨 论
本实验结果显示,岩原鲤仔稚鱼于生长阶段呈现出指数生长模式,与石首鱼(TotoabamacdonaldiGilbert, 1890)[10]、细点牙鲷(Dentexdentex)[11]、亚马逊河琵琶鲶(Pseudoplatystomapunctifer)[12]、波斯鲟(Acipenserpersicus)[7]等鱼类仔稚鱼的生长模式一致.但在鲈鲤中的研究显示,其仔稚鱼体长和体重的变化分别是线性和三项式模式[13],而大鳞副泥鳅仔稚鱼的体长和体重的变化分别是线性和指数模式[14].由此可见,不同种鱼类其仔稚鱼生长发育的模式存在一定差异.有如文献报道[15],岩原鲤于仔稚鱼阶段其生长也较其他多数鱼类相对缓慢(SGR 8.29).同时本实验结果显示,岩原鲤于仔稚鱼发育初期(0~11 d时)其生长相对缓慢(SGR 4.7),而后其生长开始显著加速(13~40 d,SGR 9.33).岩原鲤于仔稚鱼初期其生长缓慢的主要原因可能是:鱼体处于组织器官发育的关键阶段,从卵黄摄取的大部分营养物质主要用于各组织器官的生长发育,而不是用于躯干部分的生长;另外,此阶段消化器官的较低发育水平也在一定程度上限制了其对饵料的消化吸收和利用;再就是所投喂的生物饵料不足以完全满足此阶段鱼体的生长发育,这也可能是重要因素之一[16].

图3 投喂和饥饿对岩原鲤仔稚鱼消化酶活性的影响
研究仔稚鱼早期生长阶段的发育状态和消化酶活性的变化情况能够使我们了解其对营养素的利用能力,并依此建立有效的仔稚鱼投喂策略,提高其成活率.本研究显示,在岩原鲤仔稚鱼开口前的初始孵化阶段均能够检测到胰蛋白酶、脂肪酶、淀粉酶和碱性磷酸酶的活性,表明这些消化酶在没有外源食物刺激时其主要是由内源自身合成并受相应基因调控,而且它们参与了卵黄营养物质的消化与分解.同样,在大鳞副泥鳅[15]、黄尾鰤 (Seriolalalandi)[17]、亚马逊河琵琶鲶[12]等大多数鱼类的仔稚鱼初孵阶段均检测出消化酶活性.
在鱼类仔稚鱼发育阶段,蛋白质是重要的营养和能量物质,其中内源性营养阶段主要依靠卵黄供给,而在开口之后其营养主要由外源食物提供.外源食物中蛋白质或氨基酸含量能够有效促进鱼体蛋白酶的分泌[18].Cara等的研究显示,胰蛋白酶活性是反映仔稚鱼营养状态的良好指标[19].本实验结果亦显示,岩原鲤仔稚鱼胰蛋白酶的活性远高于脂肪酶等其他消化酶的活性,这进一步说明蛋白质/氨基酸是此阶段其生长发育的重要营养物质,而且在后期(15 d)当其生长速度加快时胰蛋白酶的活性也随之显著升高,并在35 d时达到峰值.而岩鲷(Oplegnathusfasciatus)[20]和欧洲鳇(Husohuso)[21]的胰蛋白酶活性在快速生长初期(10~20 d)即达到峰值,随后显著下降(30~50 d).细点牙鲷[11]、塞内加尔鳎(Soleasenegalensis)[22]和北美牙鲆(Paralichthyscalifornicus)[23]的研究显示,胰蛋白酶活性在初始孵化阶段最高,而后随着生长发育的进行其活性显著下降.然而Mourente等认为,细点牙鲷在胚胎发育阶段,蛋白质和氨基酸是其主要的能量物质来源,而在卵黄营养阶段脂质比蛋白质或碳水化合物更为重要[11].由此可见,不同鱼类在仔稚鱼生长阶段其对能量物质的需求差异也可能是导致相应消化酶活性发生不同变化的重要因素.细点牙鲷的脂肪酶活性在发育早期阶段(0~19 d)显著升高,而后开始显著下降.本实验结果显示,岩原鲤仔稚鱼的脂肪酶活性在生长发育前期显著升高(0~11 d),而后在30 d时达到峰值,随后显著下降到较低水平,在鲤科鱼类鲈鲤的研究中也显示出类似的变化趋势[13].
本研究显示,岩原鲤仔稚鱼的淀粉酶活性显著低于其他消化酶类.在西伯利亚鲟(Acipenserbaeribrandt)[24]、美国红鱼(Sciaenopsocellatus)[25]和大黄鱼(Pseudosciaenacrocea)[26]等鱼类的研究中同样发现仔稚鱼内源营养期的淀粉酶活性也很低,但是在摄入外源性营养物质后淀粉酶活性显著升高.而浮游动物等生物饵料中含有的碳水化合物也是诱导仔稚鱼淀粉酶合成和分泌增多的主要原因.但在亚马逊河琵琶鲶仔鱼阶段发现其具有较高的淀粉酶活性,其卵黄中大量沉积的糖原是诱导淀粉酶大量分泌的主要原因[12].因此,不同鱼类所表现出的淀粉酶活性差异与其摄食习性和消化生理状态有关.在岩原鲤仔稚鱼生长发育后期淀粉酶活性逐渐升高也表明其逐渐表现出杂食性的特点,能够相对较好地消化和利用饵料中的碳水化合物.碱性磷酸酶活性能够在一定程度上反映仔稚鱼肠道的发育状况[27].本实验结果显示岩原鲤仔稚鱼的碱性磷酸酶活性在发育初期(0~25 d)并无显著性变化,而后其活性显著升高并在35 d时达到峰值,表明此仔稚鱼在快速生长期其消化器官的发育也逐步发育成熟.在岩鲷的研究中发现其碱性磷酸酶活性在19 d时达到峰值,随后并无显著下降趋势,且其仔稚鱼碱性磷酸酶活性的变化规律与摄入饵料的脂肪组成密切相关[20].
前期研究发现,仔稚鱼消化器官发育和消化酶分泌受到饵料种类、营养组成以及饵料丰度的影响[28-29].本研究显示,岩原鲤仔稚鱼于饥饿状态下其胰蛋白酶和脂肪酶活性显著降低,而淀粉酶和碱性磷酸酶的活性略低于摄食组,表明其对饥饿状态不敏感.在鮸鱼(Miichthysmiiuy)的研究中则显示其脂肪酶和淀粉酶的活性未受饥饿状态显著影响,但饥饿后胰蛋白酶和碱性磷酸酶的活性显著低于摄食组[30].开口后于饥饿状态下,岩原鲤仔稚鱼12 d时的成活率为零,同样,在日本牙鲆(Paralichthysolivaceus)[31]的研究中也发现类似的实验结果.综上所述,岩原鲤仔稚鱼在孵化后即能够检测到消化酶的活性,并在30 d左右达到峰值,此时也是其生长速度较快时.岩原鲤于仔稚鱼阶段其胰蛋白酶和脂肪酶的活性较高,表明在仔稚鱼发育阶段蛋白质、氨基酸和脂肪是其主要的能量来源,而在饥饿状态下岩原鲤开口7 d后死亡,胰蛋白酶和脂肪酶的活性也显著降低;因此,在岩原鲤仔稚鱼发育阶段有必要为其提供含丰富蛋白质和脂类物质的饵料,以促进其生长发育.
- 海南大学学报(自然科学版)的其它文章
- 半潜式风力机平台撤除过程动力响应分析
- 多排冻结管斜型排布温度场发展规律数值分析

