IL-6对垂体瘤细胞的增殖、凋亡和自噬的影响
许哲鑫 杨巨亮 王位坐
垂体瘤占所有颅内肿瘤的15 %左右,当前在我国的发病率逐年上升并年轻化[1-2]。不过依然有部分垂体瘤存在一定的侵袭性,可导致周围结构浸润,导致预后变差[3]。当前炎症与肿瘤之间的关系已被广泛研究证实,接近20 %的机体肿瘤是由感染导致的慢性炎症产生[4-5]。白介素-6(Interleukin-6,IL-6)为临床上常见的炎症因子,在垂体腺瘤发生发展中起着重要作用[6]。并且IL-6也是炎症信号放大的关键结点,其调节基因包括细胞因子、丝氨酸蛋白酶、粘附分子等,均已证实与肿瘤的侵袭转移相关[7]。同时IL-6可与多TLR家族成员结合,可参与调节JNK等信号转导通路的激活,具有调节肿瘤和正常细胞的凋亡等功能[8-9]。细胞自噬又被称为Ⅱ型细胞死亡,通过溶酶体来吞噬蛋白质、细胞器,从而造成细胞死亡[10-11]。本文具体探讨了IL-6对垂体瘤细胞的增殖、凋亡和自噬的影响,以明确IL-6的作用效果与价值。现总结报告如下。
1 材料与方法
1.1 研究材料
大鼠垂体瘤细胞株GH3购自中国医学科学院基础医学研究所细胞资源中心,RPMI1640培养基购自英国Abcam公司,PCR引物、PCR试剂盒由日本Takara公司提供,抗LC3-Ⅱ抗体购自英国Abcam公司,HRP 标记羊抗兔二抗购自中杉金桥公司。
1.2 细胞分组与处理
将GH3细胞加入含10%胎牛血清的RPMI1640培养基中,置于37 ℃、5% CO2培养箱中培养。当细胞生长到70 %~80 %时,按1∶2~1∶4进行传代培养。
将细胞分为对照组、siR-IL-6组与siR-siR-NC组,siR-IL-6组与siR-NC组分别转染(Invitrogen Lipofectamine 3000 转染试剂盒)20 nmol/L的siR-IL-6质粒与siR-siR-NC质粒,转染后6 h后更换常规培养基进行培养。对照组不进行转染,以等体积的PBS代替。
siR-IL-6正向序列:5'GCAGGAUUCAACUCCAUUUdTdT-3',反向序列:5'-AAAAUGGAGUUGAAUCCUGCTdTdT-3'。
1.3 MTT法检测细胞增殖指数
收集各组对数生长期细胞,按5×103孔接种置于96孔板中,取5 mg/ml的MTT溶液20 μl加入每个细胞孔中,继续培养4 h。加入DMSO 200 μl充分溶解细胞内结晶,用上酶标仪于570 nm处检测个孔吸光度(记录OD)值,计算细胞增殖指数。
1.4 流式细胞术检测细胞凋亡指数
取数生长期细胞加入置于6孔板中,胰酶消化后留细胞,结合使用孵育缓冲液洗涤2次,离心去上清留细胞。加入结合缓冲液重悬细胞,加入20 μl FITC Annexin Ⅴ和5 μl PI混匀,避光孵育20 min。1 000 r/min离心5 min,去上清,使用孵育缓冲液清洗1次,在1 h内进行流式细胞仪检测分析,记录细胞凋亡指数。
1.5 流式细胞术检测细胞周期
收集各组对数生长期的GH3细胞,置于6孔板中,离心后留细胞去上清,PBS清洗细胞3次。加入1 mg/ml RNaseA 2 μl浓度为1 mg/ml的RNaseA,37 ℃水浴40 min。然后加入10 μl FITC Annexin Ⅴ和5 μl PI,室温下避光孵育20 min。离心去上清留细胞,用流式细胞仪检测测定各周期细胞周期细胞所占比例。
1.6 Western blot检测蛋白表达
收集各组对数生长期细胞,加入裂解液裂解细胞后,离心收集上清液,采用BCA法测定蛋白浓度,上样SDS-PAGE胶,采用加入1∶1 000 的抗LC3-Ⅱ抗体、抗GAPDH抗体4℃孵育过夜,TBST洗涤后加入1∶5000二抗IgG室温孵育1 h,TBST洗涤后以GAPDH内参蛋白作为内参照,将膜置于Imaging System化学发光成像系统进行自动曝光,以目的蛋白与内参蛋白照GAPDH的测定的结果灰度值之比表示目的蛋白的相对表达量进行比较。上述每项实验都重复3次,取平均值。
1.7 统计学方法

2 结果
2.1 细胞增殖指数对比
转染后24 h与36 h,siR-IL-6组的细胞增殖指数显著低于siR-NC组与对照组(P<0.05),siR-NC组与对照组对比差异无统计学意义(P>0.05),见表1。
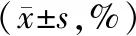
表1 三组转染后不同时间点的细胞增殖指数对比
2.2 细胞凋亡指数对比
转染后24 h与36 h,siR-IL-6组的细胞凋亡指数显著高于siR-NC组与对照组(P<0.05),siR-NC组与对照组对比差异无统计学意义(P>0.05),见表2。
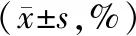
表2 三组转染后不同时间点的细胞凋亡指数对比
2.3 细胞周期对比
转染后36 h,siR-IL-6组的G1期细胞比例显著高于siR-NC组与对照组(P<0.05),S期细胞比例显著低于siR-NC组与对照组(P<0.05),siR-NC组与对照组对比差异无统计学意义(P>0.05),见表3。
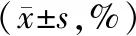
表3 三组转染后36 h的细胞周期
2.4 LC3-Ⅱ蛋白表达水平对比
转染后24 h与36 h,siR-IL-6组的LC3-Ⅱ蛋白相对表达水平显著高于siR-NC组与对照组(P<0.05),siR-NC组与对照组对比差异无统计学意义(P>0.05),见表4。

表4 三组转染后不同时间点的LC3-Ⅱ蛋白相对表达水平对比
3 讨论
当前已有多个生物学特征通常用于垂体瘤的诊治以及预后评估,包括组织学分级、淋巴结受累等,但是很多患者有相似的生物学特征却有显著不同的临床预后,寻找新的方法用于垂体瘤的早期诊治与预后预测就具有重要价值[12-13]。
IL-6是1种具有多功能自分泌或旁分泌的生长因子,对肿瘤细胞起着刺激增殖和抑制分化的双向调节作用[14]。IL-6是gp130家族中重要的信号蛋白,主要由垂体前叶滤泡星形细胞生成[15]。IL-6到达垂体细胞不只依靠血循环,垂体细胞自身也可释放IL-6,从而致垂体细胞生长阻滞、激素分泌减少[16]。不过不同信号通路的激活或抑制IL-6/gp130复合物结合,会导致IL-6在正常组织和垂体瘤组织中不同的影响。并且IL-6还能够刺激血管生成促进肿瘤细胞增殖,抑制肿瘤细胞凋亡,刺激远处转移和对化疗药物产生耐药性[17]。本研究显示转染后24 h与36 h,siR-IL-6组的细胞增殖指数显著低于siR-NC组与对照组,siR-NC组与对照组对比差异无统计学意义;转染后36 h,siR-IL-6组的G1期细胞比例显著高于siR-NC组与对照组,S期细胞比例显著低于siR-NC组与对照组,siR-NC组与对照组对比差异无统计学意义,表明抑制IL-6的表达能调节垂体瘤细胞周期,从而抑制垂体瘤细胞的增殖。
在当前垂体瘤的发展机制研究中,多是从垂体瘤自身基因、翻译蛋白异常、染色体变化,转录及转录后修饰等多个层面进行研究分析[18]。在不同类型的恶性肿瘤中,IL-6发挥作用及表达水平不尽相同,可发挥抑癌或促癌作用,还可从其特异性的角度出发进行相应的调控,从而对上下游相关蛋白进行反馈调节[19-20]。本研究显示转染后24 h与36 h,siR-IL-6组的细胞凋亡指数显著高于siR-NC组与对照组,siR-NC组与对照组对比差异无统计学意义,表明抑制IL-6的表达能促进垂体瘤细胞的凋亡。当前研究显示IL-6可通过AKT蛋白影响肺癌细胞下游PI3K/AKT/mTOR通路,对下游因子产生抑制作用,从而有利于细胞凋亡[21-22]。
LC3-Ⅱ是自噬体形成过程中的关键分子,其表达水平能够直接反应自噬的活力[23]。而肿瘤的肿瘤微环境存在差异,可导致自噬产生和自噬绕过,早期产生的自噬是对肿瘤增殖及恶化的限制和调整,分泌过多的IL-6就是机体对自噬的1个适应调整机制[24]。本研究显示转染后24 h与36 h,siR-IL-6组的LC3-Ⅱ蛋白相对表达水平显著高于siR-NC组与对照组,siR-NC组与对照组对比差异无统计学意义,表明抑制IL-6的表达能促进细胞自噬。本研究也有一定的不足,IL-6在乳腺癌中的靶基因是否是LC3-Ⅱ还不明确,且具体的作用机制还不明确,特别是IL-6的功能研究也不能脱离具体环境。
总之,在垂体瘤细胞中抑制IL-6表达能促进细胞凋亡与自噬,调节细胞周期,从而抑制细胞增殖。

