MnO2催化臭氧氧化模拟草酸废水
张鸿敏,贾青竹,吕江涛,闫方友,王 强
(1. 天津科技大学海洋与环境学院,天津 300457;2. 天津科技大学化工与材料学院,天津 300457)
草酸(OA)是一种重要的化工原料,并能与金属发生络合或螯合作用,草酸在医药和化工废水中广泛存在[1-2].另外,草酸是复杂结构有机物臭氧氧化降解过程中形成的难降解小分子有机物之一,直接影响有机污染物最终的矿化程度[3].
草酸废水常用的处理工艺主要有碱中和处理法、石灰沉淀填埋法[4]和芬顿氧化法[5]等.碱中和处理和石灰沉淀填埋法的缺点是能耗大、对环境污染严重;芬顿氧化法处理会产生大量铁泥且双氧水消耗巨大,废水处理成本高.
臭氧高级氧化技术可以去除水体中的难分解有机污染物,无二次污染且操作简单,在废水处理行业中有着广泛的应用[6].由于单独臭氧氧化对污染物的降解具有选择性,致使对一些小分子有机物比如各类醛、丙酮、羧酸、醇等无法完全降解[7].催化臭氧氧化技术是一种新兴氧化技术,催化剂能够增强臭氧的分解并形成羟基自由基(·OH),利用·OH 有效降解目标污染物[8].罗梦玉等[9]用羟基氧化镍催化臭氧氧化草酸废水(80mg/L),与单独臭氧氧化过程相比,草酸浓度的去除率显著提高.杨玉飞等[10]利用载锰氮化碳催化臭氧氧化草酸废水(80mg/L),在 60min内草酸总有机碳(TOC)去除率可以达到89.1%.Yan等[11]利用 Fe-SBA-15催化臭氧氧化 20mg/L草酸废水,60min时草酸的去除率可达 86.6%.然而,目前臭氧催化氧化处理高浓度草酸废水的研究鲜有报道.
研究表明过渡金属氧化物 MnO2在臭氧催化氧化过程中具有良好的催化能力[12-14].赵朝成等[12]选用腈纶废水作为实验用水,MnO2/O3对废水中有机物的去除率最高,20min时 COD去除率可达 40%(腈纶废水初始 COD 为 1500mg/L).王春雨等[13]采用水溶液化学沉积法制备 δ-MnO2,应用于催化臭氧化亚甲基蓝,不仅具有良好的脱色效果,并具有一定的矿化能力.冯林强等[14]制备纳米 MnO2/还原态氧化石墨烯催化臭氧降解苯酚,反应 30min催化臭氧化降解300mg/L苯酚的去除率高达86.3%.
本工作利用MnO2作为催化剂,对比了单独臭氧氧化、MnO2催化剂吸附和 MnO2催化臭氧氧化 3个体系对模拟草酸废水 COD(草酸初始质量浓度500mg/L)的去除率,考察不同催化剂投加量对模拟草酸废水处理效果的影响,基于独立反应理论分析了MnO2/O3体系中草酸的降解动力学,并与实验拟合动力学进行验证分析.
1 材料与方法
1.1 实验试剂
草酸、98%浓硫酸、硫酸亚铁铵,分析纯,天津市风船化学试剂科技有限公司;二氧化锰、硫酸银、邻菲 啰 啉、硫酸亚铁,分析纯,天津市光复科技发展有限公司;硫酸汞,分析纯,国药集团化学试剂有限公司;重铬酸钾,分析纯,天津市大茂化学试剂厂.实验所使用的超纯水由Milli-Q system制备.
1.2 实验装置
MnO2催化臭氧氧化模拟草酸废水的装置流程如图1所示.

图1 实验装置流程图Fig. 1 Flow chart of experimental set
臭氧发生器型号为 MF-S-10,臭氧产量为10g/h. 臭氧反应器为自制的圆柱形玻璃反应器.连接管均为硅胶管.布气装置为球形曝气头,连续进气.实验采用间歇的批处理方式.
1.3 实验方法
配制 1L模拟草酸废水(草酸初始质量浓度为500mg/L,初始 COD 89mg/L)于反应器中,留取5mL原液,称取一定量的 MnO2催化剂放入模拟草酸废水中,机械搅拌.吸附平衡后开启臭氧发生器进行曝气.反应一定时间后取样,样品经过针式过滤器过滤.过滤后的样品按照重铬酸钾滴定法测定COD,计算COD去除率.

式中:R为 COD 去除率,%;COD0为废水初始COD,mg/L;CODt为 t时刻废水的 COD,mg/L.
2 结果与讨论
2.1 不同体系中模拟草酸废水COD去除效果
实验对比了单独臭氧氧化、MnO2催化剂吸附和MnO2催化臭氧氧化 3个体系对模拟草酸废水 COD的去除率,结果如图2所示,其中,MnO2催化剂的投加量为0.167g/L.从图2中可以看出:单独臭氧体系中模拟草酸废水的 COD去除率不到 5%.由于臭氧分子与草酸的直接反应速率常数≤4×10-2L/(mol·s),此过程反应速率较慢,导致单独臭氧对草酸废水COD去除率较低.当加入0.167g/L MnO2催化剂后,20min吸附平衡时 COD去除率达到 20.83%.该反应体系中分散的 MnO2能吸附 H2O分子,并将 H2O分子分解成 OH-和 H+,形成表面羟基,表面羟基具有离子交换性质,因而表面羟基成为主要的吸附中心.另外,MnO2上 Lewis酸位点能协调 Lewis碱分子,这些位点极具反应性,MnO2表面对羧酸阴离子具有较高亲和力[15].因此,单独 MnO2催化剂对模拟草酸废水有一定的吸附作用.当体系吸附平衡后开始通入臭氧,MnO2(0.167g/L)催化臭氧氧化草酸废水时 COD去除率提高到 44.44%.MnO2促进水环境中臭氧分解产生·OH,·OH 的氧化能力强(E0=2.8V),且草酸与·OH 的反应速率常数≤1.4×106L/(mol·s),该常数远高于臭氧与草酸的直接反应速率常数[16].因此,MnO2催化剂和臭氧能够协同促进草酸的降解.

图2 不同体系对模拟草酸废水COD去除效果Fig. 2 COD removal efficiency of simulated oxalic acid wastewater in different systems
此外,在 MnO2/O3体系中,Mn4+/Mn3+在反应中发生电子的转移,生成另一部分·OH,提高催化活性,实现对有机物的彻底氧化(反应式(1)—(4))[17].

2.2 MnO2投加量对模拟草酸废水COD去除的影响
MnO2的投加量直接影响着目标污染物的降解率,因此在草酸的初始质量浓度为 500mg/L,初始COD为 89mg/L,总反应时间为 60min的条件下考察MnO2催化剂投加量对模拟草酸废水的降解效果,实验结果如图3所示.由图3可知:随着MnO2催化剂投加量从 0.167g/L增加到 0.500g/L,反应 60min后,COD去除率从 44.44%提高到 85.87%;MnO2催化剂投加量继续增加至 0.668g/L,COD去除率稍下降至80.69%.总体而言,随着MnO2催化剂投加量的增加,模拟草酸废水的 COD去除率呈现先升高后降低的趋势.随着催化剂投加量的增加,臭氧与催化剂的接触面积增加,由于催化活性位点的数量增加,更多的臭氧被催化产生·OH,促进了草酸的降解[18].但是催化剂投加量过多时,会降低催化剂单位面积上草酸与臭氧的接触浓度,导致 COD去除率下降[19].因此,本实验体系中,MnO2催化臭氧氧化模拟草酸废水的最佳投加量为0.500g/L.

图3 催化剂投加量对模拟草酸废水 COD去除效果的影响Fig. 3 Effect of catalyst dosage on COD removal efficiency of simulated oxalic acid wastewater
2.3 动力学分析
为了进一步探究 MnO2催化剂投加量对模拟草酸废水 COD去除率的影响,进行动力学分析.对于表面吸附-催化反应过程,动力学分析考虑了两种情况:一是考虑催化剂吸附的去除率效果,建立表面吸附-催化反应动力学;二是单独考虑此过程的催化反应动力学.
2.3.1 吸附-催化反应动力学
考虑了催化剂吸附的去除率贡献,不同催化剂投加量体系中COD去除浓度对数图的线性拟合结果如图4所示.根据图4建立了准一级动力学方程,结果见表 1.由表 1可知:所有实验体系中准一级动力学方程的相关性系数均达到0.9以上,说明MnO2催化O3氧化对模拟草酸废水降解符合准一级动力学.

图4 不同催化剂投加量体系中-ln(CODt/COD0)与时间的关系Fig. 4 Relationship between -ln(CODt/COD0) and time with different catalyst dosage

表1 不同催化剂投加量对模拟草酸废水降解动力学的影响Tab. 1 Effect of different catalyst dosage on degradation kinetics of simulated oxalic acid wastewater
催化剂投加量影响效果显著性检验(P检验)表明,所有P值均远小于 0.05,说明 MnO2催化剂投加量显著影响模拟草酸废水 COD的去除效率.当MnO2投加量由 0.167g/L增加到 0.500g/L时,动力学常数由 0.0108min-1升高到 0.0288min-1,说明随着 MnO2催化剂投加量的增加,模拟草酸废水 COD的去除效率逐渐升高.而MnO2催化剂投加量升高至0.668g/L时,动力学常数随之下降至0.0256min-1.
2.3.2 催化反应动力学
若不考虑催化剂吸附的去除率贡献,进行动力学分析其降解过程,结果如图5所示,根据图5建立了准一级动力学方程,结果见表 2.由表 2可知:所有实验体系中准一级动力学方程的相关性系数均达到0.9以上,说明不考虑催化剂吸附的影响,MnO2催化臭氧氧化对模拟草酸废水的降解过程仍然符合准一级动力学.

图5 不同催化剂投加量体系中-ln(CODt/COD0)与时间的关系(反应阶段)Fig. 5 Relationship between -ln(CODt/COD0) and time with different catalyst dosage(reaction stage)

表2 不同催化剂投加量对模拟草酸废水降解动力学的影响(反应阶段)Tab. 2 Effect of different catalyst dosage on degradation kinetics of simulated oxalic acid wastewater(reaction stage)
2.4 MnO2/O3体系降解草酸的独立反应验证
对于 MnO2/O3氧化降解草酸体系,假设草酸能被彻底氧化实现完全矿化,则在反应体系中主要存在以下组分:H2C2O4、O3、·OH、H2O 和 CO2,则化学计量系数矩阵[20]可写为

据此,矩阵A的秩为rA=3,A′为独立组分矩阵,Adep为非独立组分矩阵,e为各组分原子组成空间的基底,取

求解矩阵方程,得此体系的 2个独立反应,分别为反应式(5)和(6):

整理后得

结合实际反应条件,可以确定反应式(5)、(6)和(7)是 MnO2/O3体系降解草酸的独立反应.反应式(5)、(6)和(7)表明,臭氧经催化产生·OH,·OH 再促进草酸的降解,与催化臭氧氧化降解有机物的机理一致.由此推断,使用独立反应组即反应式(5)、(6)和(7)描述MnO2/O3体系氧化降解草酸是合理的.
另外,假设草酸不能被彻底氧化实现完全矿化,则在反应体系中可能存在中间产物.根据草酸、甲酸和乙酸的热力学性质可知,草酸、甲酸和乙酸的标准吉布斯生成自由能分别为:-161.1、-361.4、-389.9 kJ/mol,由此判断ΔG<0,说明草酸氧化产生甲酸和乙酸中间产物也是可能的.因此,若考虑到可能的中间产物甲酸(HCOOH)和乙酸(CH3COOH),则反应体系的化学计量矩阵表示为

这样,矩阵B的秩为rB=3,取

求解矩阵方程,分别为反应式(8)和(9):
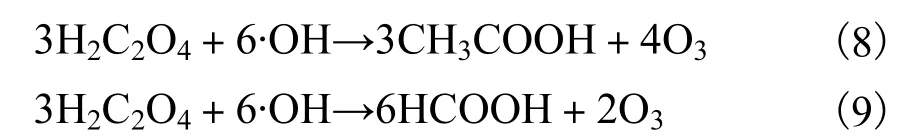
在反应式(8)和(9)中,作为反应物的 O3出现在方程的右边,这与反应条件不相符合.因此,通过独立方程式验证,在草酸降解过程中很难形成中间产物乙酸和甲酸,而是实现了彻底的分解矿化.
假设独立反应式(7)的动力学常数为 k,根据反应动力学方程得

由此式可知,MnO2/O3体系氧化降解草酸的独立反应符合一级动力学.结合表 1、表 2中不同催化剂投加量对 MnO2/O3体系中草酸降解动力学分析,理论推演独立反应和实验数据的动力学拟合一致,二者均表明 MnO2/O3体系氧化降解草酸过程符合准一级动力学.
3 结 论
MnO2/O3能够协同促进草酸的降解,与单独臭氧氧化相比,MnO2/O3对模拟草酸废水 COD的去除效果增加,MnO2投加量显著影响 COD的去除效果.MnO2最佳投加量为0.500g/L时COD(草酸初始质量浓度500mg/L,初始COD质量浓度89mg/L,反应时间 1h)的去除率高达 85.87%,MnO2催化臭氧氧化处理高浓度草酸废水(500mg/L)具有可行性.其中,COD的降解过程符合准一级动力学方程,相关性系数均在 0.9以上.独立反应理论分析表明,草酸分子可被直接氧化和彻底矿化,进一步验证了草酸分解过程符合准一级动力学反应.

