基于美国临床试验数据库的罕见病临床试验现状研究及启示
周 萍,康 怡,张东肃,刘丽宏(首都医科大学附属北京朝阳医院药事部,北京 100020)
罕见病是一项重大的、全球性的公共卫生问题。据估计,全世界有7 000多种罕见病,2.5亿多例罕见病患者,但仅有不到10%的疾病“有药可医”[1]。绝大多数罕见病仍然缺乏有效的诊断和治疗方法,罕见病用药情况不容乐观。依据《2019中国罕见病药物可及性报告》,我国罕见病患者面临诊断难、诊断后无药可医、治疗药物未在我国上市和已上市药品价格昂贵等困难,药物可及性存在极大障碍。我国颁布的第1批罕见病目录中,仅有53种疾病在我国境内有获批的治疗药物,只包含83种药物。目前,我国学者对罕见病问题的研究集中于政策激励、救治保障、孤儿药可及性和医保准入等国内外经验、模式等方面,专门针对罕见病临床研究的讨论和议题相对较少[2]。罕见病临床研究不但可以为罕见病患者提供更多获得诊断、治疗和康复的机会,还能够评估一些现有诊疗方法和药物的安全性和有效性,提高罕见病患者获得有效治疗的可能性,提高患者用药的可及性。因此,分析罕见病临床试验发展的现状和特点,了解国际罕见病临床试验研究的态势,具有重要的研究意义。本研究旨在通过具体的数据分析及文献研究,探讨罕见病临床试验研究的现状和特点,了解国际研究态势,最终为罕见病临床试验管理提供参考,为完善罕见病临床试验研究提出相关的建议。
1 资料与方法
1.1 研究对象
本研究的研究对象为罕见病临床试验,是将罕见病作为主要研究对象或研究重点的来自全球各地的临床试验,即以罕见病为关注点的临床试验。
1.2 数据来源
本研究选取美国临床试验数据库(ClinicalTrails.gov)进行数据采集和分析。ClinicalTrails.gov临床试验平台包含了来自全球各地注册的罕见病临床试验,具有一定的代表性。ClinicalTrails.gov是由美国国家医学图书馆和美国食品药品管理局共同创办的,该平台符合国际医学杂志编辑委员会对临床试验注册库创建和管理的标准,是目前国际上具有较高影响力的临床试验注册平台之一,也是应用最为广泛的临床试验注册平台[3-4]。
1.3 检索策略与路径
以所有罕见病主题词为检索条件,在ClinicalTrails.gov平台上全面检索针对罕见病的临床试验。根据MeSH主题词表,罕见病的主题词包括“Rare Diseases”“Disease, Rare”“Diseases, Rare”“Rare Disease”“Orphan Diseases”“Disease, Orphan”“Diseases, Orphan”和“Orphan Disease”。依据ClinicalTrails.gov对临床试验注册各要素的定义,“条件和关键词”(“Conditions and Keywords”)即指临床试验的主要研究对象[4],因此,主要在该字段下进行检索。
2 结果
2.1 罕见病临床试验注册数量及发展趋势
截至2019年10月31日,已有481项针对罕见病的临床试验在ClinicalTrails.gov平台进行了注册。以注册的临床试验开始日期为依据进行检索和分析发现,罕见病临床试验数量呈现出“先增加后减少、先大幅后小幅”的波动变化趋势。在早期,罕见病临床试验极少,但1990—1999年的10年间,罕见病临床试验数量总体上大幅增加,此后逐渐减少;近十年来,每年都有新的罕见病临床试验在全世界开展,基本保持在10~20项,见图1。

图1 基于ClinicalTrails.gov平台的罕见病临床试验数量变化趋势Fig 1 Trend of clinical trials of rare diseases based on ClinicalTrails.gov
2.2 罕见病临床试验地域分布特征
481项已注册的罕见病临床试验的全球地域分布差异大,主要分布于北美洲(共255项,占53.01%),其次为欧洲(共71项,占14.76%),其他地区数量相对较少,见图2(图片来源:https://ClinicalTrails.gov)。

图2 罕见病临床试验全球分布图Fig 2 Global distribution of clinical trials of rare diseases
经济发达的国家和地区成为罕见病临床试验研究的“主力军”,这些国家和地区大都颁布了相关的“罕见病计划”。从注册数量看,美国注册的罕见病临床试验最多,共233项;其次为法国,共33项;意大利、加拿大、英国和德国等均约10~20项;其余地区均<10项,我国仅有4项。开展罕见病临床试验较多的国家基本都颁布了较高层面的促进罕见病诊疗保障和研究的计划或战略,如美国的《孤儿药法案》、法国的“罕见病国家计划”和英国的“罕见病国家战略”,德国、意大利也发布了“罕见病国家行动计划”等,这些国家高度重视罕见病议题,将其上升到国家层面[1]。
2.3 罕见病临床试验研究类型及进展
从研究类型来看,481项已注册的罕见病临床试验主要为干预性研究,共有329项,占68.40%;观察性研究150项,占31.19%;还有2项为拓展性应用。干预性研究中,无分期的临床研究数量最多,其次为Ⅱ、Ⅲ期临床试验,Ⅳ期临床试验最少,见图3。无分期的临床试验包括了部分器械、行为干预研究和探索性新药研究,即0期临床试验,如微剂量研究、筛选研究等。探索性临床试验受试者数量极少,研究周期通常<7 d,能够快速得到候选药物药动学等方面的重要数据,节约了大量的时间、经济成本,已被国外很多地区主张用于抗肿瘤新药的研发[5]。罕见病药物临床试验成本高,周期长,研究投入产出效益低,适当的探索性临床试验对于降低成本、提高效率具有重要价值和意义。
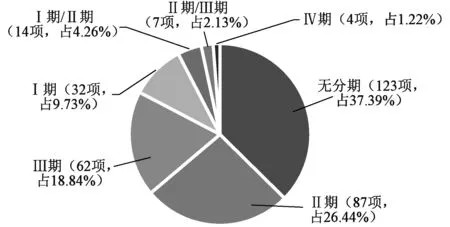
图3 罕见病临床试验研究阶段分布Fig 3 Stage of clinical trials of rare diseases
大多数罕见病临床试验已经完成(316项,占65.70%);剩余临床试验中,招募受试者、未知状态的临床试验相对较多,均有61项,分别占12.68%;还有部分试验已经暂停或撤回。已完成的罕见病临床试验大多始于2000年以前。61项正在招募受试者的临床试验中,约60%的招募时间≥3年,约36%的招募时间≥5年,甚至有6项试验招募时间已超过10年。罕见病确诊难、缺乏对患者群体所在地的了解等,导致部分试验需要数年才能达到受试者招募目标。
2.4 罕见病临床试验研究设计方案特点
(1)329项干预性研究中,149项为随机干预,非随机干预20项。从干预研究模型来看,大多数试验没有注明干预模型类别,而其余的试验中,采取单臂试验的研究相对较多,其次为平行对照研究,交叉研究相对较少,见表1;在明确了盲法设计类型的试验中,98项采取了盲法,74项为开放性试验,见表2。(2)150项观察性研究中,除了未注明的研究外,前瞻性研究占比最高,见表3;从观察性研究模型看,以队列研究为主,其次为单纯病例研究,而病例对照试验相对较少,另外还有自然史研究、家族型研究等,见表4。

表1 干预模型设计类别分布情况Tab 1 Distribution of intervention model design category
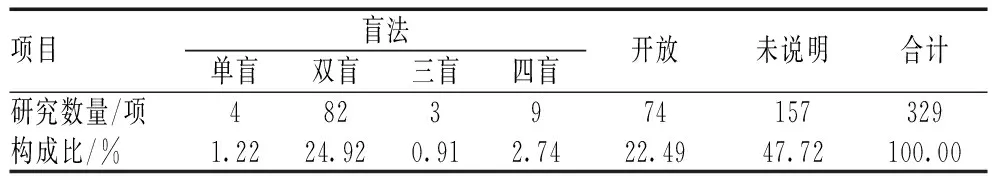
表2 干预性研究盲法设计情况Tab 2 Design of blind method of intervention study

表3 观察性研究类型分布情况Tab 3 Distribution of time perspective design type and quantity in observational research

表4 观察模型设计情况Tab 4 Design type of observational model
2.5 罕见病临床试验受试者情况
从受试者规模来看,受试者数量在21~100例范围内的临床试验最多,其次为纳入1~20、101~500例受试者的试验,见图4。48项纳入受试者>500例的临床试验中,绝大多数为观察性研究(34项,占70.83%);而纳入受试者≤500例的临床试验以干预性研究为主。ClinicalTrails.gov平台对受试者数量的定义为“预估的纳入总数(目标人数)或实际的临床研究参与者总数”,因此,本研究讨论的受试者规模指实际已纳入或拟纳入的受试者数量。
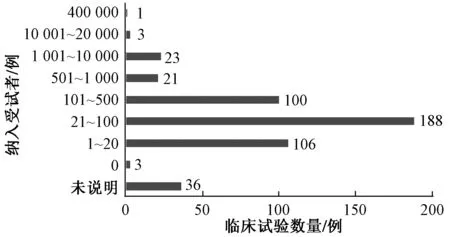
图4 罕见病临床试验受试者规模情况Fig 4 Scale of enrollment in clinical trials of rare diseases
2.6 罕见病临床试验研究的主要目的和疾病领域
从研究目的来看,481项已注册的罕见病临床试验中,大多数研究以治疗为目的,共有292项,占60.70%;其次是以筛查、诊断为目的的研究;其他还有以教育、心理咨询和训练、基础科学研究以及支持治疗等为目的的研究。
ClinicalTrails.gov平台注册的罕见病临床试验涉及523种罕见病和症状,研究数量排序居前10位疾病领域分别为代谢病(137项),神经系统疾病(114项),皮肤和结缔组织病(114项),心血管及淋巴系统疾病(101项),免疫系统疾病(97项),与腺体或激素相关的疾病(87项),肌肉、骨骼和软骨疾病(85项),行为与精神障碍(82项),消化系统疾病(70项)和呼吸系统疾病(70项)。从涉及的具体疾病及症状来看,神经鞘脂病、囊性纤维化、范科尼综合征、卟啉症和先天性氨基酸代谢紊乱等疾病相关的临床试验相对较多。
3 讨论
针对罕见病治疗的临床试验,需要依据其特点,探索更多适宜的新方法和新思路。罕见病发病率极低、患病总人数极少、种类多和诊断难等特点,决定了罕见病研究难以开展大量随机对照试验。因此,有必要探索符合罕见病临床试验特点的研究方法,如采取适应性研究设计方法、随机撤药设计和单病例随机对照试验等[6]。
应加强罕见病自然史研究,以促进罕见病药物研发和诊疗手段的进步。疾病自然史的研究有助于识别和诊断罕见病,了解罕见病发病机制或进展,预测疾病进程,确定合适的临床研究结局指标,为临床试验提供外部对照等[7]。因此,在现阶段加强罕见病自然史和流行病学方面的研究,尤其是针对患病率相对较高、危害相对更大的罕见病,能够为罕见病的早发现、早诊断、早治疗以及完善临床试验研究提供重要依据和参考,为长远的罕见病相关研究夯实基础。
我国罕见病临床试验研究相对较少,研究能力有待加强,罕见病患者接受诊疗的可及性有待提高。一方面,我国罕见病诊疗领域创新能力和积极性严重不足,罕见病临床试验开展相对较少[8];另一方面,我国罕见病治疗药物绝大部分依赖进口,大量罕见病患者面临“无药可医”的困境,包括可及性和可负担性带来的“无药”困境。据统计,我国《第一批罕见病目录》列举的121种罕见病中,只有36种疾病对应的60余种药品获得了批准上市,而只有27种在我国获得了上市资格,约50%的药品完全依赖进口[9]。从长远看,完善法律法规,大力支持罕见病临床研究,培养专业型研究人才,建立专业化的临床研究基地等,对逐步解决我国罕见病问题,摆脱被动的罕见病诊疗药品、技术依赖,具有积极的现实意义。
综上所述,本研究从多角度分析了罕见病临床试验的现状和特点,并结合罕见病具体特征和我国实际情况提出了部分罕见病临床试验发展和管理的建议和意见,但尚存在一定的局限性。主要在于数据来源比较单一,虽然ClinicalTrails.gov平台是全球运用较广泛的临床试验注册平台之一,也得到了国际专家和权威性学术机构及出版物的认可,但是由于检索方式限制、注册字段缺失等,存在一定的“遗漏”,尤其是某些针对罕见病但未标注“罕见病”关键词造成的遗漏。虽然我国罕见病临床研究和罕见病患者的诊断、治疗及康复等方面与一些发达国家还存在差距,但随着国家和公众对罕见病重视程度的不断提高,对罕见病研究的不断深入,相信无论是科研还是临床实践都将取得更多进步和成绩。

