经多色流式细胞术确诊多发性骨髓瘤并发恶性胸腔积液6例临床特征分析
王梦园 马莉 管俊
多发性骨髓瘤(multiple myeloma,MM)为血液系统发病率位居第二位的恶性肿瘤,是起源于B细胞的恶性克隆性浆细胞疾病。通常骨髓瘤细胞仅局限于骨髓,但其也可扩散并渗透到其他部位,如胸膜、淋巴结和肺脏等[1],从而产生恶性胸腔积液(malignant pleural effusion,MPE)。本研究主要探讨由更为敏感的多色流式细胞术(flow cytometry,FCM)确诊的6 例MM并发MPE患者的临床特点、实验室指标和转归情况,旨在强调FCM 对MPE 的诊断价值及增加对MM并发MPE患者临床特点的认识。
1 材料与方法
1.1 病例资料
分析2016年7月至2019年10月江苏省苏北人民医院经FCM诊断的6例MM并发MPE患者,其中男性4 例,女性2 例,年龄范围49~72 岁,中位年龄62岁。MM的诊断标准采用国际骨髓瘤工作组(IMWG)指南。胸腔积液的诊断标准为影像学检查(胸部X线、胸部CT或超声)发现胸腔积液同时行胸腔穿刺检查。MPE的诊断则依据胸水脱落细胞学检查和(或)FCM 检查。按照Durie-Salmon(DS)分期体系及国际分期系统(ISS)进行分期,按照血清肌酐水平分组。
1.2 方法
1.2.1 资料收集 收集患者的临床资料,包括年龄、性别、分期、分型和出现胸腔积液的时间以及随访截至2020年5月1日患者的总生存时间,同时收集患者的实验室指标,胸水常规、生化及脱落细胞学检查,对所有胸腔积液进行FCM检测。
1.2.2 主要试剂及仪器 CD38-FITC/CD56-PE/CD19-PerCP/CD138-APC、CD138-FITC/CD117-PE/CD28-PerCP/CD27-APC、CD200-PE/CD45-PerCP/CD138-APC、κ-FITC/λ-PE/CD138-APC、溶血素、破膜剂,上述试剂均购自美国贝克曼库尔特公司。Dx⁃FLEX流式细胞仪购自美国贝克曼库尔特公司。
1.2.3 实验方法 多色流式细胞法:取新鲜胸腔积液200~500 mL,过滤后以肝素抗凝,以1 000 r/min的速度离心5 min,弃上清液,PBS洗涤2次,细胞沉淀用PBS制成细胞浓度为106/mL的单细胞悬液,分成5管,分别加入100 mL单细胞悬液,1管为空白对照,2、3、4 管 加 入CD38- FITC/CD56- PE/CD19- PerCP/CD138-APC、CD138-FITC/CD117-PE/CD28-PerCP/CD27-APC、CD200-PE/CD45-PerCP/CD138-APC、κ-FITC/λ-PE/CD138-APC 抗体各10 μL,充分混匀,于室温避光孵育15 min,加入1∶9 配制的溶血素2 mL,避光8 min 后,以1 000 r/min 的速度离心5 min,弃上清液,PBS 缓冲液0.5 mL 再悬浮细胞。第5 管加入1号固定剂,于室温避光孵育15 min,加1 mL PBS缓冲液震荡,以1 000 r/min 的速度离心5 min,弃上清液,加入2 号固定剂,静置5 min,加入κ-FITC/λ-PE/CD138-APC 抗体各10 mL,充分混匀,于室温避光孵育15 min,加1 mL PBS 缓冲液震荡,以1 000 r/min 的速度离心5 min,弃上清液,PBS缓冲液0.5 mL再悬浮细胞,用DxFLEX 流式细胞仪进行检测,采用Cytex⁃pert 软件获取与分析数据。建立FSC/SSC,每管获取20 000个细胞,根据同型对照分析。检测细胞CD19、CD38、CD45、CD56、CD138和κ、λ的表达情况。
脱落细胞学检查:取胸腔积液标本10 mL,1 500 r/min离心5 min,弃上清液留取沉淀物,混匀后制片,经自然干燥后用瑞-姬染色,光镜下进行细胞学分析。
1.3 统计学分析
采用SPSS 26.0软件进行统计学分析。研究中连续变量以±s表示,分类变量以率(构成比)表示,相关性分析双变量正态分布采用Pearson 相关性分析,不符合双变量正态分布采用Sperman 相关性分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征
按照ISS 分期:Ⅰ期1 例,Ⅱ期4 例,Ⅲ期1 例。DS 分期:Ⅰ期1 例,Ⅱ期2 例,Ⅲ期3 例。6 例患者均为A 组。分型:IgA-κ 型1 例,IgG-κ 型1 例,IgA-λ 型2例,IgG-λ型1例,κ轻链型1例。其中4例为早发性渗出,另外3 例为迟发性渗出,早发性渗出被定义为在MM 诊断时或在第1 个化疗周期发生的渗出。迟发性渗出是指在第1个周期化疗后发生的渗出[2],见表1。
2.2 胸腔积液特征
2.2.1 胸腔积液部位及性质 6例MPE患者中,所有患者均出现双侧大量胸腔积液,胸腔积液颜色1例为红色,1例为浅黄色,4例为黄色。李凡他试验中4例阳性,2例弱阳性。6例胸水中乳酸脱氢酶(lactate de⁃hydrogenase,LDH)水平76~1 328 U/L(中位88 U/L),腺苷脱氨酶(adenosine deaminase,ADA)0~51 U/L(中位45 U/L),白细胞17×106~742×106/L(中位135.5×106/L),单个核细胞数13×106~680×106/L(中位124.5×106/L)。6 例患者行胸腔积液脱落细胞学检查,镜下见淋巴细胞等炎症细胞及间皮细胞,均未见癌细胞。
用多色流式细胞仪对6 例患者的胸水进行免疫表型分析,表达的浆细胞分别占有核细胞数的59.10%、0.71%、1.34%、1.90%、0.38%和29.80%。表2总结了6例患者的胸水骨髓瘤细胞免疫表型。
2.2.2 胸水浆细胞百分比与常规实验室指标相关性分析 分析6 例经FCM 确诊的MM 并发MPE 患者胸水浆细胞比例与常规实验室指标,结果显示胸水浆细胞比例与胸水总蛋白、白蛋白、球蛋白、LDH水平、ADA 及初诊时骨髓浆细胞比例成正相关(P<0.05),与胸水常规红细胞数、单个核细胞数、白细胞数以及血清血红蛋白、血小板、总蛋白、白蛋白、LDH 水平、ADA、β2-微球蛋白均无明显相关性(P>0.05)。见图1,表3。
2.3 治疗及转归
随访截至2020年5月1日,共有4 例(66.7%)MPE 患者死亡,2 例(33.3%)患者存活。病例1 在确诊MPE 17 个月后死于疾病进展。病例2 在第1 次PAD(硼替佐米+多柔比星+地塞米松)方案化疗中出现MPE,经3 个疗程PCD(硼替佐米+环磷酰胺+地塞米松)方案治疗后,胸腔积液基本消失,此后患者未予治疗,4 个月后疾病进展,最终死于浆细胞白血病。病例3 出现心肌淀粉样变,给予PTD 方案(硼替佐米+沙利度胺+地塞米松)化疗后胸水未消失,通过FCM找到异常浆细胞,后改为PCD方案,最终死于疾病进展。病例4 入院时即存在MPE,经过2 个疗程PTD 方案治疗后,患者出现呼吸心跳骤停,心肺复苏后转入重症监护室,最后死亡。病例5 在第1 次PCD方案化疗结束后出现MPE,后改为BRD方案(硼替佐米+来那度胺+地塞米松),因出现全身广泛皮疹,考虑来那度胺过敏,给予BD 方案(硼替佐米+地塞米松)化疗,胸腔积液未消失,后未于本院治疗,目前仍然生存。病例6经2个疗程PCD方案后,胸腔积液基本消失,第3 个疗程结束后骨髓示缓解期骨髓象,游离轻链阴性,后行第4 个疗程PCD 方案化疗,游离轻链转阳性,患者要求转入当地医院治疗,截至随访结束日期仍然生存。
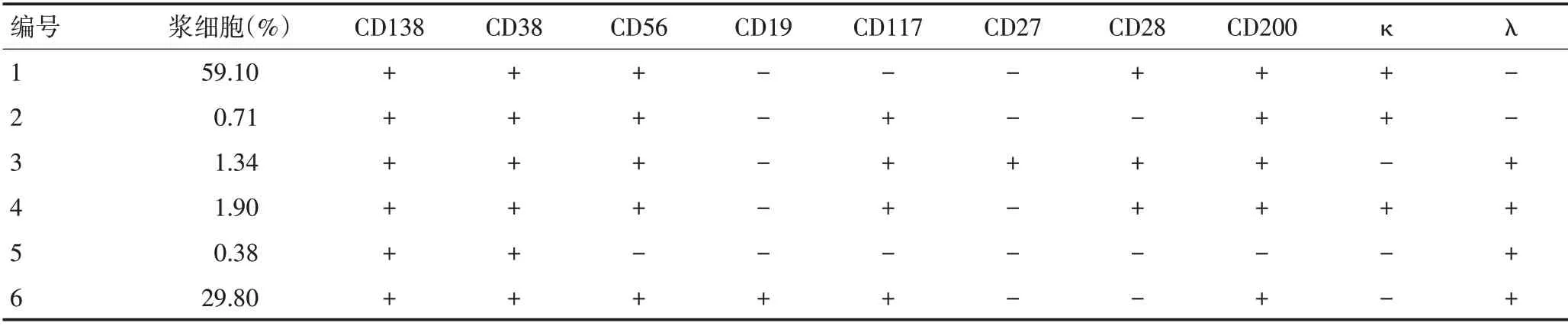
表2 6例MM并发MPE患者的胸水免疫表型特征
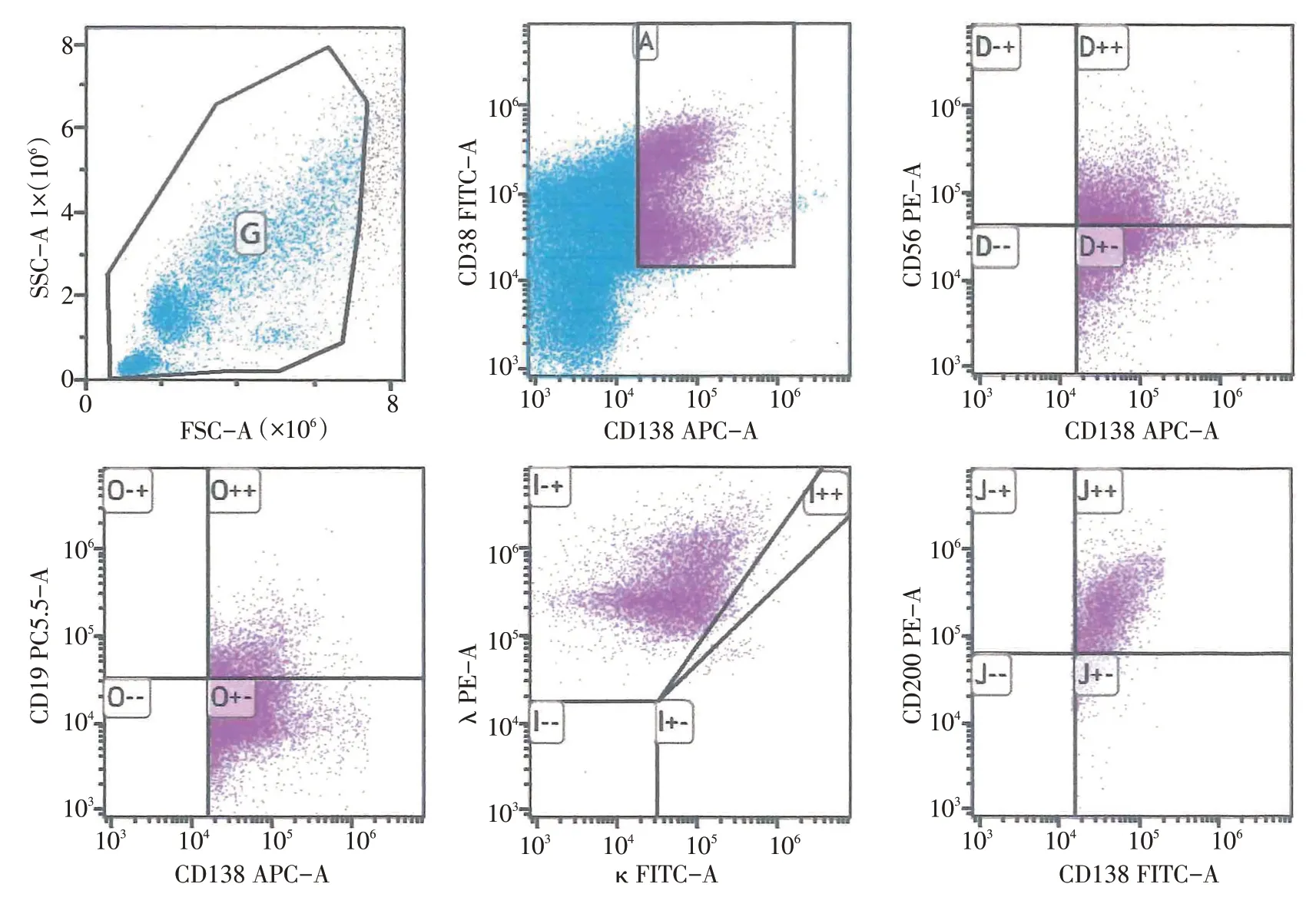
图1 病例6胸水流式分析散点图
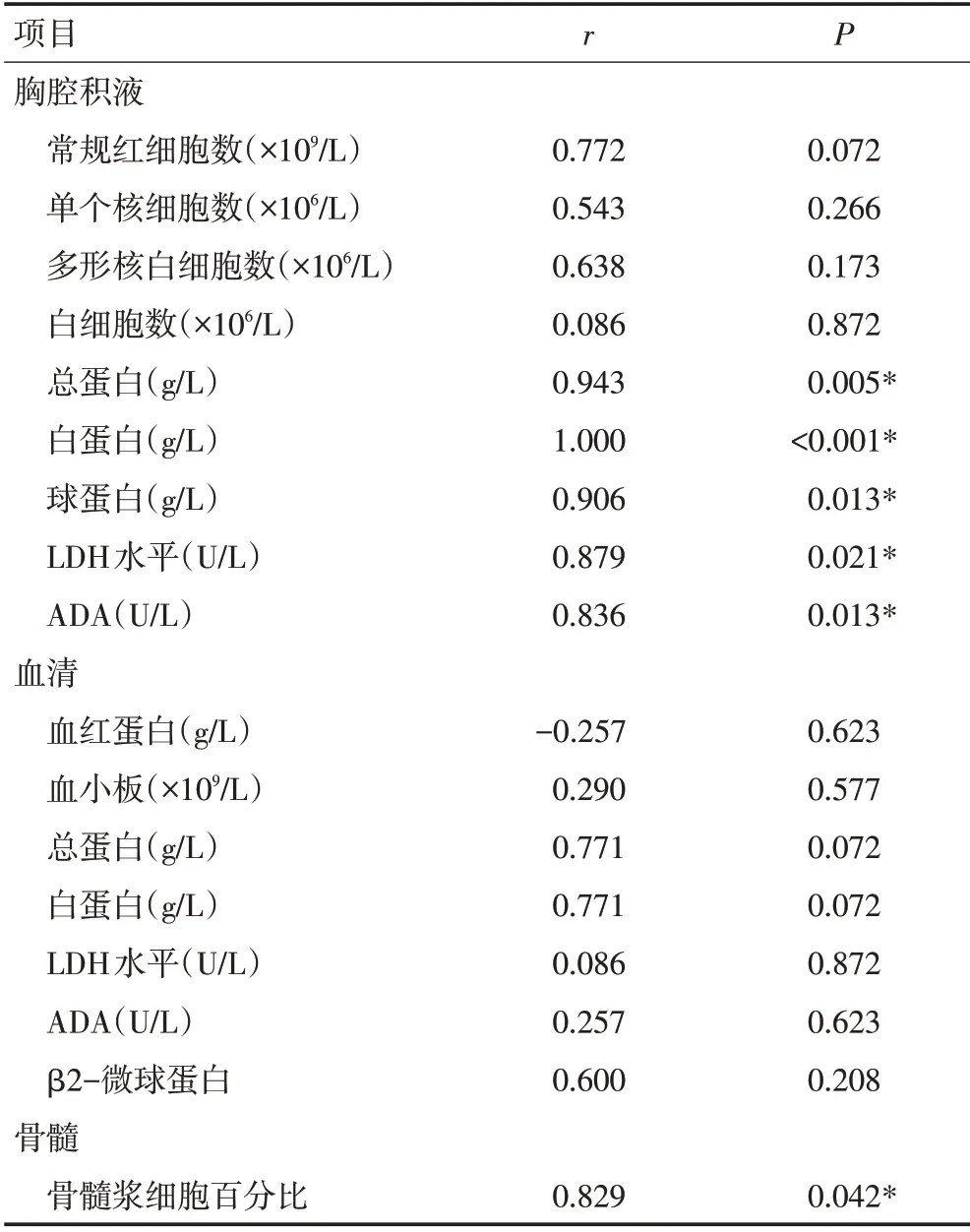
表3 胸水浆细胞比例与实验室指标相关性分析
3 讨论
MM为一种浆细胞恶性增殖性疾病,主要表现为CRAB 症状:高钙血症、肾衰竭、贫血和溶骨性损害,但也有约6%MM患者出现以胸腔积液为主要表现的呼吸困难[3]。MM合并胸腔积液产生的原因主要为邻近骨骼或肿瘤的胸膜腔受累、纵隔淋巴结浸润伴淋巴阻塞、胸膜或肺淀粉样变,同时MM 可并发肾病综合征、慢性肾功能衰竭、淀粉样心肌病、感染、低蛋白血症和肺栓塞,上述症状均可导致胸腔积液的发生[4]。骨髓瘤细胞直接累及胸膜腔产生的MPE 极为罕见,发生率<1%。本院报道的MPE 发生率高于既往研究,主要原因可能为对所有MM并发胸腔积液可抽液样本均进行传统常规胸水细胞学检查联合FCM检查。
目前,对于MM 并发MPE 的检查主要包括胸腔积液细胞学检查,虽然单纯的病理涂片具有较高的特异性,但其敏感性较低,涂片的染色质量可能会妨碍脱落细胞学诊断[5]。因此,流式细胞术在诊断MM并发MPE过程中发挥较大作用。
意大利国家癌症研究所有数据有力地支持FCM作为一种简单可靠的技术,在胸水样本中可以明确鉴定肿瘤浆细胞,而且明显比细胞学检查更敏感[6]。目前,认为CD138、CD38、CD45、CD19和CD56均是可鉴别良恶性浆细胞的主要免疫表型[7]。本研究运用FCM 检测,均可从6 例患者胸腔积液中找到浆细胞,但胸腔积液脱落细胞学检查均未见癌细胞。所有患者CD38及CD138均为阳性,除病例6之外,所有患者CD19均为阴性。病例4虽然κ和λ均为阳性,但κ/λ>4.0,仍有意义。因此,有必要将FCM纳入胸腔积液的常规检查中,其在鉴别胸腔积液良恶性中发挥重要作用。
Zhong等[8]研究发现,23例MM合并MPE患者,其中男性11 例,女性12 例,中位年龄为56.8(37~68岁),大多数患者为IgA 亚型,其次为IgG 亚型。该研究男性患者多于女性,中位年龄62(49~72)岁,与既往研究相似,IgA型占大多数(50%),IgG型占30%,这可能与IgA 骨髓瘤患者13 号染色体缺失发生率较高有关[9]。但因本研究样本数较少,同时克隆性浆细胞未做分选,6例患者染色体均为正常核型。
MM患者产生MPE往往预示着疾病进展或复发,为疾病进入晚期的表现。先前的报道指出骨髓瘤性积液患者的总生存期(overall survival,OS)明显少于无骨髓瘤性胸腔积液的患者(P=0.002)[2]。Cho 等[10]研究表明,MM 伴MPE 预后较差,MPE 发生后患者中位生存时间(median OS,mOS)为2.8(0.2~15.6)个月,总死亡率为57.9%。Kamble 等[9]研究发现,13 号染色体缺失在MM 伴MPE 患者中出现率较高,这可能解释了MPE 与不良预后之间的关系,约90%浆膜腔浸润的MM 患者在确诊后1年内死亡[11]。在本研究中,6 例患者在随访结束后,4 例死亡,2 例生存,mOS 为7.5(2~36)个月,MPE 出现后的mOS 为6.5(2~17)个月,研究结果与上述研究基本相符。
目前,骨髓瘤性胸腔积液的治疗应以化疗联合胸腔引流为主[9]。胸膜内予以顺铂治疗可以缓解MPE 症状,但对预后无影响[12]。Ye 等[13]报道1 例以骨髓瘤性胸腔积液为首发症状的患者,最初予以Cy⁃BorD(环磷酰胺+硼替佐米+地塞米松)方案化疗。然而,MPE 快速积聚,后来将化疗方案更换为硼替佐米+达雷木单抗+地塞米松方案,1个月内胸腔积液基本消失。也有学者研究发现,IgG-κ 亚型MM 并发MPE 的患者,最初对地塞米松有良好的反应[14]。Zhong 等[8]研究发现,MM 并发MPE 的患者对联合硼替佐米的治疗具有一定反应。硼替佐米为一种新型的蛋白酶体抑制剂,具有明显的抗骨髓瘤活性。然而,硼替佐米可能引起肺损伤,出现肺部并发症,其中包括胸腔积液[15]。因此,这为应用蛋白酶体抑制剂治疗MM并发胸腔积液增加了更多的挑战[16]。
综上所述,本研究认为在胸腔积液常规检查基础上,亟需联合更为敏感的FCM 检查,以便提高MM并发MPE诊断的阳性率,从而更好地判断预后,指导临床个体化治疗。

