间充质干细胞归巢效应的研究进展*
胡啸天邓志钦段莉李文翠王大平*
间充质干细胞(mesenchymal stem cells,MSCs)是一种多能干细胞,其来源为中胚层和外胚层,具有易于体外分离培养、造血支持、多分化潜能、免疫调节、旁分泌效应等多种优点。因此,MSCs被认为是一种理想的种子细胞来源,可以治疗多种疾病,从而被广泛应用于组织工程、免疫治疗、干细胞移植等多个研究领域。但是很多研究表明,植入的外源性MSCs在靶向组织中检出率很低,从而影响了其治疗效果。因此,提高MSCs归巢率成为其治疗疾病、获得良好疗效的关键,为此需要进一步地明确MSCs的归巢机制。
1 MSCs归巢的定义
1983年,Gallatin等[1]首次将血源性淋巴细胞选择性进入二级淋巴器官这一过程称为“淋巴细胞归巢”,此后“归巢”这一概念被引申至多种干细胞。2002年,Saito等[2]首次提出MSCs具有归巢特性,当机体组织受到刺激时,体内部分MSCs被“唤醒”,从而归巢到损伤部位进行分化,以替代受损细胞。2009年,Karp等[3]建议将“MSCs归巢”定义为“MSCs在靶组织的脉管系统里被捕获,随后跨越血管内皮细胞迁移至靶组织的过程”。
2 MSCs的归巢机制
许多研究指出,MSCs的归巢效应所涉及的物质与白细胞向炎症组织归巢的效应十分相似。如Ann De Becker等[4]提出MSCs在治疗各类疾病时,表现出了牢固的黏附、爬行、扩散和跨内皮细胞迁移的过程,并且在该过程中趋化因子CXCL9、CXCL16、CCL20和CCL25的表达都有显著增强。尽管白细胞的归巢机制已被研究得较为清楚,但是MSCs归巢的具体机制仍不明确。不过令人欣慰的是,一些分子已被证实参与了MSCs的归巢。现将参与MSCs归巢过程的相关分子及其机制介绍如下。
2.1 MSCs的动员及迁移
许多研究表明,趋化因子及其受体操控着MSCs归巢的动员和迁移。目前研究最多的趋化因子为SDF-1(基质细胞衍生因子1),又称CXCL12。同时,其研究最深入的受体为CXCR4。SDF-1/CXCR4轴的主要功能之一是调节前体细胞的移植、趋化及归巢至损伤部位,是介导MSCs迁移分布的关键信号[5]。Jin等[6]通过缺氧预处理MSCs,使其上CXCR4过表达,相比未经处理的MSCs,其在小鼠肝脏损伤模型中的归巢能力更强且相比对照组能更好地促进肾脏功能恢复。此外,Sohni等[7]还发现了hMSCs上其他能表达趋化功能的趋化因子受体,如CCR1-4、CCR7、CCR9、CXCR6等。但是相比这些受体的趋化因子,SDF-1具有最强的趋化能力。因此,SDF-1/CXCR4轴仍然是目前MSCs趋化研究领域最大的热点。
2.2 MSCs黏附内皮
MSCs归巢完成动员和迁移后,MSCs开始向毛细血管壁内皮细胞黏附,这时就需要MSCs表达细胞黏附分子与细胞外基质表达的黏附分子配体相结合,介导该过程。目前所发现的有关MSCs黏附内皮细胞的黏附分子主要为整合素和选择素。其中一种整合素为VLA-4,它表达于约50%的人MSCs上。同时整合素细胞血管黏附因子1(VCAM-1)是VLA-4的配体,其主要表达于内皮细胞上,两者构成了VLA-4/VCAM-1轴。而Dykstra等[8]采用岩藻糖基化的方法增加MSCs上E-选择素的表达,可以增加移植的MSCs的归巢。Chi等[9]也发现在MSCs表面固定P选择素配体后,更利于流动的MSCs的捕获和黏附。此外,在hMSCs上还有多种黏附分子(如细胞间细胞黏附分子l、内皮因子等)存在不同程度的表达,但它们与MSCs的内皮黏附乃至归巢的关系仍有待进一步研究。但可以肯定的是,黏附分子是MSCs完成归巢过程中不可缺少的成分。
2.3 MSCs穿越内皮
在MSCs完成归巢动员及黏附内皮后,想要发挥其治疗作用,仍需从血液循环中迁移出来,从而进入损伤部位。而穿越血管内皮细胞是其主要途径。在此过程中各种趋化因子、金属蛋白酶(matrix metalloproteinase,MMP)和纤维连接蛋白(fibronectin,FN)发挥着重要作用。许多研究表明,在组织受损后,趋化因子不仅能诱导MSCs沿血管内皮滚动而到达靶组织附近,并且能介导其向靶组织方向穿越血管内皮。当组织受损后,大量趋化因子如MCP-1、MIP-1等富集在受损区域,它们与MSCs上相应受体(如CCR2、CCR3等)结合,促进MSCs穿越血管内皮[10]。由于MSCs体积较大但伪足运动能力偏弱,单纯依靠趋化因子诱导其穿越内皮难度较大。因此有研究还发现,MMP和FN也在MSCs穿越内皮过程中发挥了重要作用。研究证明,MMP可以分解基底膜来提高血管通透性,从而帮助MSCs越过血管内皮。王俊等[11]发现促进骨髓MSCs表达MMP-2和MMP-9可以使其获得更强的迁移能力。而FN则能增强MSCs向血管内皮深部黏附。Clements等[12]发现FN暴露的V区是MSCs上VLA-4的一个结合点,它们结合后使MSCs能够黏附到血管内皮外,从而进入细胞外基质(见图1、表1)。
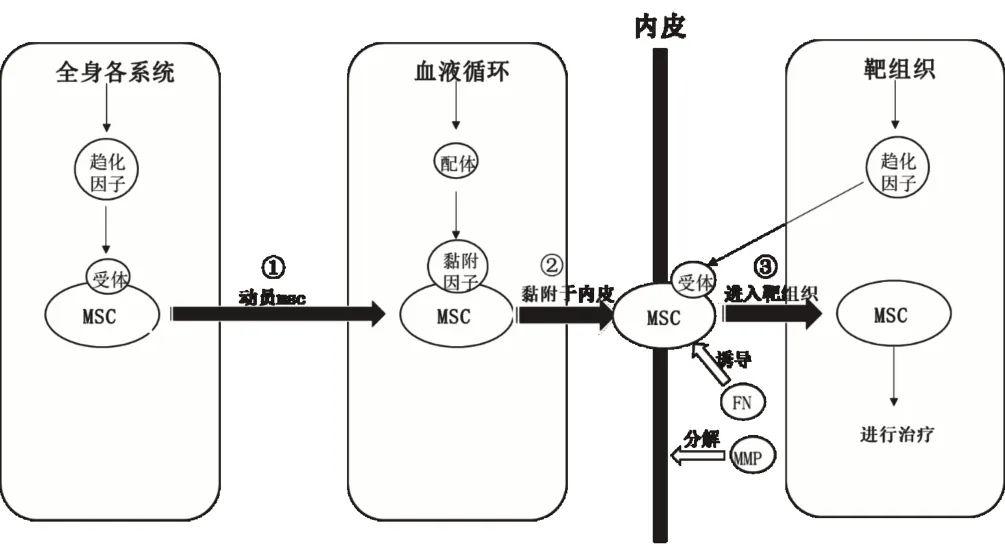
图1 间充质干细胞归巢大体路线图
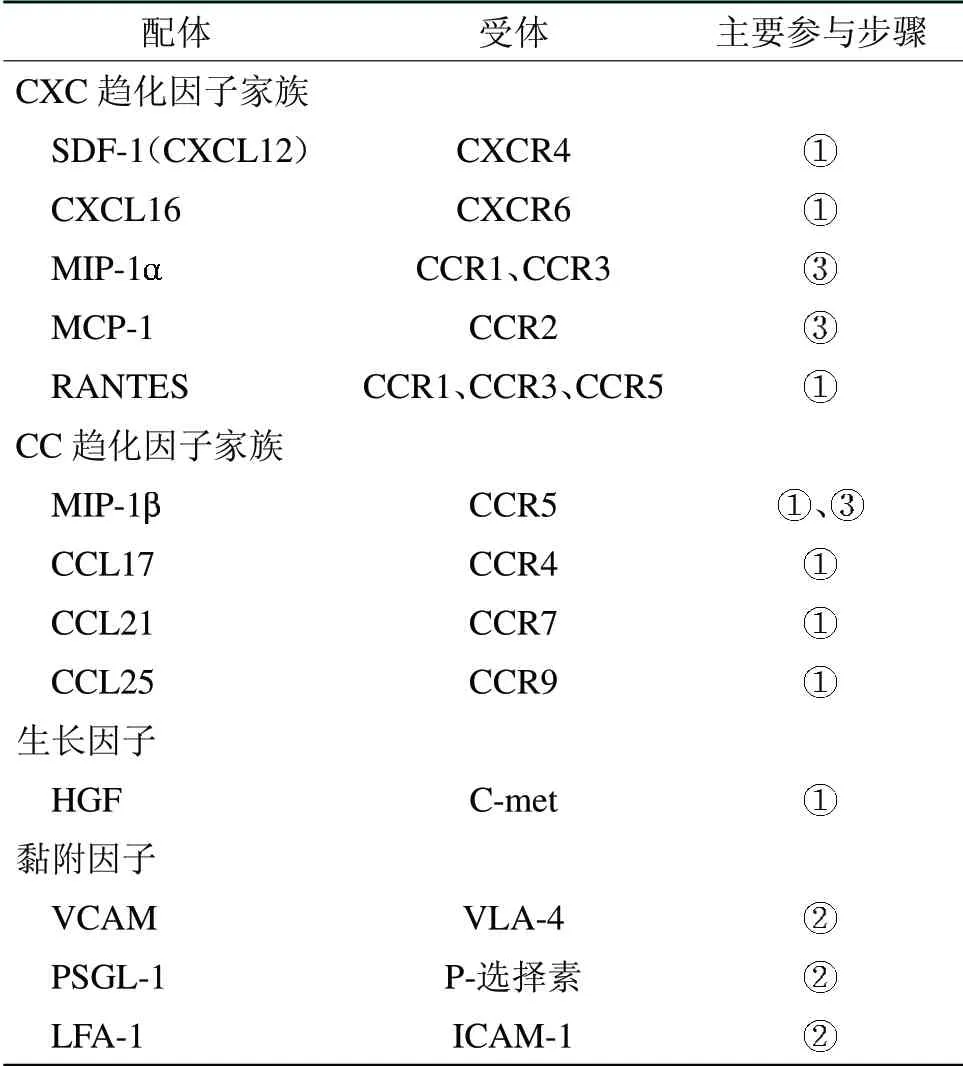
表1 间充质干细胞归巢各步骤参与分子
3 提高MSCs归巢率的策略
3.1 增强MSCs响应归巢刺激的能力
3.1.1 应用相关化合物
当使用MSCs治疗时加入相关化合物可以触发信号通路,使参与细胞运输的关键介质表达。Li等[13]在体外实验证实,将HMG-CoA还原酶抑制剂与MSCs联用可以提高其表面CXCR4的表达,有效增加MSCs移植后心肌梗死周围MSCs的数量。Najafi等[14]发现MSCs用去铁胺处理后使细胞表面的CXCR4、CCR7表达增加,并且HIF-1蛋白、MMP-2和MMP-9的活性相比未结合去铁胺的MSCs也显著增加。而且在体内/外迁移中,用去铁胺处理的MSCs的迁移率较对照组显著增高。其原因是去铁胺可稳定HIF-1的含量并提高其活性,从而增加其所涉及的细胞迁移的相关基因的转录。
3.1.2 低氧预处理
现阶段发现,将MSCs短期暴露于缺氧条件下可能会诱导参与细胞迁移的一些基因表达,如CXCR4、CXCR7、CX3CR1和SDF1a。周治来等[15]发现低氧预处理大鼠脐带间充质干细胞可促进其迁移至脊髓损伤区域加速修复。Antebi等[16]也证实了短期生理性缺氧可增强间充质干细胞的治疗效果。Ho等[17]证实低氧预处理后的MSCs相比空气对照组加速了节段性骨缺损的修复。
3.1.3 培养预处理
为了研究MSCs的迁移活性是否可以通过添加趋化因子或生长因子的预处理来影响,Lejmi等[18]用趋化因子MIP-1和MIP-3对MSCs进行预处理,发现这两种趋化因子能够在体外增加MSCs的迁移。Hengartner等[19]在用IL-1体外刺激MSC时,发现IL-1是调节MMP1和免疫调节基因表达的关键介质,并且IL-1介导的MMP1表达的上调可能促进了MSCs的内源募集或移植的MSCs的体内迁移。
3.1.4 基因修饰
已有大量研究发现过表达CXCR4可以趋化MSCs归巢的瞬时启动并且增加MSCs的运动性。体外培养的MSCs上的CXCR4表达率低,因此直接移植未经处理的MSCs,其归巢效果相对而言差。既往通常采用病毒质粒转染CXCR4基因的方法来加强MSCs对SDF-1的敏感度。Wang等[20]通过超声微气泡联合脂质体包被转染CXCR4到骨髓间充质干细胞,与传统的病毒质粒转染相比,该方法具有更高的转染效率,且Transwell实验表明该方法转染的骨髓间充质干细胞体外迁移能力与对照组相比提高了9倍。
3.1.5 糖工程学
细胞迁移涉及一系列事件,这些事件是由靶组织流动的内皮细胞之间的抗剪切黏附分子相互作用引起的。其中,内皮细胞表达的E-选择素在此步骤中起关键作用。E-选择素是结合了特定糖类序列的凝集素,其上含有a-2,3-甲硅烷基。然而E-选择素的配体在造血干细胞中表达,而MSCs不表达E-选择素的配体。但是MSCs表达的一个CD44糖型含有a-2,3-甲硅烷基。因此在特定酶条件下的糖转移的应用程序后,MSCs上的天然CD44的糖型被转换为E-选择素的配体,并且不会对细胞活力和潜力造成影响。这个配体也被称作HCELL[21]。
肖飞等[22]证明CD44分子的体外岩藻糖基化修饰能显著加强兔骨髓间充质干细胞的归巢能力,这可能是通过SDF-1、MCP-1的调节来实现的。此外Blocki等[23]设计了一种微囊,这种微囊包括了低浓度的琼脂糖、细胞外基质、胶原纤维蛋白等。在该微囊的保护下,MSCs可以长期存活和增殖且微囊本身的降解不会引起体内的不良反应。
虽然我们已经引入了一些策略来提高MSCs响应归巢刺激的能力,但体外扩增和一些操作可能会改变细胞的一些特性,如其增殖能力、分化潜能和遗传稳定性。这可能会对其临床安全产生负面影响。因此,一些学者更倾向于调节目标位点,来设计一种更有吸引力的环境来增强干细胞/祖细胞的招募。这些策略被认为比基于干细胞本身的策略更为有效。
3.2 提高靶部位对MSCs的吸引力
在组织损伤后,受损细胞中SDF-1的表达增加,继而通过SDF-1浓度梯度的趋化吸引来完成损伤部位干细胞的招募和保留。然而,由于SDF-1增加的自然现象似乎不足以使病变完全再生和修复,因此正在寻求更全面的方法来增强MSCs对损伤组织/器官的趋化作用,讨论如下。
3.2.1 趋化因子编码基因直接转染靶组织
超声靶向微泡破坏(ultrasound targeted microbubble destruction,UTMD)是一种非侵入性和选择性的基因传递方法。在一项研究中,通过UTMD方法处理MSCs并植入大鼠的心肌梗死模型中,可以增加MSCs的迁移率,并且发现缺血心肌中SDF-1的表达增加,且MSCs表面CXCR4的表达增加,表明UTMD可能通过SDF-1/CXCR4轴辅助MSCs归巢[24]。在一项临床试验(Ⅰ期)中,17名患者接受了心肌内膜注射JVS-100。JVS-100是编码SDF-1的DNA质粒。治疗12个月后,结果显示接受注射的患者生活质量有所改善[25]。
3.2.2 支架材料在靶组织中的应用
由各种生物材料控制释放趋化因子可以增强MSCs向它们的募集。有学者提出可注射水凝胶,如CHGP-HEC,是通过募集骨髓间充质干细胞进行原位软骨组织再生的好选择[26]。此外,明胶水凝胶、PLGA支架(聚乳酸聚乙醇酸共聚物)以及聚乙二醇水凝胶也被用来实现MSCs的招募。Chen等设计了一类D型氨基酸自组装肽纳米水凝胶支架,其不仅具有良好的生物活性、生物相容性和生物稳定性,还能够促进大鼠骨髓间充质干细胞(BM-MSCs)的增殖和迁移[27]。在另外一些研究中,3D支架材料被学者寄予厚望。3D打印是一种强大的技术,通过逐层沉积细胞加载的生物相容性墨水,通过计算机辅助设计预先制定,可重复且准确地形成具有几何形状的组织状结构[28]。已有文章提出,基因激活的生物油墨与MSCs结合可以帮助其扩散[29]。而Cunniffe等[30]已成功将MSCs与由RGD-照射的海藻酸盐和纳米透明质酸制成的基因激活生物油墨结合,其复合的质粒DNA表达BMP2和TGF 3。而Chung等[31]考虑到患者特异性移植物替代节段性骨修复的需要,制作了3D打印的PLLA模板,其孔隙度和孔径大小与天然组织相似,在hMSC动态培养下具有良好的生物相容性,和对生理相关的机械载荷的响应。因此,这种移植物替代物被认为有利于在患者的临界尺寸骨缺损矫正中进行开发。
3.2.3 电场的应用
Guangping等[32]发现,电场激活多种细胞信号传导途径,如PI3K/PTEN,KCNJ15/Kir4.2的膜通道,这些途径可以涉及MSCs的定向迁移。如今,Zhao等[33]应用ETC(电场定向芯片)完成了在一个高通量筛选电场平台上的定向细胞迁移实验,能够识别所选细胞类型的电场敏感范围,促进其细胞的迁移。并且,研究发现通过ES(电刺激)或者PEMF(脉冲电磁场)处理过的MSCs具有更强的成骨分化能力[34]。
尽管电场应用在体内难以得到优化,但是对人体是安全的,因此在用于细胞治疗时可以对损伤组织带来更直接的细胞归巢而没有其他损害。
3.3 植入途径的选择
目前,移植MSCs的途径主要有3种,分别为静脉注射、动脉注射及局部注射。Idriss等[35]分别采用静脉和脾内注射MSCs治疗肝纤维化。研究发现,静脉注射是更合适、更有效的治疗路径。而在MSCs治疗结肠炎的研究中,Wang等[36]发现腹腔注射是MSCs的最佳给药途径,通过此途径给药的MSCs表现出更高的细胞迁移率。但是Goncalves等[37]发现,在治疗结肠炎时静脉注射比腹膜内注射效果更好,这种不一致可能归因于MSCs的类型不同,不同的MSC的增殖率和分化的能力,以及在细胞因子分泌蛋白质和趋化因子受体表达的显著差异都有可能影响迁移。所以,在解释研究结果和选择具体的临床应用时,应系统地考虑不同来源MSCs的生物学差异。因此,相关研究虽然已报道了各个植入方式的优缺点,但仍未统一出何种途径最适宜植入MSCs。这也是未来需要研究的方向之一。
4 小结与展望
MSCs的归巢率直接决定了其治疗效果,因此只有保证了在治疗中有一个可观的归巢率,才能保证其疗效。许多趋化因子、黏附分子等与MSCs归巢直接或间接相关,因此各国学者已经做了巨大努力来利用趋化因子配体/受体轴瞄准靶组织/器官,以增强MSCs定向迁移至损伤部位的能力。尽管在基于细胞的这些策略上取得了初步成功,但这些策略要么费用高昂,要么存在一定安全问题,在临床上难以推广和应用。为了解决这些问题,研究者们将目光转向基于靶组织的策略。使用支架材料、电场等技术虽然更安全、更吸引人,但仍需研究者们做更深入的研究来提高其最终的效率。而现今最束缚研究者们开展深入研究的困难便是MSCs的归巢机制尚不明确。只有更加充分地了解MSCs的归巢体系,对其过程中的每一个步骤、每一个参与分子及每一种影响因素都做到心中有数,才能从根本上提高MSCs的归巢率,使其在细胞治疗领域得到更广泛的应用,造福全人类。

