淫羊藿苷纳米微粒对大鼠成骨细胞成熟与矿化的影响
葸慧荣 高玉海 陈克明 马慧萍
1. 中国人民解放军联勤保障部队第940医院骨科研究所,甘肃 兰州 730050; 2.中国人民解放军联勤保障部队第940医院药剂科,甘肃 兰州 730050)
骨质疏松是目前危害老年人身体健康的一种全身性骨骼疾病,其特点是骨量减少、骨密度降低、骨脆性增加,容易导致骨折[1]。因此,抗骨质疏松药物的研发已成为当今社会的主要课题,特别是从天然中草药中提取有效成分已成为抗骨质疏松药物研发的热点。淫羊藿苷为中药淫羊藿的主要有效成分,是目前抗骨质疏松症常用的天然药物有效成分之一[2]。淫羊藿苷属于异黄酮类化合物,难溶于水,易溶于甲醇、乙醇等有机溶剂,具有口服吸收差,生物利用度低等特点[3]。因此,我们对淫羊藿苷进行剂型改造,制备成了新型纳米混悬制剂,从而提高淫羊藿苷的水溶性和生物利用度。
本实验以自制的淫羊藿苷纳米微粒处理成骨细胞。通过检测成骨细胞中碱性磷酸酶活性,钙化结节染色面积和颜色以及相关成骨性蛋白的表达量变化,观察淫羊藿苷纳米微粒对成骨细胞矿化和成熟的影响,从而初步评价淫羊藿苷纳米微粒的生物利用度是否得到有效提高。
1 材料和方法
1.1 材料
自制淫羊藿苷纳米微粒;出生48 h以内的Wistar大鼠乳鼠[甘肃省兰州市联勤保障部队第940医院动物实验科,动物合格证号:SYXK(军)2016-0029,动物级别为SPF级]。淫羊藿苷(陕西省宝鸡市辰光生物科技有限公司);DMSO、胰蛋白酶(Sigma公司);β-actin、Ⅰ型胶原(COLⅠ)、Runx-2、OSX、BMP-2、OPG、RANKL一抗均购自Abcam公司;胎牛血清(兰州民海生物工程公司);碱性磷酸酶试剂盒(南京建成);辣根过氧化物酶标记的二抗(Cell sig纳米微粒Ling公司);α-MEM培养基粉剂(美国Gibco公司);Hochest 3342/PI(北京雷根生物技术有限公司);BCA蛋白水平测定试剂盒[上海碧云天(Beyotime)生物技术有限公司];ECL超敏化学发光液(武汉博士德公司);淫羊藿苷纳米微粒(实验室自制)。
1.2 实验仪器
倒置相差显微镜(Olympus,日本);正置荧光显微镜(Olympus,日本);电泳仪、电转移仪和酶标仪(Bio-Rad,美国);H1650-W台式微量高速离心机(长沙湘仪离心机仪器有限公司,中国);CO2细胞培养箱(Thermo 公司,美国);超净工作台(北京半导体一厂,北京)。
1.3 实验方法
1.3.1淫羊藿苷纳米微粒的制备方法
称取处方量淫羊藿苷原料药溶于1 mL二甲基亚砜溶液中作为油相;取适量的稳定剂分散于20 mL蒸馏水中作为水相;使用超声细胞破碎仪超声并高速剪切水相,超声过程中将油相缓慢匀速注入水相中,同时用冰水浴冷却,即得淫羊藿苷纳米微粒。
1.3.2大鼠颅骨原代成骨细胞的培养
取出生48 h内的Wistar大鼠脱颈处死,经酒精浸泡消毒处理后,于灭菌过的超净工作台中解剖乳鼠取出整个颅骨,剔除周围软骨组织,用PBS漂洗3~5次,将其全部捣碎装于EP管中;加入适量胰酶消化细胞,8~10 min后弃去上清液并重复上述过程3次;再次漂洗后加入0.1%Ⅱ型胶原酶,于37 ℃恒温水浴条件下消化细胞4次,每次15 min,弃去第一次收集的上清液,收集后3次消化液合并,加入适量的完全培养基终止消化;将收集的细胞悬液经细胞筛过滤两次,滤液以1 000 r/min离心5 min;弃去上清液,加入完全培养基重新悬浮细胞团块,并连续吹打至分散均匀,接种于中号培养皿中于37 ℃,5% CO2细胞培养箱中培养,备用。
1.3.3淫羊藿苷纳米混悬液对成骨细胞形态的影响
培养成骨细胞,待细胞状态良好且铺满皿底时,将细胞分为3组,分别为对照组(1×10-6mol/L DMSO),淫羊藿苷组(1×10-6mol/L 淫羊藿苷溶液)、淫羊藿苷纳米微粒组(1×10-6mol/L 淫羊藿苷纳米微粒溶液),加上述药物处理细胞12、24 h后,观察不同时间点药物对细胞形态的影响。
1.3.4Hoechst 3342/PI 双染色检测细胞毒性
细胞样品的制备:培养成骨细胞至铺满皿底,分别加药处理24 h后弃培养基,PBS洗涤两次,加入1 mL细胞染色缓冲液、5 μL Hoechst 染色液和5 μL PI 染色液冰浴或 4 ℃ 染色30 min。染色后经 PBS 洗涤一次,在荧光显微镜下观察细胞染色情况。
1.3.5碱性磷酸酶(ALP)活性测定
将培养的第一代细胞接种于三个中号培养皿中,每3 d更换一次培养基,待细胞铺满皿底且状态良好时加入成骨细胞诱导液,继续培养3 d和6 d后,分别用碱性磷酸酶检测试剂盒(按说明书操作)检测细胞内ALP的水平。
1.3.6茜苏红钙化结节染色
取P1代培养的成骨细胞分别进行加药处理,同时加入适量的成骨性诱导液进行诱导,每隔3 d换一次培养基,第12 d后弃掉培养基,用PBS漂洗两遍,加入2 mL 4%多聚甲醛固定10 min,弃去多聚甲醛再用PBS漂洗两次。向培养皿中加入适量0.1%的茜素红染色液,37 ℃恒温培养箱中放置30~45 min,待培养皿中逐渐出现深红色斑点时,弃去茜苏红染液,去离子水漂洗2次,于显微镜下拍照取图,观察染色后钙化结节区域的面积。
1.3.7成骨特异性蛋白表达量的检测
弃掉加药处理过的成骨细胞培养液, PBS缓冲液漂洗两次,加入300 μL的细胞裂解液RIPA,待细胞充分裂解后收集裂解液,-20 ℃保存备用。将上述收集的细胞裂解液于离心机中以12 000 r/min离心30 min,按BCA蛋白定量试剂盒说明书进行蛋白定量。取适量蛋白经 SDS-PAGE 凝胶电泳分离后,转移至 PVDF 膜上用封闭液封闭。分别加入 1∶1 000 稀释的一抗4 ℃过夜,次日分别加入1∶5 000 稀释的辣根过氧化酶标记的二抗室温孵育 1 h,TBST 漂洗后,ECL 显色,结果用图像分析软件Image Proplus 6.0分析灰度值,比较各组细胞中不同蛋白相对表达水平。
1.4 统计学处理

2 结果
2.1 加药处理后细胞形态变化
加药处理12 h时,将细胞置于倒置相差显微镜下观察,各组细胞贴壁生长,呈三角形、纺锤形或多角形等形态正常,但细胞数目稀少(如图1);加药处理24 h后,各组细胞数目明显增多,而形态无明显变化。初步表明淫羊藿苷纳米微粒对成骨细胞形态无显著影响。

图1 药物处理对成骨细胞形态的影响(上排:加药12 h;下排:加药24 h) (20×)Fig.1 Effect of drug treatment on the morphology of osteoblasts (upper row: 12 hour; lower row: 24 hour; 20×)
2.2 Hoechst 3342/PI 双染色检测细胞毒性
图2所示,对照组细胞呈正常状态,淫羊藿苷组和淫羊藿苷纳米微粒组成骨细胞调亡或坏死的数量增多,但各组间差异无统计学意义。

图2 Hoechst 3342/PI 双染色检测细胞毒性结果 (20×)Fig.2 Cytotoxicity results of Hoechst 3342/PI double staining (20×)
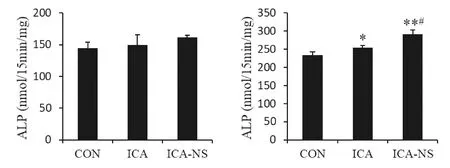
图3 不同时间点成骨细胞中ALP活性测定结果(n=3)注: 与CON组相比,*P<0.05,**P<0.01;与ICA组相比,#P<0.05。Fig.3 ALP activity assay results of osteoblasts at different time points (n=3)
2.3 碱性磷酸酶活性测定结果
由图3所示,加药处理第3 d时,与对照组比较,淫羊藿苷组和淫羊藿苷纳米微粒组的ALP 活性均升高,但差异无统计学意义;加药第6 d时, 淫羊藿苷组ALP 活性显著高于对照组(P<0.05),淫羊藿苷纳米微粒组ALP活性极显著高于对照组(P<0.01),且显著高于淫羊藿苷组(P<0.05),表明将淫羊藿苷制备成纳米微粒后,其促进成骨细胞分化的能力显著增强。
2.4 茜苏红钙化结节染色结果
由图4可知,对照组钙化结节呈淡红色,数量最少、面积最小;淫羊藿苷组呈橘红色,钙化结节数量增加、面积增大;淫羊藿苷纳米微粒组呈深橘红色,钙化结节数量最多、面积最大,表明将淫羊藿苷制备成纳米微粒后,其促进成骨细胞矿化的能力显著增强。
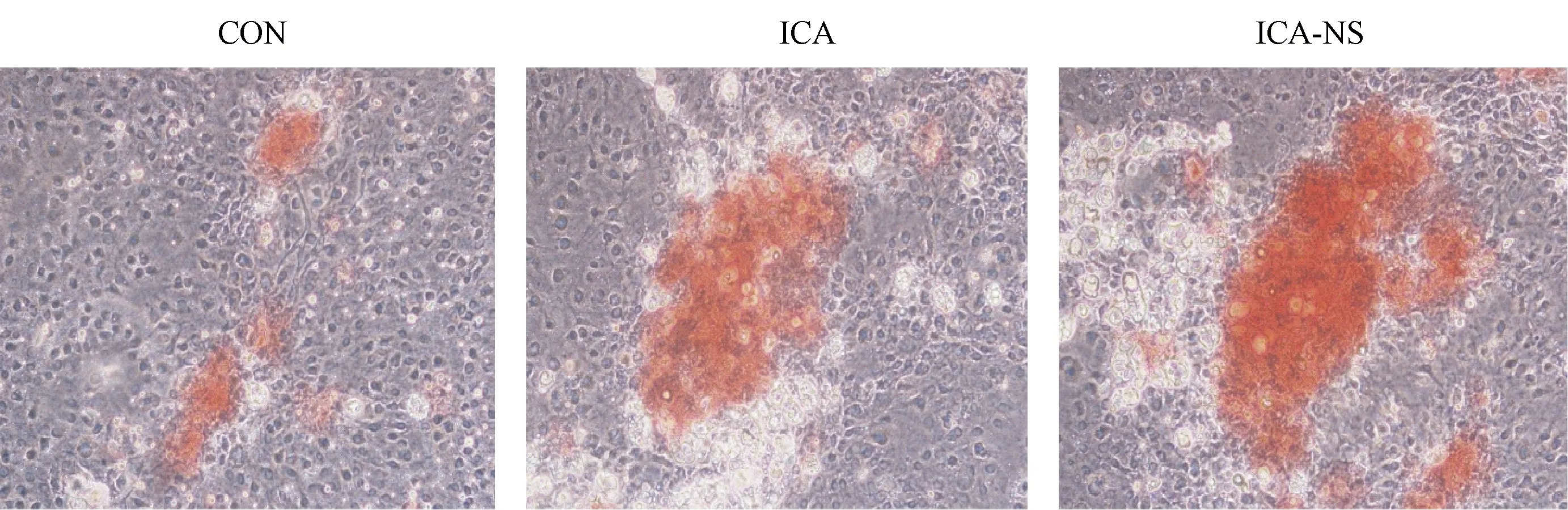
图4 药物处理后钙化结节染色结果 (20×)Fig.4 Calcified nodules stained by Alizarin red after 12 days of drug treatment (20×)
2.5 成骨特异性蛋白表达量的检测结果
由于淫羊藿苷纳米微粒能显著增加成骨细胞ALP活性,促进成骨细胞的矿化成熟,表明淫羊藿苷纳米微粒应通过增加成骨细胞活性来促进生长期大鼠骨量的。于是我们检测了成骨细胞中Runx-2、OSX、CoL1α2和BMP-2等成骨特异性蛋白表达量的变化,结果显示这些蛋白的表达水平均显著增加,且淫羊藿苷纳米微粒组显著高于淫羊藿苷组(图5、6)。
3 讨论
大量研究已经表明,淫羊藿苷能够促进体外成骨细胞的成熟与矿化,同时抑制破骨细胞的骨吸收并诱导其凋亡[4]。Hsieh等[5]发现淫羊藿苷剂量依赖性地提高成骨细胞的增殖与矿化成熟。马小妮等[6]研究发现淫羊藿苷可以上调OPG/RANKL的比值,从而抑制破骨细胞发生及其骨吸收活性。以上研究结果表明,淫羊藿苷能够促进体外成骨细胞的骨形成、抑制骨吸收,具有潜在的、良好的临床应用价值。

图5 通过Western印迹检测成骨特异性蛋白表达量结果注:与CON组相比,*P<0.05,**P<0.01。Fig.5 Protein expression of osteogenic proteins as assessed with Western blotting

图6 成骨性特异性蛋白表达的量化结果(n=3)Fig.6 Quantitative results of relative expression of osteogenic proteins(n=3)
本研究以自制的淫羊藿苷纳米微粒为评估对象,考察其对体外培养大鼠颅骨成骨细胞成熟与矿化的影响,并与淫羊藿苷原料药相比较,从细胞水平上评价该递释系统是否可提高淫羊藿苷的生物利用度。
实验首先检测了淫羊藿苷纳米微粒对大鼠成骨细胞形态的影响,经加药处理细胞24 h后,在倒置显微镜下观察细胞形态变化情况。结果显示,淫羊藿苷纳米微粒组细胞状态与对照组和淫羊藿苷组相比无明显变化,初步表明淫羊藿苷纳米微粒对成骨细胞无明显不良反应。实验进一步用Hoechst 3342/PI双染色法在荧光显微镜下观察淫羊藿苷纳米微粒对细胞凋亡和坏死的影响情况,由Hoechst 3342/PI染色原理可知,当细胞凋亡或坏死时,细胞染色质固缩,Hoechst 3342 染料穿透细胞膜,在荧光显微镜下观察细胞呈亮蓝色;同时由碘化丙啶 (PI)染色原理可知,弱红色细胞为凋亡细胞,强红色细胞为坏死细胞[7]。由上述染色结果显示淫羊藿苷纳米微粒组亮蓝色、亮红色或弱红色细胞数量虽然较多,但与对照组和淫羊藿苷原料药组比较无明显差异,再次表明淫羊藿苷纳米微粒溶液对成骨细胞均无明显的不良反应。
碱性磷酸酶活性是成骨性分化的早期指标之一,其数量和活性在成骨细胞的骨形成过程中直接影响骨形成能力[8]。而成骨细胞分化的最终结果是矿化成熟,因此,检测成骨细胞中钙盐沉积量可揭示细胞矿化的进度和程度。该实验中碱性磷酸酶活性检测结果发现,在一定时间内淫羊藿苷纳米微粒可显著提高成细胞中ALP活性,同时可增加钙盐沉积量,且效果显著高于淫羊藿苷原料药,表明淫羊藿苷纳米微粒能显著促进成骨细胞的分化和矿化。
为了进一步证明上述结果,实验还检测了与成骨性相关的部分蛋白水平变化情况。OSX是一种成骨细胞转录因子,能促进前成骨细胞分化为成熟的细胞[9];BMP-2为骨形态发生蛋白,是促进骨形成和诱导骨细胞分化最重要的细胞外信号分子之一[10]。Runx-2在成骨细胞分化、成熟中也发挥重要作用,参与骨形成的早期阶段[11]。淫羊藿苷纳米微粒处理细胞24 h后,OSX、Runx-2、BMP-2等蛋白表达量较淫羊藿苷组明显提高。OPG/RANKL 的比值决定了破骨细胞的命运,比值降低则骨吸收增强,比值升高则骨吸收降低[12]。本研究结果显示,与对照组相比,淫羊藿苷纳米微粒显著提高了 OPG的表达量,而对 RANKL 表达无显著影响,即淫羊藿苷纳米微粒组 OPG/RANKL比值显著高于对照组,表明淫羊藿苷纳米微粒是通过促进骨形成和抑制骨吸收双重作用来调节骨代谢的。
以上实验表明,淫羊藿苷纳米微粒可能是通过促进ALP活性,增大钙化结节面积,增加OSX、Runx-2、COL1α2、BMP-2等的蛋白表达量来促进成骨细胞的骨形成活性,且淫羊藿苷纳米微粒的上述作用均强于淫羊藿苷原料药,表明将淫羊藿苷原料药制备为纳米混悬液后, 其促进骨形成的活性明显提高了。其机理可能为:淫羊藿苷纳米微粒作为一种新型药物递释系统,具有粒径小、载药量高、黏附力强,且其载体本身易附着于细胞表面并与膜融合,进入细胞内部的效率更高,使细胞内部药物浓度较淫羊藿苷普通溶液提高,从而发挥了更高的药效。这表明淫羊藿苷纳米微粒可望成为抗骨质疏松症的新剂型,但其是否应用于临床还有待进一步研究。

