pH值对麦醇溶蛋白-槲皮素相互作用及其Pickering乳液特性的影响
王启明,唐瑜婉,杨雅轩,刘士健,赵吉春,张宇昊,明 建,2,
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
槲皮素是一种广泛分布在果蔬、谷物中的重要黄酮类化合物,具有抗氧化、抗炎、降血压、降血脂等生物活性及药理学作用[1-2],大量的酚羟基结构赋予其独特的化学特性,如能与生物大分子(蛋白质、多糖等)发生相互作用[3-4]。麦醇溶蛋白是小麦中的主要贮藏蛋白,能赋予面团黏性,具有两亲性,可自组装形成胶体颗粒,在Pickering乳液中起乳化和稳定作用[5]。
在食品加工过程中,荞麦粉和小麦粉常混合食用,槲皮素和麦醇溶蛋白之间的相互作用,会引起蛋白结构和功能特性的改变。食品组分间复杂的相互作用形成复合颗粒结构,可操控食品结构(如乳液、泡沫体系等)的形成[6-7]。相关研究报道植物多酚(芦丁[8]、姜黄素[9]、单宁酸[10]等)与植物蛋白质(大豆分离蛋白[8-9]、玉米醇溶蛋白[10]等)的复合改变了蛋白质理化性质,且复合颗粒对乳液的稳定性、流变学特性和微观结构也产生了明显的作用。
乳液具有改善食品风味、提升营养品质等应用潜力,逐渐成为研究的热点,但其特性常受多种因素(如pH值、离子强度、温度等)的影响。其中,蛋白质和多酚的表面电荷会随pH值变化,从而影响相互作用类型和乳液的特性[11-12]。Chen Shou等[9]报道了在pH 3.0和pH 7.0条件下,姜黄素与大豆分离蛋白的络合明显促进乳液的脂质氧化。Zhou Fuzhen等[13]研究发现,pH 4.0条件下小麦醇溶蛋白和原花青素复合颗粒制备的乳液具有黏弹性和超稳定性。然而对于特定pH值条件下,麦醇溶蛋白-槲皮素的相互作用及其荷载前后蛋白制备Pickering乳液的基础特性尚不清楚。
因此,本实验利用反溶剂法制备麦醇溶蛋白-槲皮素复合物,研究pH值对蛋白及其复合物性质的影响,并探究pH值对荷载前后蛋白制备Pickering乳液的流变学性质及微观结构的影响,以期拓宽两者在小麦制品中的应用范围,为开发富含生物活性物质的高蛋白食品提供理论基础。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白(Lot#SLBS6538)、槲皮素(≥95%,色谱纯,Lot#SLBV2993) 美国Sigma公司。
盐酸、氢氧化钠、乙醇、溴酚蓝、磷酸氢二钠、磷酸二氢钠(均为分析纯) 成都科龙化工试剂公司。
1.2 仪器与设备
F-2500荧光分光光度计 日本日立公司;Pro10102扫描电镜 荷兰Phenom Pro公司;DSC25差示量热扫描仪美国TA公司;PB-10 pH计 德国Sartorius公司;XHF-DY高速分散器 宁波新芝生物科技股份公司;TGL-18MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;LGJ-10真空冷冻干燥机 北京松原华兴科技有限公司;MCR302流变仪 奥地利安东帕公司;BX53荧光正置显微镜 日本Olympus公司;LSM800激光共聚焦显微镜 德国卡尔蔡司公司。
1.3 方法
1.3.1 样品的制备
通过反溶剂法制备麦醇溶蛋白及其复合物麦醇溶蛋白-槲皮素分散液,参考Hu Yaqiong等[14]的方法略作修改。在磁力搅拌条件下将1.0 g麦醇溶蛋白和7.5 mg槲皮素溶解在100 mL体积分数70%乙醇溶液中,超声辅助溶解。然后在4 ℃贮存过夜以完全水合。在反溶剂过程,水相与醇相体积比为2.5∶1。将麦醇溶蛋白溶液缓慢滴入1%冰乙酸溶液中,边滴边均质(10 000 r/min、3 min)。均质完成后,所得溶液在45 ℃水浴下旋转蒸干。在没有槲皮素的情况下相同条件制备麦醇溶蛋白溶液。调节溶液pH值,得到pH 3.0、5.0、7.0的分散液,冷冻干燥,备用。
1.3.2 荧光猝灭测定
吸取1 mL不同pH值的麦醇溶蛋白-槲皮素复合溶液(混合前,麦醇溶蛋白浓度为10 μmol/L,槲皮素浓度梯度为0、5、10、20、30、60、100 μmol/L)。分别在20、30、40 ℃测定。激发波长285 nm,扫描范围为300~500 nm。参考Lakowicz[15]的方法校正内滤光效应。
1.3.3 表面疏水性测定
参考Tang Yu等[16]溴酚蓝法进行测定。将1.0 mL样品(10.0 mg/mL)与1.0 mL磷酸盐缓冲液(50.0 mmol/L,pH 7.0)和200 μL(1.0 mg/mL)溴酚蓝充分混合,旋涡10 min。以磷酸盐缓冲液为空白,使用分光光度计在波长595 nm处测量离心后上清液(稀释10 倍)吸光度(A)。溴酚蓝结合量按下式计算:
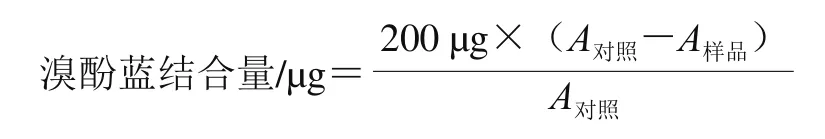
1.3.4 扫描电镜观察
取适量固体粉末,经喷金处理后在10 kV加速电压下扫描,观察样品的微观结构。放大倍数为3 000 倍和8 000 倍。
1.3.5 差示扫描量热测定
参考Tang Yu等[16]的方法,略作修改。称量2.0 mg固体粉末密封在差示扫描量热(differential scanning calorimetry,DSC)铝盒中,在40~100 ℃温度范围内以10 ℃/min进行升温。采用TA仪器自带TRIOS软件分析获得变性峰温度Tp,代表蛋白质的热稳定性。
1.3.6 乳液制备
参考Hu Yaqiong等[14]的方法,采用简单的均质乳化法制备乳液。粒子质量浓度为5.0 mg/mL,研究pH 3.0、5.0条件下乳液的形成及性能。油相为大豆油,油水比为体积比1∶1,10 000 r/min均质3 min得到乳液。
1.3.7 乳液类型判断
通过观察乳液滴到水或油里的分散情况判断乳液的类型(O/W或W/O)。乳滴分散在水中,则为水包油(O/W)型乳液;反之,则为油包水(W/O)型乳液。
1.3.8 乳液的稳定性分析
离心稳定性:观察乳液10 000 r/min离心2 min后的状态判断。贮藏稳定性:观察室温下乳液静置后乳析层的变化判断。
1.3.9 乳液流变学行为分析
参考Zou Yuan等[10]的方法,略作修改。采用安东帕流变仪测定乳液的流变学行为,选用d=50 mm的平行板,设置间隙为0.104 mm。黏度测量:剪切速率为0.1~100 s-1。黏弹性质测量:频率扫描范围为0.1~100 Hz,应变为0.5%;应力扫描范围为0.01%~100%,频率为1 Hz。
1.3.10 乳液的微观结构观察
参考Hu Yaqiong等[14]的方法,略作修改,进行乳液微观结构的观察。
光学显微镜:将10 μL样品置于载玻片上放大40 倍观察乳液的形态。使用显微镜自带软件分析液滴尺寸分布:对每个样品乳液的3 张图像进行100 次液滴测量,并将平均值作为该条件下的平均液滴尺寸。
激光共聚焦显微镜:配制含有0.2%尼罗红(异丙醇溶解)和0.2%尼罗蓝(去离子水溶解)的染料。将1 mL乳液与20 μL尼罗红和20 μL尼罗蓝混合均匀。将10 μL乳液置于载玻片上放大40 倍观察乳液的形态。激发波长分别为488 nm和633 nm。
1.4 数据统计及分析
所有实验至少进行3 次重复,利用MiniTab 17软件对数据进行ANOVA差异显著性分析,置信区间为95%。采用SigmaPlot 12.5软件进行图表处理。
2 结果与分析
2.1 荧光猝灭分析
蛋白质固有的荧光团(色氨酸和酪氨酸)对其微环境的极性高度敏感。如图1所示,在未加槲皮素时,不同pH值溶液下麦醇溶蛋白在波长340 nm左右有最强荧光发射峰,而随着槲皮素的加入及浓度的增大,荧光强度降低且伴随着明显的蓝移现象(pH 3.0:339~321 nm;pH 5.0:339~327 nm;pH 7.0:341~333 nm),表明槲皮素与麦醇溶蛋白间存在相互作用,氨基酸附近微环境极性减弱,疏水性增强。在pH 3.0、5.0和pH 7.0条件下,槲皮素对麦醇溶蛋白的的猝灭率分别为84.50%、85.95%和87.08%,猝灭效应强度为pH 3.0>pH 5.0>pH 7.0,表明pH值影响槲皮素对麦醇溶蛋白的猝灭作用。
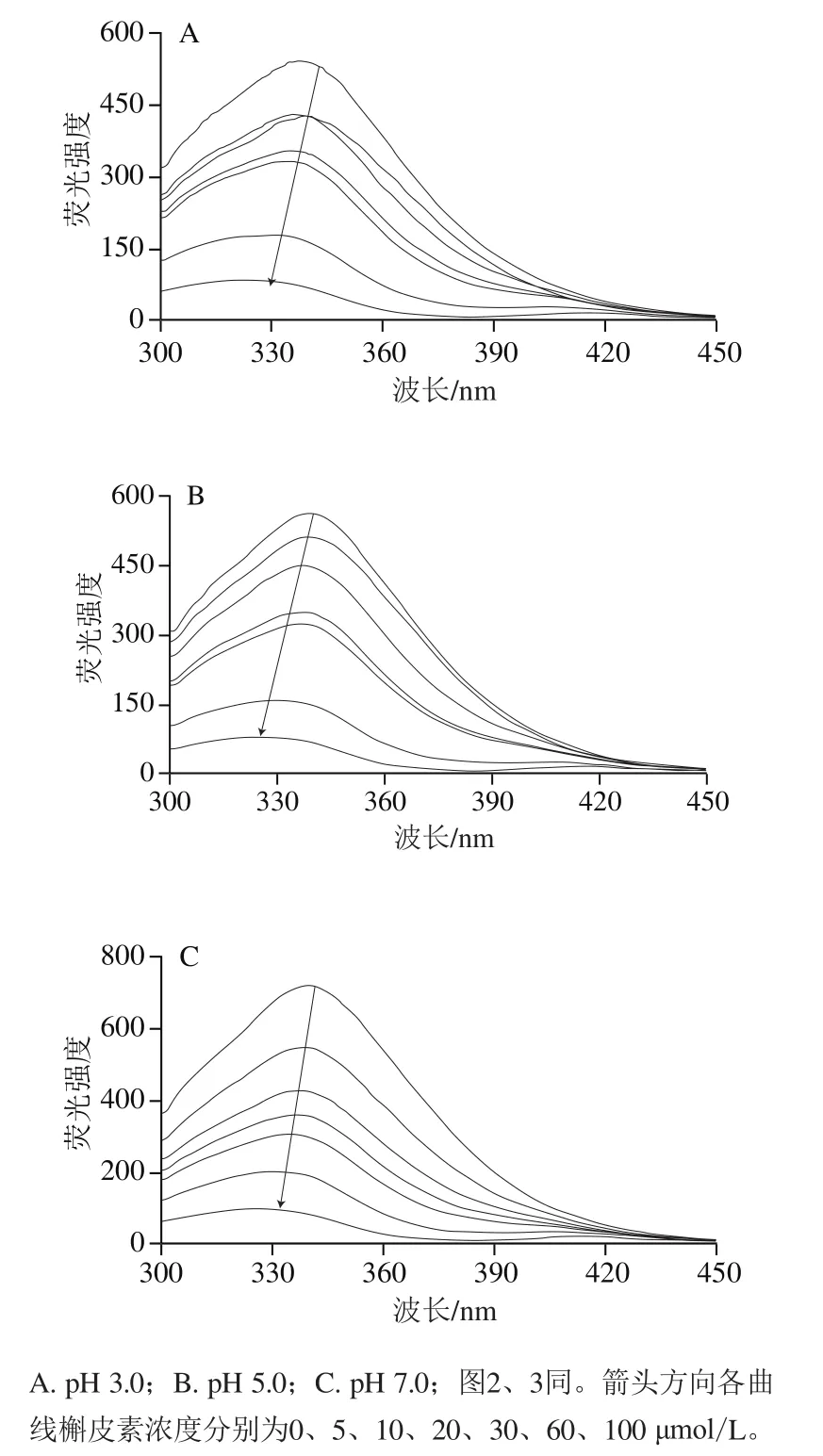
图1 不同pH值条件下槲皮素对麦醇溶蛋白的荧光猝灭效应Fig.1 Fluorescence quenching effect of Q on G at different pH values
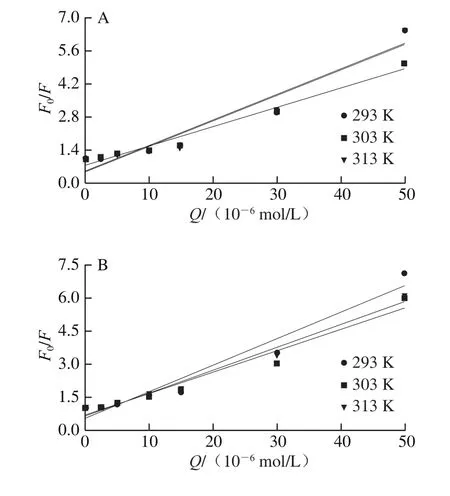
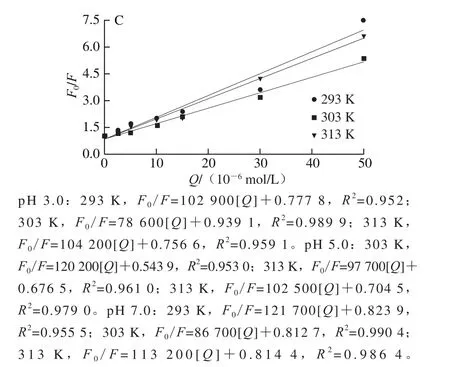
图2 不同温度下槲皮素猝灭麦醇溶蛋白的Stern-Volmer图Fig.2 Stern-Volmer plot for wheat gliadin quenching by quercetin at different temperatures
通过Stern-Volmer方程进行荧光猝灭数据的分析。如图2所示,F0/F和[Q](Q为槲皮素)之间存在线性相关性,斜率随着温度的升高呈增加趋势,说明槲皮素与麦醇溶蛋白之间发生了动态猝灭现象。通过无荧光猝灭剂状态下的平均荧光寿命τ0(一般为10-8s)和猝灭常数Ksv得到双分子猝灭速率常数Kq(Ksv=10-8×Kq),如表1所示,其值在7.86×1012~1.22×1013L/(mol·s)之间,远大于最大动态猝灭速率2.0×1010L/(mol·s),说明相互作用过程中也存在静态猝灭现象,所以槲皮素对麦醇溶蛋白的猝灭方式为动、静态结合,麦醇溶蛋白的猝灭结果与Joye等[17]报道的一致。如图3所示,lg[(F0-F)/F]-lg[Q]的双对数关系提供了有效猝灭常数Ka和化学计量数n的信息,其值列于表1。pH 5.0条件下Ka较大,表明此条件下槲皮素更易于与麦醇溶蛋白形成复合物[18]。各条件下n约为1,表明槲皮素与麦醇溶蛋白之间至少有一个结合位点。
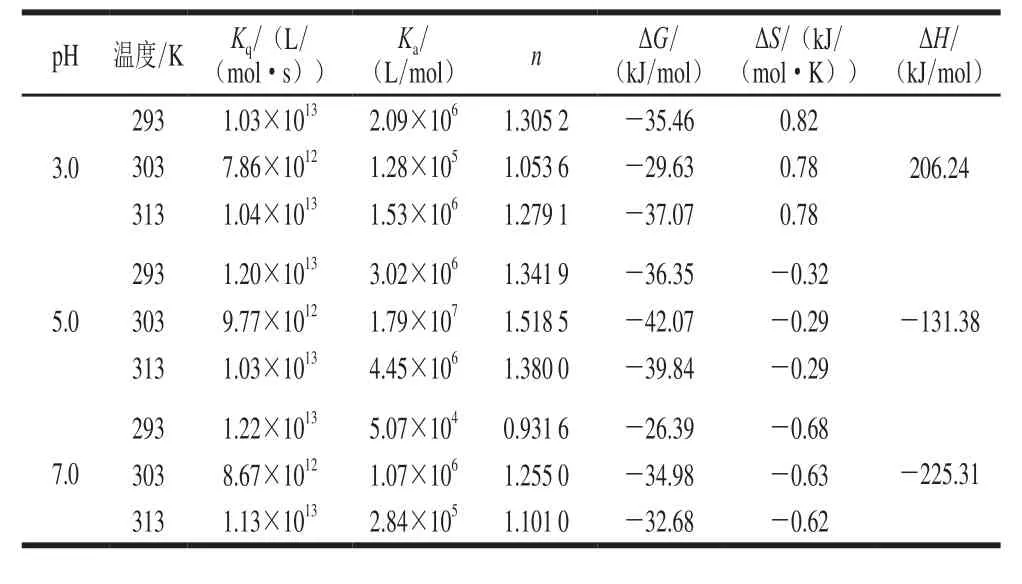
表1 麦醇溶蛋白-槲皮素复合物在不同pH值和3 个温度下的猝灭常数和热力学参数Table 1 Quenching constants and thermodynamic parameters for the formation of wheat gliadin/quercetin (G-Q) complexes at different pH values and temperatures
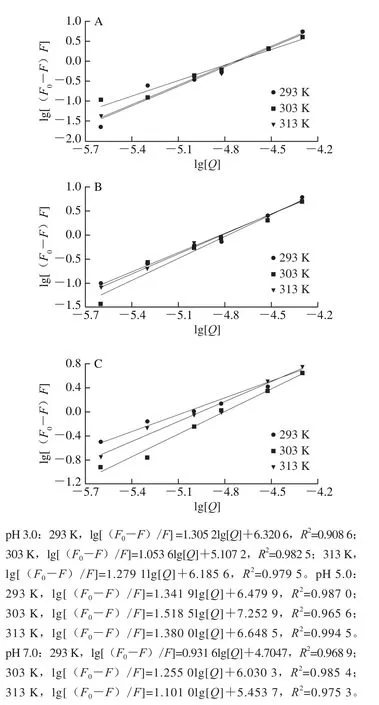
图3 不同温度下槲皮素猝灭麦醇溶蛋白的双对数图Fig.3 Double logarithmic plot for wheat gliadin quenching by quercetin at different temperatures
通过热力学参数(自由能变化(ΔG)、焓变(ΔH)和熵变(ΔS))的正负关系判断槲皮素与麦醇溶蛋白之间的主要结合力。根据Ross等[19]的结果,ΔH>0且ΔS>0,为疏水作用;ΔH<0且ΔS<0,为范德华力和氢键;ΔH<0且ΔS>0,为静电相互作用。由表1可得,pH 3.0条件下,槲皮素与麦醇溶蛋白之间主要为疏水作用力;而pH 5.0和pH 7.0条件下,槲皮素与麦醇溶蛋白之间主要为氢键和范德华力。而所有pH值条件下ΔG均小于0,表明槲皮素与麦醇溶蛋白的结合为自发过程。不同pH值条件下,麦醇溶蛋白的带电程度和槲皮素的解离度差异显著影响着槲皮素与麦醇溶蛋白的相互作用[4]。
2.2 表面疏水性分析
溴酚蓝可与低水溶性蛋白质的疏水位点结合,溴酚蓝的结合量越高,表明疏水性越强。如表2所示,添加槲皮素后,复合物的溴酚蓝结合量更大,说明酚类化合物的疏水羟基促进了蛋白疏水性位点的暴露,与荧光光谱分析结果一致。对于麦醇溶蛋白和麦醇溶蛋白-槲皮素体系,溴酚蓝结合量均为pH 3.0>pH 5.0>pH 7.0,原因可能是pH 3.0条件下蛋白内部非极性氨基酸的暴露更有利于溴酚蓝与蛋白质的结合,与陈硕等[18]测定的结果一致。
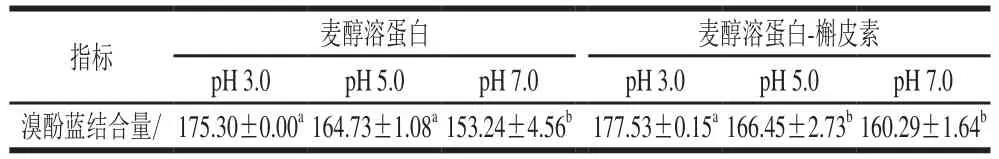
表2 pH值对麦醇溶蛋白和麦醇溶蛋白-槲皮素表面疏水性的影响Table 2Effect of pH on surface hydrophobicity s of G and G-Q complex
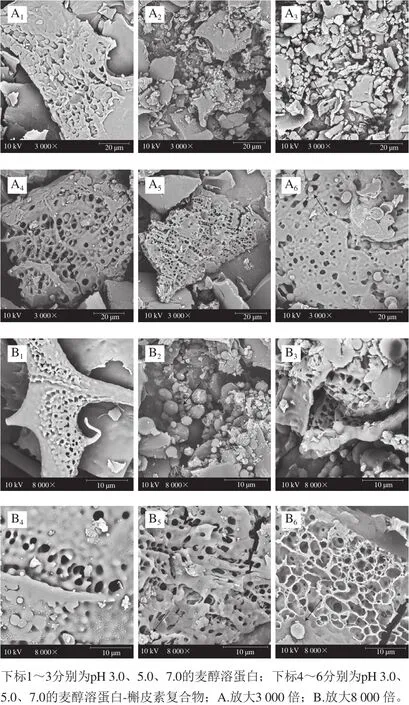
图4 不同pH值条件下麦醇溶蛋白和麦醇溶蛋白-槲皮素电镜图Fig.4 Electron micrographs of G and G-Q complexes at different pH values
如图4所示,麦醇溶蛋白分子间有空隙,冷冻干燥过程中易形成裂纹或气孔。麦醇溶蛋白体系中,蛋白表面有裂纹,能观察到少量颗粒(箭头所指处),正如Sun Shaomin等[20]描述的这些球晶状颗粒可能是聚集的小麦醇溶蛋白。随着pH值的升高,蛋白网络结构更致密;pH 5.0和pH 7.0条件下,蛋白表面气孔小且多,蜂窝状具有良好的物理截留作用[21],表明槲皮素的添加和pH值的改变导致了蛋白结构的差异。
2.3 差示扫描量热仪分析
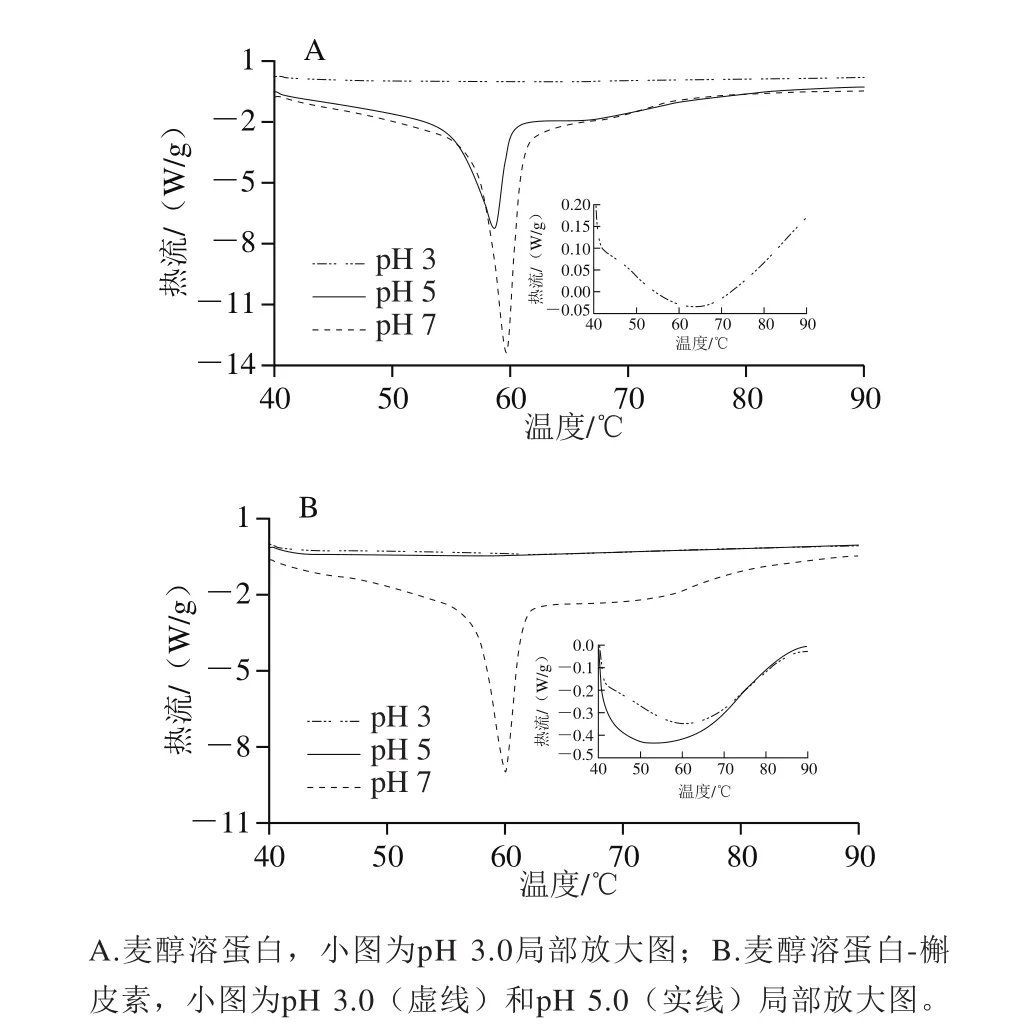
图5 不同pH值下麦醇溶蛋白和麦醇溶蛋白-槲皮素差示扫描量热分析图Fig.5 DSC thermograms of G and G-Q complexes at different pH values
如图5所示,麦醇溶蛋白体系中,最大峰值温度为66.64 ℃(pH 3.0),随pH值的升高,Tp降低,pH 5.0时,Tp降至58.60 ℃,pH 5.0条件下,蛋白的变性峰开始变窄,表明蛋白质分子的变性方式更协同[22]。添加槲皮素,热稳定性略微降低,表明相互作用可能破坏分子内疏水和静电力导致蛋白结构的去稳定化,与Cao Yanyun等[23]的研究结果一致。仇超颖[24]的研究指出,小麦醇溶蛋白球状结构的出现可能导致其相对高变性温度(pH 7.0),本研究扫描电镜结果显示,pH 7.0条件下确有球状颗粒的蛋白出现。结果表明,pH值导致蛋白热稳定性以及热变性方式的变化,pH值似乎是影响多酚-蛋白质相互作用模式的关键因素,仍需进行深入探讨。
2.4 乳液类型判断及乳液稳定性分析
将不同条件下的乳液滴到水中后(图6A),液滴快速分散,证明各乳液是O/W型乳液。贮藏稳定性是乳液的关键参数,因为它在某种程度上决定产品最终能否被使用。乳液的贮藏稳定性通过乳析指数(乳液中水相高度与乳液总高度的比值)评价。图6B、C显示乳液的典型外观。pH 3.0条件下制备的新鲜乳液具有类似牛奶的流动性,无乳析现象;而pH 5.0条件下制备的新鲜乳液呈类似蛋黄酱的膏状(图中未显示)。由于贮藏期间的密度梯度,乳液静置1 h后,乳析指数在20%左右(图6B)。随着静置时间的延长,界面高度随之增加。贮藏7 d后,对于pH 3.0的乳液,乳析指数增加到35%,乳液不像凝胶那样坚硬,但其流动性不如液体;而pH 5.0的乳液,乳析指数基本未变(图6C)。pH 5.0条件下底部水相是透明的,表明颗粒吸附在油水界面,且有些颗粒迁移到了油相[25]。Wang Lijuan等[26]制备了玉米醇溶蛋白-壳聚糖纳米颗粒稳定的乳液,乳液贮藏9 个月后也观察到了这一现象,表明乳化并未导致乳液发生不可逆的聚结。实验结果证明,pH 5.0条件下的乳液乳析指数更低,贮藏稳定性更好,且pH 5.0条件下的乳液在均质完后迅速变成固体状的乳液凝胶状,提高了乳液的贮藏稳定性,与Hu Yaqiong等[14]的研究结果相符合。

图6 不同pH值条件下麦醇溶蛋白和麦醇溶蛋白-槲皮素的Pickering乳液Fig.6 Pickering emulsions stabilized by G and G-Q particles at different pH values
乳液离心后,出现严重排水现象,乳析指数约50%,在离心力作用下,乳滴迅速聚集,比贮藏90 d后的乳析指数稍高(图6D)。pH 3.0、pH 5.0的乳液均未观察到破乳漏油现象,这一结果与贮藏稳定性结果一致,进一步说明pH 3.0、pH 5.0条件下的乳液耐受离心力。
2.5 乳液的流变学性质
乳液呈现表观黏度随剪切速率的增大而减小的剪切稀化现象,如图7A、B所示。同一pH值条件下,槲皮素的加入使表观黏度增大。在1 s-1时,pH 3.0、5.0条件下复合颗粒稳定乳液的表观黏度分别是蛋白颗粒的10 倍和100 倍,表明槲皮素在一定条件下能增强乳滴的絮凝作用。经过10 000 r/min离心后,乳液仍为剪切稀化状态,但表观黏度均比新鲜乳液大,表明乳液经过离心后,乳滴间的絮凝作用增强,正如邹苑[27]报道的离心可以产生具有黏弹性的乳液结构,这也进一步证明乳液耐受离心。
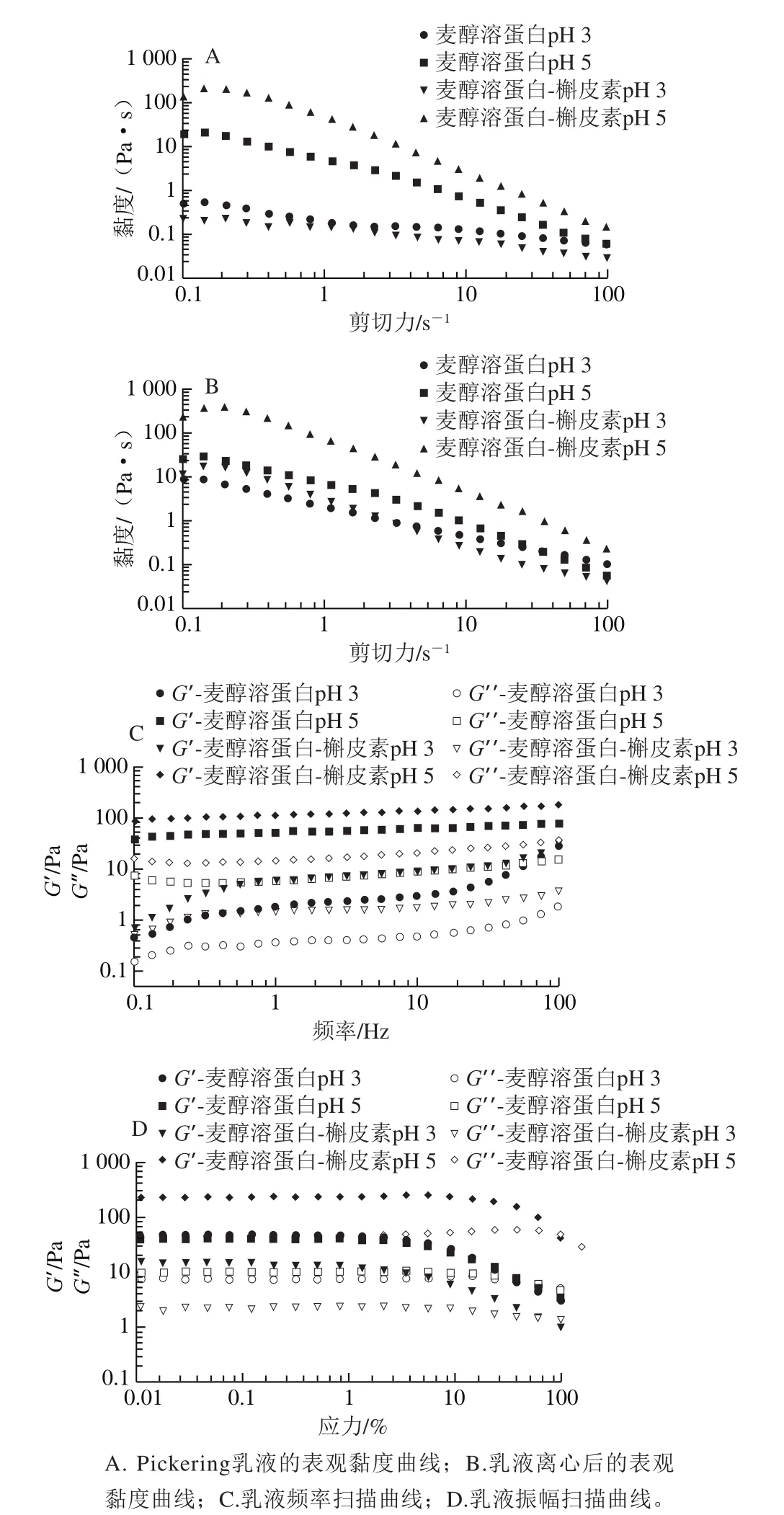
图7 不同pH值条件下麦醇溶蛋白和麦醇溶蛋白-槲皮素Pickering乳液的流变学性质Fig.7 Rheological behaviors of Pickering emulsions stabilized by G and G-Q particles at different pH values
如图7C所示,对于所有的测试乳液,其储能模量(G’)大于损耗模量(G’’),特别是pH 5.0条件下的乳液,G’约为100 Pa,超过了G’’的10 倍,表明形成了以弹性为主的凝胶网络结构乳液。有无槲皮素的乳液,G’和G’’值均随频率增加而增大。但在同一频率下,复合颗粒稳定乳液的G’和G’’大于同等pH值条件下蛋白颗粒稳定的乳液,说明前者的凝胶性更强,槲皮素起着重要作用。但在复合颗粒稳定的乳液体系中,pH 5.0条件下的G’和G’’值更大,表明乳液的凝胶性更强。如Dai Lei等[28]所述,pH 3.0条件下乳液的G’随频率变化表明Pickering乳液凝胶状结构的形成主要归因于非共价物理相互作用。而pH 5.0条件下乳液的G’随频率变化幅度小则是颗粒凝胶的特征,与Zou Yuan等[10]的观察结果一致。
图7D是乳液在应力为0.01%~100%范围内的动态模量变化。在所有测试样品中都发现在低应力条件下(γ<1%),G’大于G’’,且两者基本不依赖应力的变化。随着应力进一步增大,G’和G’’都开始下降,当G’下降速度大于G’’时出现交叉点,此点为流动点,说明乳液开始出现流动行为[29]。Zou Yuan等[10]研究发现,应力超过交叉点时,玉米醇溶蛋白/单宁酸复合纳米颗粒稳定的乳液表现出以黏性为主导的流动行为。
2.6 乳液的微观结构

图8 不同pH值下麦醇溶蛋白和麦醇溶蛋白-槲皮素Pickering乳液的光学显微镜(A)和激光共聚焦显微镜(B)图Fig.8 Observation of Pickering emulsions stabilized by G and G-Q particles at different pH values under optical microscope (50 μm) and CLSM (20 μm)
如图8A所示,pH 3.0条件下,乳液的尺寸较小(~10 μm),乳滴不连续,很少聚集。pH 5.0条件下,乳滴变大(~30 μm),少量聚集,乳液的凝固性开始增强。添加了槲皮素的乳液,观察到明显的乳滴聚集现象。然而,尽管有部分聚集现象,但是乳液能够90 d后保持稳定而不发生油析现象。
为了更好地理解乳液的形成及乳液的稳定性,通过激光共聚焦显微镜观察乳液的微观结构。如图8B所示,pH 3.0时,连续相中的红色蛋白信号较强,而绿色油滴周围几乎没有,表明大量颗粒留在连续相中形成网络结构,少量颗粒稳定油滴。因此,连续相中蛋白粒子的连续网络结构对乳液的稳定性起重要作用[14]。
pH 5.0条件下的乳液,油滴附着明显的蛋白颗粒,且信号强烈突出。油相位于液滴内部,而颗粒在液滴边界处开始形成紧密堆积结构,有助于乳液的贮藏稳定性,与图6B、C和图8A观察结果一致。pH 5.0条件下,相邻的油滴挨在一起形成网络结构稳定了乳液。以上结果说明,pH值不同会使得蛋白粒子的分布具有差异性,也会影响乳滴的聚集状态[14]。pH 3.0条件下,乳液体系中主要的作用力可能来自于颗粒之间的相互作用(如氢键、疏水相互作用、静电相互作用);而pH 5.0条件下,吸附在油滴界面的颗粒间的相互作用及油滴之间的相互作用变得更重要。
3 结 论
在不同pH值条件下,探究麦醇溶蛋白与槲皮素的相互作用及其复合物对乳液特性的影响。研究表明,pH值影响蛋白-多酚的相互作用和乳液特性。槲皮素对麦醇溶蛋白有较强的猝灭作用,且疏水相互作用是pH 3.0条件下的主要作用力,范德华力和氢键作用是pH 5.0和pH 7.0条件下的主要作用力。不同pH值条件下,乳液的流变学行为及微观结构方面的差异,可为实际食品体系(如乳制品、调制饮料、蛋黄酱等)的构建提供参考。

