脓毒症致心肌损伤模型的研究进展
杭成文 崔鸣
100191 北京大学第三医院心内科
脓毒症是机体对感染的反应失调而引起器官功能障碍的一种致命综合征。脓毒症所致心功能不全是脓毒症患者死亡率上升的主要原因之一,脓毒症导致心肌损伤(sepsis-induced myocardial injury,SIMI)是脓毒症主要表现之一,其发病机制复杂且不明确,临床上亦无统一的诊断标准和特异性疗法。因此,建立SIMI模型来研究发病机制并开发治疗药物显得格外重要。目前,已经建立了多种SIMI的模型,在体动物模型研究已经相对成熟;近年来,离体细胞模型,如原代剥离心肌、心肌细胞系、人多潜能干细胞来源的心肌细胞(cardiomyocytes derived from human pluripotent stem cells,hPSC-CMs),也逐渐受到大家的关注。本文将对SIMI的机制、模型及其特点进行综述,为优化和选择SIMI模型提供参考依据。
1 SIMI的发病机制
1.1 炎性损伤
脓毒症时,机体通过内源性与外源性的炎症反应造成心肌损伤。脂多糖(lipopolysaccharide,LPS)可以与心肌细胞表达的Toll样受体4(Toll-like receptor 4,TLR 4)结合,导致心肌细胞产生多种促炎因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等。同时,机体免疫系统产生的大量炎性细胞因子,通过血液系统到达心脏,内源与外源两方面造成心肌过度炎性损伤[1](图1)。
1.2 线粒体损伤
线粒体稳态对于心肌细胞功能维持尤为重要,而脓毒症发生时心肌细胞中线粒体分裂、融合失衡及线粒体氧化磷酸化受损,ATP合成减少[2]。另有研究发现,LPS可诱导心肌细胞线粒体活性氧(reactive oxygen species,ROS)生成,诱导肌浆网应激和细胞凋亡,致使心脏功能下降[3]。
1.3 细胞凋亡
心肌细胞凋亡在SIMI中发挥着重要作用。脓毒症时心肌细胞由于ROS、细胞因子等激活caspase9依赖的内源性凋亡通路,同时TNF-α与相应受体结合激活caspase8依赖的外源性凋亡通路,导致心肌细胞凋亡增多,而针对凋亡的干预可缓解脓毒症心肌损伤[4]。
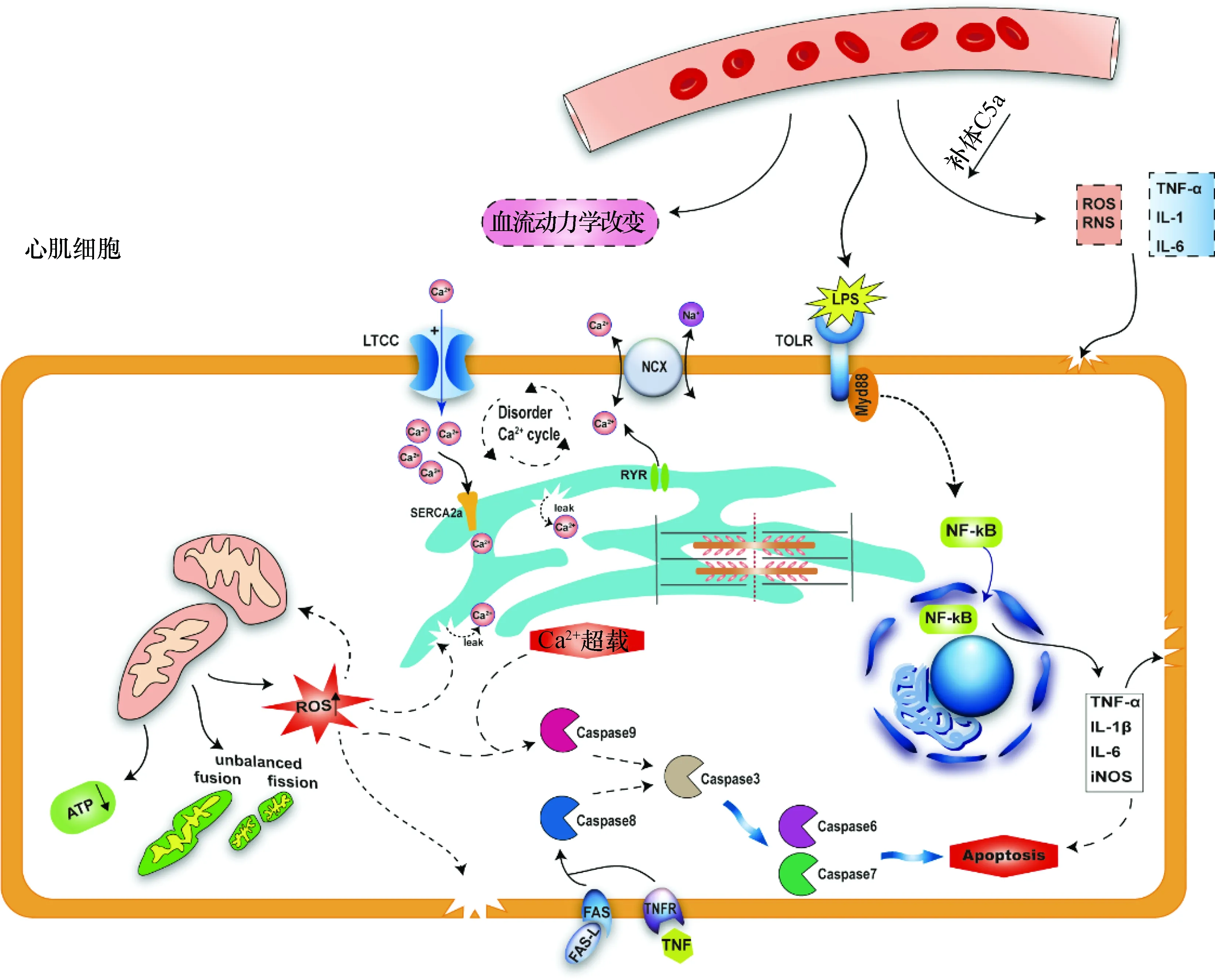
LPS:脂多糖;ROS:活性氧;RNS:活性氮;TNF:肿瘤坏死因子;IL:白细胞介素;LTCC:L型钙通道;SERCA2a:钙离子ATP酶2a;Disorder Ca2+ cycle:钙循环紊乱;NCX:钠钙交换体;RYR:斯里兰卡碱受体;TOLR:Toll样受体;Myd88:髓样分化因子88;NF-κB:核因子-κB;unbalanced fusion/fission:分裂融合失衡;Caspase:含半胱氨酸的天冬氨酸蛋白水解酶;FAS:死亡受体;FAS-L:死亡受体的配体;TNFR:肿瘤坏死因子受体;iNOS:诱导型一氧化氮合酶;Apoptosis:凋亡图1 SIMI的主要机制
1.4 钙循环紊乱
Ca2+是兴奋收缩偶联的重要离子,心肌细胞 Ca2+活动受肌浆网斯里兰卡碱受体(ryanodine receptor,RYR)、肌浆网钙离子ATP酶2a(sarcoplasmic reticulum Ca2+ATPase,SERCA2a)和细胞膜L型钙通道(L-type calcium channel,LTCC)及Na+/Ca2+交换的调节。脓毒症中,由于LTCC过度的Ca2+内流以及Na+/Ca2+交换的抑制,可观察到心肌细胞钙循环紊乱,细胞处于钙超载的状态[5]。研究也表明,钙通道阻滞剂能改善脓毒症预后[6]。
2 SIMI动物模型
目前,SIMI动物模型的研究与应用已经相对成熟。制备SIMI的动物模型主要有三种方法:宿主屏障破坏,毒素注射和病原体注射。
2.1 宿主屏障破坏模型
盲肠结扎穿孔术(cecal ligation and puncture,CLP)即通过人为的盲肠结扎和穿刺诱发多菌性腹膜炎,动物会出现典型脓毒症症状。在此脓毒症模型基础上,通过超声、血液学检测等方法,筛选出心肌损伤的动物,用于SIMI研究。
2.2 毒血症模型
2.2.1 LPS注射 LPS是G-菌细胞壁的主要成分。研究显示,LPS可以激活心肌细胞炎症通路,导致氧化应激和细胞凋亡,进而造成心肌损伤[3,7]。研究发现腹腔注射LPS后,小鼠心肌组织中炎性细胞浸润,促炎细胞因子TNF-α、IL-1β和IL-6的表达升高,心脏收缩功能障碍[8]。使用药物抑制炎症相关通路,可改善LPS所致的心肌损伤和心肌功能障碍[7]。
2.2.2 外毒素注射 白喉毒素是一种多肽外毒素,通过受体介导的内吞作用侵入细胞,抑制延伸因子2的活性,并导致DNA断裂和细胞溶解[9]。中国学者给小白鼠尾静脉注射白喉毒素,建立了白喉毒素诱导的心肌损伤模型,但此动物模型生存期仅约3 d[10]。Männ等[11]向CD11c.DTR转基因小鼠腹腔注射白喉毒素,发现小鼠心脏组织大量炎性浸润及心肌细胞溶解破坏,4~5 d内发生爆发性心肌炎及致命性心律失常。因此,白喉毒素所致的小鼠心肌损伤多为急性重症病变,实验动物生存时间短,故很大程度上限制其使用。
3 SIMI细胞模型
脓毒症是一种系统性的疾病,涉及机体复杂的免疫网络,目前在细胞水平上,难以构建脓毒症模型,只能复制脓毒症某一阶段的发展过程。LPS是目前普遍被认可的脓毒症细胞模型诱导剂,在构建SIMI细胞模型时得到广泛应用。
3.1 原代心肌细胞模型
Hobai等[12]发现成年大鼠心室肌细胞(ARVM)长时间暴露于LPS,会通过影响Ca2+循环来抑制心肌细胞的收缩。同样,也有研究表明LPS可以通过激活PKA通路来诱导新生大鼠原代心室肌细胞(NRCM)的凋亡[13],提示原代心肌细胞是SIMI潜在的细胞模型。此后,Yang等[14]利用此模型研究发现SO2对LPS诱导的心肌损伤具有保护作用,为寻找SIMI的治疗方法提供参考依据。
3.2 心肌细胞系模型
3.2.1 大鼠心室H9c2细胞株 1976年,Kimes等[15]从胚胎期BDIX大鼠心室组织中获得可以体外培养增殖的H9c2心肌细胞株。H9c2心肌细胞可以传代分化,在低血清培养基中向骨骼肌分化,而在维甲酸诱导下则呈现心肌细胞表型,但此株细胞即使分化,依然缺乏心肌细胞样的节律性搏动。研究发现体外培养的H9c2细胞在LPS处理下出现明显的炎症反应,为利用H9c2细胞建立SIMI模型提供基础。此后研究发现黄芪多糖通过下调miR-127、大黄素通过下调miR-223的表达来改善LPS诱导的心肌损伤,提示microRNA可能是SIMI治疗的一个重要靶点[16]。
3.2.2 小鼠心房HL-1细胞株 1998年,Claycomb等[17]从小鼠心房肌细胞肿瘤谱系中衍生出一株可以连续传代增殖的HL-1细胞株,其具有心肌特异性表型,并在保持成年小鼠心房肌细胞特性的同时进行分化。Yuan等[18]发现HL-1细胞暴露于LPS,可以通过ROS的产生激活心肌细胞的凋亡;同时,LPS还可以导致HL-1细胞动作电位时程延长,这些研究对于揭示SIMI的发病机制有重要意义。
3.2.3 人AC16细胞株 AC16心肌细胞是将人心室肌组织与SV40转染的成纤维细胞进行融合而获得的永生化的人心室肌细胞系,可以反复冻融传代,在特定培养基中可以进行分化[19]。AC16细胞使用LPS处理后会使细胞稀疏肿胀,失去原纺锤体形态,线粒体异常[20]。Tan等[21]的研究也证实LPS可通过TLR4介导AC16凋亡,表明AC16细胞建立SIMI模型的可行性。
3.2.4 hPSC-CMs 2007年,Takahashi等[22]利用病毒载体将四个转录因子转入人成体细胞,使其重编程而得到诱导多潜能干细胞(induced pluripotent stem cells,iPSCs)。这些干细胞在特定微环境或小分子诱导剂的作用下[23],可以向心肌细胞分化,即hPSC-CMs,这一突破为心血管疾病人源化细胞模型的建立奠定坚实基础。Yücel等[24]用LPS处理hPSC-CMs,6 h后促炎因子和趋化因子产生显著增多;而处理48 h后抗炎因子开始升高。同时还发现,LPS影响hPSC-CMs离子通道蛋白表达,延长动作电位时长,导致心肌细胞电生理功能异常,证实hPSC-CMs具有内毒素诱导的炎症反应系统,可以用来模拟某些脓毒症或细菌感染诱导的心肌细胞炎症反应。
4 各模型优缺点
两种常用的SIMI动物模型为CLP模型和毒血症模型。其中,CLP模型利用宿主内源性细菌感染诱发SIMI的过程,与人类疾病进程相似性最高,是目前应用最为广泛的模型。CLP模型和毒血症模型各有优缺点,具体如表1。
常用的SIMI心肌细胞模型,包括原代心肌细胞、大鼠H9c2、小鼠HL-1、AC16和hPSC-CMs。其中,人源性心肌细胞的开发,尤其是hPSC-CMs的发现,解决了心肌细胞来源困难的问题,同时克服种属差异,其研究方兴未艾。SIMI细胞模型各有优缺点,具体如表2。

表1 两种常用SIMI动物模型比较

表2 多种SIMI细胞模型比较
5 展望
虽然对SIMI进行了广泛的研究,但其发病机制尚未完全阐明,人们对其认知尚浅。目前已经建立多种SIMI的在体和离体模型,在体动物模型的应用和研究已趋于成熟;而随着多种心肌细胞系的建立,SIMI细胞模型研究逐渐增多。尤其是人源心肌细胞(hPSC-CMs和AC16)的发现,突破人原代心肌细胞来源受限和动物种属差异的缺点,为心血管疾病人源细胞模型的建立奠定了坚实的基础,而hPSC-CMs因为其在疾病造模,高通量药筛和细胞替代治疗方面的优势,将会成为未来研究的热门。多年来,研究者通过这些模型的应用,逐渐揭示SIMI的复杂机制,尝试探究各类药物,特别是传统中药对SIMI的治疗作用。但是,这些模型不能完全模拟人体SIMI发生发展过程,还需要不断的优化,相信随着基因编辑、组织工程和3D技术等的逐渐发展,将会有越来越多的模型被开发出来。
利益冲突:无