替吉奥用于非小细胞肺癌术后辅助化疗效果和安全性的荟萃分析
林恒 谢强 钟爱虹 朱金秀 陈文鑫 李丽秀 乐雨银 臧焕平
【摘要】 目的:探讨替吉奥(S-1)用于非小细胞肺癌(NSCLC)术后辅助化疗效果和安全性。方法:全面搜索关于替吉奥用于NSCLC术后辅助化疗的相关文献,并按照制定的纳入标准筛选出符合要求的文献,然后分别提取各文献的NSCLC术后使用替吉奥辅助化疗的完成率、2年无复发生存(RFS)率、严重不良反应发生率,最后使用Stata 15软件对所提取的数据进行Meta分析。结果:本研究分析了纳入的10项临床试验共计420例患者,对于替吉奥用于NSCLC术后辅助化疗有三个主要发现:(1)荟萃的完成率为61.0%;(2)荟萃的2年RFS率为78.0%;(3)绝大部分的严重不良反应的发生率均<5%,除了中性粒细胞减少(6.2%)。结论:NSCLC采用替吉奥辅助化疗具有较好的完成率和2年RFS率,不良反应少。因此,对于年老体弱难以耐受化疗毒副反应的NSCLC患者,可以考虑将替吉奥作为辅助化疗的可选方案之一。
【关键词】 替吉奥 非小细胞肺癌 辅助化疗 荟萃分析
doi:10.14033/j.cnki.cfmr.2020.22.001 文献标识码 A 文章编号 1674-6805(2020)22-000-06
[Abstract] Objective: To investigate the efficacy and safety of adjuvant chemotherapy with S-1 in patients with non-small cell lung cancer (NSCLC). Method: Relevant articles about adjuvant chemotherapy with S-1 in patients with NSCLC were thoroughly collected. Subsequently, eligible studies were identified according to the inclusion criteria. Moreover, completion rate, 2-year relapse-free survival rates (2-yRFS rate) and incidence of severe adverse events were extracted. Eventually, this meta-analysis was performed via Stata 15 software. Result: In the present Meta-analysis included 10 eligible studies incorporating 420 patients, three major findings were reported: (1) the pooled completion rate was calculated to be 61.0%; (2) the pooled 2-yRFS rate was 78.0%; (3) most of severe adverse events were found in less than 5% of patients, except that neutropenia events were found in 6.2% of patients. Conclusion: S-1 adjuvant chemotherapy for treating NSCLC provided good curative effect of better completion rate and 2-yRFS, with less adverse reactions. Therefore, S-1 adjuvant chemotherapy regimen is recommended for frail older people with NSCLC who are unable to tolerate certain side effects.
[Key words] S-1 Non-small cell lung cancer Adjuvant chemotherapy Meta-analysis
First-authors address: Fuzhou Pulmonary Hospital, Fuzhou 350008, China
非小细胞肺癌(NSCLC)约占原发性肺癌的85%,这是全球癌症相关死亡的主要原因[1]。早期NSCLC最有效的治疗方式是手术。但是,Ⅱ或ⅢA期NSCLC即使进行了彻底的外科手术,其5年生存率也低于50%[2-3]。这种不良预后主要是因远处转移引起,而术后辅助化疗被认为能治疗微转移,从而降低癌症复发风险并提高生存率。目前已经确定含铂双药是NSCLC术后辅助化疗的标准方案。但一项纳入以顺铂为基础的术后化疗的荟萃分析(LACE研究)显示,4 584例患者的5年的绝对生存获益仅为5.4%[HR=0.89,95%置信区间(CI):0.82,0.96][4],这意味着其余95%的患者没有获益。并且,只有长春瑞滨与顺铂联用能显著延长生存期(P=0.005)。此外,还观察到了主要由顺铂引起的少数与化疗毒性相关的死亡。因此,亟待开发更安全,更有效的治疗方案。替吉奥(S-1)是一种新的口服氟尿嘧啶抗肿瘤药物,通过添加二氢嘧啶脱氢酶(DPD)抑制剂吉美拉西改善5-氟尿嘧啶(5-FU)的肿瘤选择性细胞毒性,同時通过添加调节剂奥替拉西钾抑制胃肠道中5-FU的磷酸化作用来降低胃肠道毒性。然而,目前尚未有大型Ⅲ期临床研究验证NSCLC替吉奥辅助化疗的可行性,仅有一些单臂或Ⅱ期随机对照研究报告了替吉奥作为NSCLC术后辅助化疗的益处和风险[5-14],并且报道的结果存在争议。因此,笔者系统地回顾了现有文献以进行目前的单臂荟萃分析,目的是确定替吉奥作为NSCLC术后辅助化疗的效果和安全性。
1 资料与方法
1.1 数据来源和搜索
对Cochrane图书馆、PubMed数据库、EMBase数据库、中国期刊网数据库(CNKI)、万方数据库中的文章进行了没有语言限制的全面、系统的搜索,并实时追踪最新发表的相关主题文献,最后检索日期为2019年12月22日。按照系统评价和荟萃分析优先报告的条目(preferred reporting items for systematic review and meta-analysis,PRISMA)的指导方针[15],使用以下关键词和医学主题词,中文:“替吉奥、非小细胞肺癌、辅助化疗”;英文:“S-1、tegafur-gimeracil-oteracil potassium capsule、non-small cell lung cancer、NSCLC、adjuvant chemotherapy”。此外,对检索到的相关文献的参考文献列表逐一进行手工检索。
1.2 研究选择
纳入标准:(1)研究类型,所有关于替吉奥用于NSCLC辅助化疗的前瞻性临床试验或回顾性分析;在性别、种族、地区、国籍、预处理等方面没有限制,但不能有显著差异;(2)研究对象,所有的试验对象已经过组织学或细胞学确诊为NSCLC;(3)研究方案,涉及以替吉奥为主的NSCLC辅助化疗方案;(4)评价指标,试验至少评估包括完成率,2年无复发生存(RFS)率和严重不良反应发生率这三项结果指标中的一项。
排除标准:(1)个案报告,系统评价,荟萃分析,体外试验,动物实验;(2)无可用研究终点数据;(3)重复发表文献。
1.3 文献筛选
将Cochrane图书馆、PubMed数据库、EMBASE数据库、CNKI、万方数据库检索到的所有文献导入文献管理软件(EndNote X7)。首先,通过EndNote X7软件自带的文献查重功能剔除重复文献。其次,将剩下文献进行手工查重,剔除遗漏的重复文献。随后,由两名评价员根据纳入及排除标准通过浏览标题、阅读摘要、研读全文等流程独立进行筛选。最后,对是否该纳入有争议的文章通过讨论决定。
1.4 数据提取
由两名评价员独立地从纳入的研究中提取数據,过程中遇到分歧时通过讨论决定或由第三人裁定。提取的内容包括:(1)纳入研究的基本特性:第一作者、出版年份、患者人数、中位年龄、性别、病理类型、肿瘤分期、干预措施和主要结果指标;(2)结果指标:直接从文中获得或通过相关统计方法[16-17],从文献中给出的数据表格及Kaplan-Meier生存曲线上提取NSCLC接受替吉奥术后辅助化疗后的2年RFS率。
1.5 质量评估
对于单臂或非对照临床研究,笔者使用Cochrane系统评价手册提供的偏倚风险评估工具纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)对其进行质量评价[18]。评估分数0~3、4~6、7~9分别被评估为差、中等、良好的研究。任何争议均通过讨论解决。
1.6 统计学处理
对于纳入的研究,笔者仅分析了与替吉奥有关的主要结果。输入每个研究的参加人数和主要结果的总百分比,使用Stata 15软件(StataCorp,USA,https://www.stata.com)计算这些准正态分布“比率”的相应标准误。由“比率”和标准误得出95%CI下限(LI)和区间上限(UI)。最后,输出合并效应量(ES),表示中值“比率”和95%CI[19]。ES及其95%CI在森林图中统计和呈现。合并的ES有助于评估替吉奥的益处和风险。不同试验的统计异质性用Q检验和I2检验进行评价[20];如果I2<50%,则认为存在较低的异质性,使用固定效应模型进行效应量的整合。如果I2≥50%并且Q检验的P≤0.1时,可认为各研究间具有显著的异质性,效应量的整合采用随机效应模型[21]。在非比较研究中,由于缺乏相关的对照组,存在很大的主观性,而且倾向于高度异质性[22],因此笔者对所有合并的ES使用随机效应模型,通过漏斗图的视觉鉴定进行发表偏倚的风险评估。
2 结果
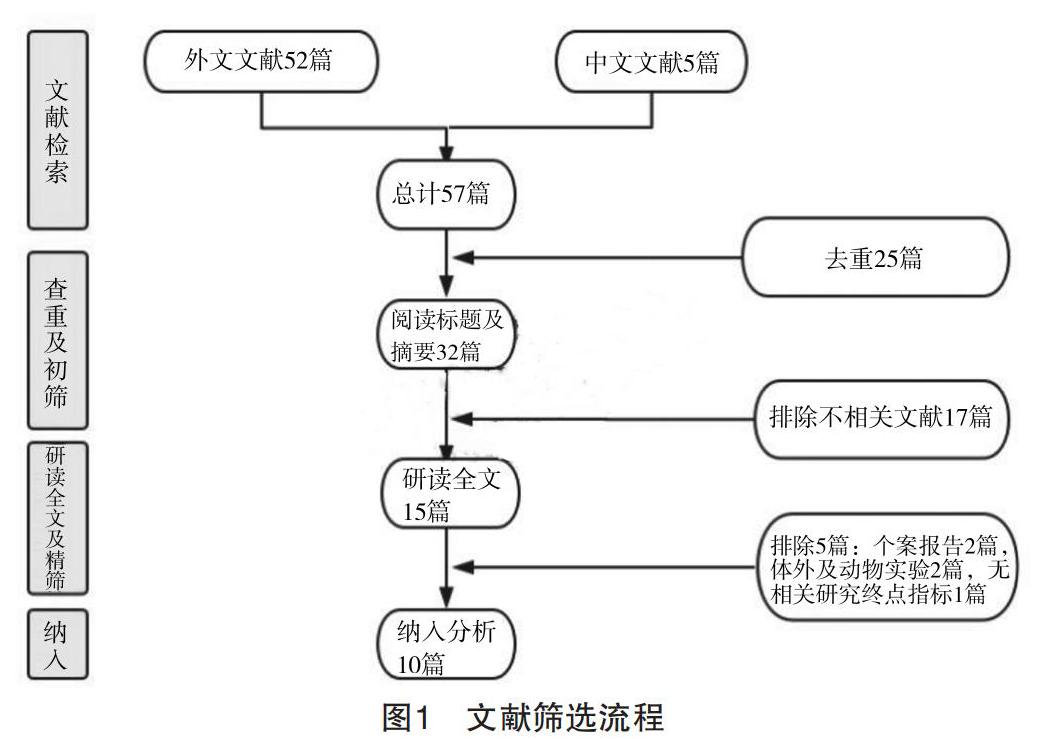
2.1 文献检索
搜索相关数据库后,初检出相关文献57篇,包括外文文献52篇,中文文献5篇。分别来自Pubmed数据库27篇,EMBASE数据库25篇,Cochrane图书馆0篇,CNKI数据库1篇及万方数据库4篇。首先,通过Endnote X7软件及手工查重后剔除25篇重复文献。其次,阅读标题及摘要后排除17篇与本研究内容不相关的文献。随后,经过研读剩余15篇文献全文后,5篇文献因以下原因被剔除:个案报告2篇,体外及动物实验2篇,无相关研究终点指标1篇。最终,纳入10篇文献[5-14]进行分析,具体流程见图1。
2.2 纳入文献信息
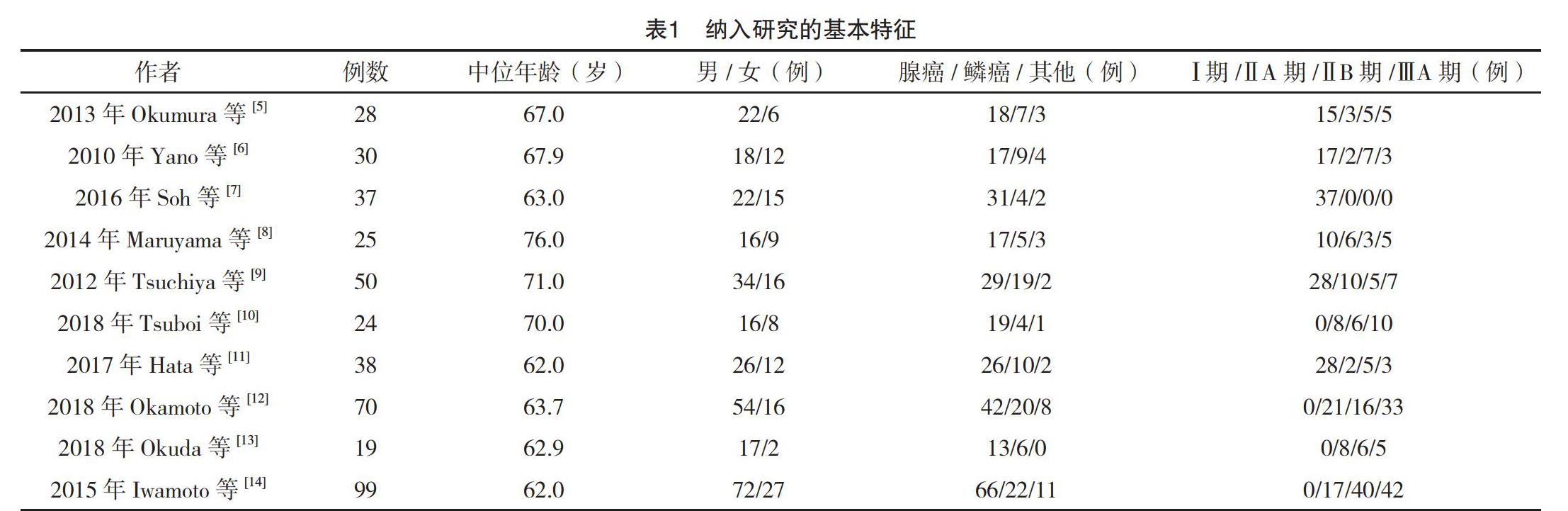
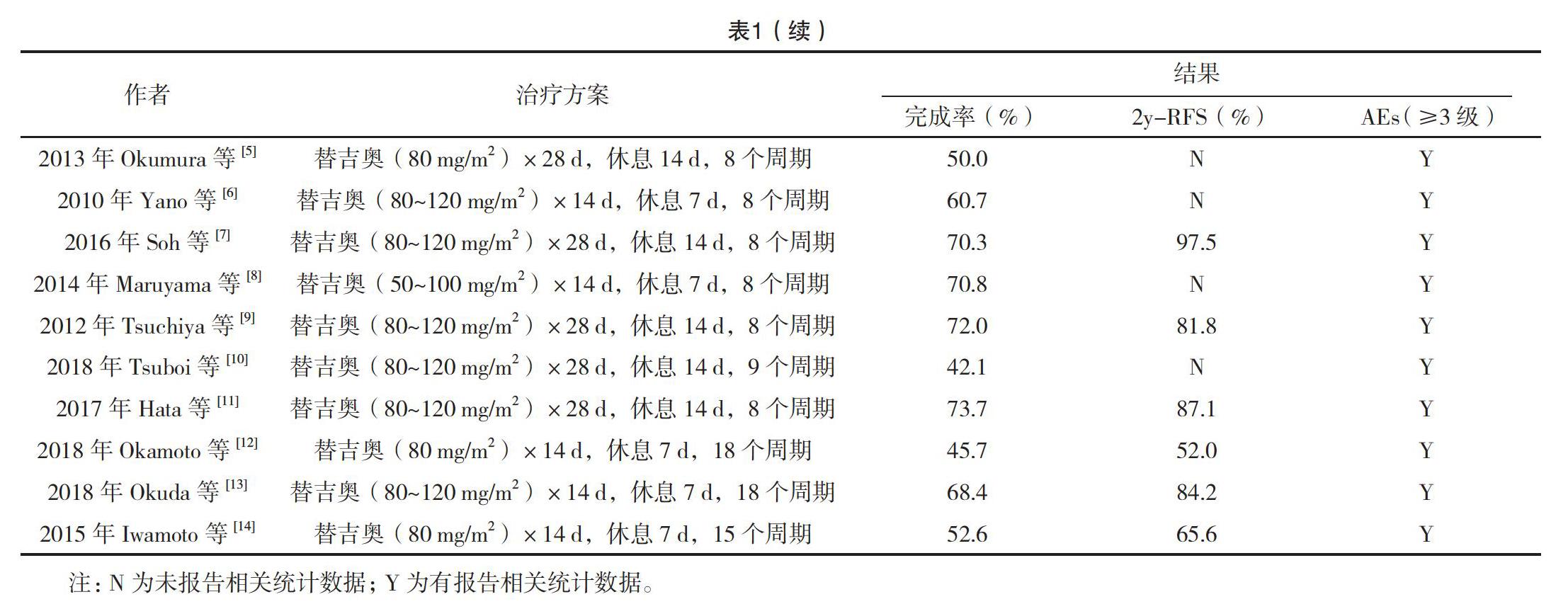
最终纳入的10项研究文献[5-14]均是英文文献,均为前瞻性研究。10项研究共纳入420例患者。主要结果指标包括完成率,2年RFS率和严重不良反应发生率。所有研究均主要纳入Ⅰ~Ⅲ期的患者,见表1。
2.3 方法学质量评价
由于纳入的大部分为单臂或非对照临床研究,笔者根据NOS量表中的评价标准,对每篇纳入的文献进行研究对象选择(共4项,每项1星)、组间可比性(最多可评2星)、结局指标评价(共3项,每项1星)逐项评价,最后统计每篇文献所得的总星数。纳入的10项研究评分均为5~6星,均可认为是中等质量文章,偏倚风险可控,见表2。
2.4 完成率
2.4.1 异质性分析 共10项研究文献[5-14]纳入分析,10项研究间的可信区间彼此均有交集现象,来自Tsuboi等[10]研究的完成率最低,为0.42,Hata等[11]研究的完成率最高,为0.74。经过I2检验,发现I2=61.5%>50%,同时Q检验结果Q=23.38,P=0.005,认为10篇文献异质性较高,故完成率的整合采用随机效应模型。经随机效应模型整合后,10项研究完成率的ES值为0.61(95%CI:0.53,0.68),即10项研究荟萃的完成率为61.0%,森林图见图2。
[6] Yano T,Yamazaki K,Maruyama R,et al.Feasibility study of postoperative adjuvant chemotherapy with S-1(tegaful,gimeracil,oteracil potassium) for non-small cell lung cancer-LOGIK 0601 study[J].Lung Cancer,2010,67(2):184-187.
[7] Soh J,Okumura N,Nakata M,et al.Randomized feasibility study of S-1 for adjuvant chemotherapy in completely resected Stage IA non-small-cell lung cancer: Results of the Setouchi lung cancer group study 0701[J].Jpn J Clin Oncol,2016,46(8):741-747.
[8] Maruyama R,Ebi N,Kishimoto J,et al.A feasibility trial of postoperative adjuvant chemotherapy with S-1,an oral fluoropyrimidine,for elderly patients with non-small cell lung cancer:a report of the Lung Oncology Group in Kyushu(LOGIK) protocol 0901[J].Int J Clin Oncol,2014,19(1):57-62.
[9] Tsuchiya T,Nagayasu T,Yamasaki N,et al.A multicenter phase II study of adjuvant chemotherapy with oral fluoropyrimidine S-1 for non-small cell lung cancer: high completion and survival rates[J].Clin Lung Cancer,2012,13(6):464-469.
[10] Tsuboi M,Kondo K,Takizawa H,et al.A feasibility study of postoperative adjuvant chemotherapy with fluoropyrimidine S-1 in patients with stage Ⅱ-ⅢA non-small cell lung cancer[J].J Med Invest,2018,65(1):90-95.
[11] Hata Y,Kiribayashi T,Kishi K,et al.Adherence and feasibility of 2 treatment schedules of S-1 as adjuvant chemotherapy for patients with completely resected advanced lung cancer:a multicenter randomized controlled trial[J].BMC Cancer,2017,17(1):581.
[12] Okamoto T,Yano T,Shimokawa M,et al.A phase II randomized trial of adjuvant chemotherapy with S-1 versus S-1 plus cisplatin for completely resected pathological stage Ⅱ/ⅢA non-small cell lung cancer[J].Lung Cancer,2018,124(23):255-259.
[13] Okuda K,Yano M,Tatematsu T,et al.S-1 vs paclitaxel plus carboplatin as adjuvant chemotherapy for completely resected stage Ⅱ/ⅢA non-small-cell lung cancer[J].Mol Clin Oncol,2018,8(1):73-79.
[14] Iwamoto Y,Mitsudomi T,Sakai K,et al.Randomized phase Ⅱ study of adjuvant chemotherapy with long-term S-1 versus Cisplatin+S-1 in completely resected stage Ⅱ/ⅢA non-small cell lung cancer[J].Clin Cancer Res,2015,21(23):5245-5252.
[15] Stewart L A,Clarke M,Rovers M,et al.Preferred Reporting Items for Systematic Review and Meta-Analyses of individual participant data: the PRISMA-IPD Statement[J].JAMA,2015,313(16):1657-1665.
[16] Parmar M K,Torri V,Stewart L.Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints[J].Stat Med,1998,17(24):2815-2834.
[17] Tierney J F,Stewart L A,Ghersi D,et al.Practical methods for incorporating summary time-to-event data into meta-analysis[J].Trials,2007,24(8):16.
[18] Wells G A,Shea B J,Connell D O,et al.The Newcastle-Ottawa Scale (NOS) for assessing the quality of non-randomized studies in meta-analysis[J].Appl. Eng. Agric,2014,18(11):727-734.
[19] Ali S A,Donahue R M,Qureshi H,et al.Hepatitis B and hepatitis C in Pakistan: prevalence and risk factors[J].Int J Infect Dis,2009,13(1):9-19.
[20] Higgins J P,Thompson S G,Deeks J J,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[21] Ford A C,Forman D,Hunt R H,et al.Helicobacter pylori eradication therapy to prevent gastric cancer in healthy asymptomatic infected individuals: systematic review and meta-analysis of randomized controlled trials[J].BMJ,2014,348(203):g3174.
[22] Spittal M J,Pirkis J,Gurrin L C.Meta-analysis of incidence rate data in the presence of zero events[J].BMC Med Res Methodol,2015,15(7):42.
[23] Douillard J Y,Rosell R,De Lena M,et al.Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage ⅠB-ⅢA non-small-cell lung cancer(Adjuvant Navelbine International Trialist Association[ANITA]):a randomised controlled trial[J].Lancet Oncol,2006,7(9):719-727.
[24] Pepe C,Hasan B,Winton T L,et al.Adjuvant vinorelbine and cisplatin in elderly patients: National Cancer Institute of Canada and Intergroup Study JBR.10[J].J Clin Oncol,2007,25(12):1553-1561.
[25] The International Adjuvant Lung Cancer Trial Collaborative Group.Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer[J].N Engl J Med,2004,350(4):351-360.
[26] Niho S,Ikeda N,Michimae H,et al.Feasibility trial for adjuvant chemotherapy with docetaxel plus cisplatin followed by single agent long-term administration of S-1 chemotherapy in patients with completely resected non-small cell lung cancer:Thoracic Oncology Research Group Study 0809[J].Br J Cancer,2013,109(3):545-551.
(收稿日期:2020-05-21) (本文編辑:郎序莹)

