白介素-17相关疾病及单抗类药物研究进展
许靖悦,杨永民
作者单位:201203 上海华奥泰生物药业股份有限公司
1993年,Rouvier 等[1]首次从激活的啮齿类 T 细胞杂交瘤中克隆出 CTLA-8(cytotoxic T lymphocyte-associated antigen-8)的 cDNA 序列,并发现其与一种 T 细胞疱疹病毒——松鼠猴疱疹病毒的第 13 个开放阅读框(ORF)有 57% 同源性。1995年,Yao 等[2]发现 CTLA-8 蛋白可以分泌到胞外,能激活成纤维细胞的 NK-κB,诱导 IL-6 的分泌,可以共激活 T 细胞增殖,并基于其类似细胞因子的性质,提议将其命名改为白细胞介素 17(IL-17)。
1 IL-17 简介
1.1 IL-17 的分类及存在形式
迄今为止,IL-17 家族已有 6 个成员被发现:IL-17A(俗称 IL-17)、IL-17B、IL-17C、IL-17D、IL-17E(IL-25)、IL-17F。IL-17A 是 IL-17 家族的原型,IL-17F 与 IL-17 有最高的同源性(约 50%),且其编码基因位于染色体的同一区段 6p12。IL-17B ~ E 与 IL-17 同源性相对较差(16% ~ 30%),且定位在不同染色体上。但这些细胞因子在人鼠之间高度保守(62% ~ 88%)。IL-17A、IL-17E、IL-17F 是重要的促炎症因子,IL-17B、IL-17C、IL-17D 的功能还有待研究[3]。IL-17 家族成员以同源二聚体或异源二聚体的形式行使功能。
1.2 IL-17 的细胞来源
IL-17A 和 IL-17F 最初被发现是由激活的 CD4+T 细胞分泌。这一类特征性分泌 IL-17A 和 IL-17F 的 T 细胞亚群被称为 Th17 细胞。目前认为 Th17 细胞受 IL-23(IL-12 家族成员)、TGF-β、IL-6 调控。Th17 分化有两条途径:① IL-23/IL-1 途径,IL-23 诱导 CD4+T 细胞分化为 Th17 细胞,此过程需要 IL-1 分子。IL-23/IL-1 介导的 IL-17 产生是通过 STAT3、NF-κB 等信号途径来完成。 ② TGF-β、IL-6 能诱导 Th17 细胞的产生。
除了 Th17 细胞以外,细胞毒性 CD8+T 细胞(Tc17)、γδT 细胞、自然杀伤 T 细胞(NKT-17)和 B 细胞也能在特定条件下表达 IL-17A 和 IL-17F。先天免疫细胞,包括单核细胞、中性粒细胞、自然杀伤细胞和淋巴组织诱导样(Lti-like)细胞也可以产生 IL-17A 和 IL-17F[4]。在一项关于锥虫感染的研究中发现,B 细胞也可以产生 IL-17A 和 IL-17F[5]。一些非免疫细胞,比如肠道潘氏细胞和肠上皮细胞也可以在应激情况下产生 IL-17A 和 IL-17F。由于 Th17 细胞在体内的分布最广,而且在炎症反应中有广泛作用,所 以,通常认为它还是 IL-17A 和 IL-17F 的主要来源细胞[4]。
1.3 IL-17 成员的组织表达
IL-17 在体内主要在活化的 T 细胞中表达,也有个别成员在组织中表达,例如 IL-17B 也可见在某些外周组织中有表达,IL-17D 在肌肉和神经系统有表达,详见表 1。

表1 IL-17 成员的组织表达
1.4 IL-17 的受体
IL-17 结合 I 型细胞表面的受体称为 IL-17R,IL-17R 家族由五个成员组成:IL-17RA ~ IL-17RE。IL-17A 与 IL-17F 以同源二聚体或异源二聚体的形式结合 IL-17RA 和 IL-17RC,形成受体复合物来转导信号,并参与机体自身免疫疾病、多种炎症反应以及宿主抗感染免疫反应[3]。IL-17C 结合 IL-17RA 和 IL-17RE 的受体复合物能激活下游信号,促进机体抗感染免疫、自身免疫疾病和炎症反应。IL-17B 被发现可以结合 IL-17RB,但其下游信号仍不清楚。IL-17D 的受体及下游信号目前仍不清楚[3-4]。
1.5 IL-17 的信号通路
IL-17A 与 IL-17F 主要通过诱导靶细胞表达多种炎症因子和趋化因子来发挥其促进炎症反应的功能[4]。IL-17A 与细胞表面受体 IL-17RA 结合,招募 IL-17RC 形成异源二聚体作为受体,介导下游信号通路。IL-17 与其受体结合后能激活 TNF 受体相关因子 6(TNF-receptor associated factor 6,TRAF6)。IL-17 与 IL-1 及 TNF 共用相同的转录途径,它可以激活 NF-κB 和 3 个丝裂原活化蛋白(MAP)酶,包括 ERK1、ERK2、JNK、p38。这些通路在滑膜细胞和软骨细胞中都有发现。
2 IL-17 相关的疾病
越来越多的研究发现,IL-17 与多种炎症疾病相关,针对 IL-17 靶点的药物研究也逐步增多,目前临床上主要针对的适应证有银屑病、银屑病关节炎和强直性脊柱炎等。
2.1 银屑病
2.1.1 银屑病概述 银屑病是一种遗传与环境共同作用诱发,免疫介导的慢性、复发性、炎症性及系统性疾病,典型临床表现为鳞屑性红斑或斑块,局限或广泛分布,无传染性,治疗困难,常罹患终身。临床分为寻常型银屑病、脓疱型银屑病、红皮病型银屑病和关节病型银屑病 4 种类型,其中以寻常型银屑病最为常见[6]。银屑病常与一些系统性疾病相关联,如代谢综合征、心血管疾病等,常因疼痛、瘙痒、搔刮后出血等表现,严重影响人们的生活质量并带来巨大的心理负担。
2.1.2 银屑病的流行病学 目前自然人群银屑病患病率约为 2%[7],但在不同种族中的患病率存在着明显差异。据统计,欧洲患病率最高的是丹麦(2.9%),美国患病率在 2.2% ~ 2.6% 之间,每年约有 15 万新增病例[8],而亚洲患病率较低约为 0.3%[9]。1984年我国银屑病流行病学调查发现北方(0.227%)患病率略高于南方(0.153%)[10],2008年中国六省市银屑病流行病学调查发现总患病率为 0.47%[11],目前我国患病率呈现逐年增高的趋势。男女患病率大体相同,银屑病可以在任何年龄段发病,但发病高峰年龄为 15 ~ 30 岁[12]。目前,我国有逾 650 万银屑病患者,约 30% 病情已发展为中重度。
2.1.3 银屑病的发病原因及发病机制 银屑病病因复杂,发病机制尚不完全明确,近年来研究认为其病因与遗传、环境及免疫等多种因素相关。据报道,银屑病遗传率为 60% ~ 90%,是所有多因素遗传病中遗传率最高的疾病之一[13]。免疫系统异常是银屑病皮损组织的特征性表现之一,也是银屑病发病机制研究的主要切入点[14]。目前发现的参与银屑病发病的 T 细胞亚群主要有 CD4+Th1 细胞、Th17 细胞和 Th22 细胞等。这些特定亚群的 T 淋巴细胞迁移至皮肤组织,释放多种细胞因子导致免疫功能异常,从而促进银屑病的发生发展[15]。研究表明,IL-23/Th17/IL-17 轴是银屑病发病机制中的关键环节[16]。IL-17 通过刺激抗微生物肽、促炎性细胞因子及趋化因子的释放,在宿主对抗外界病原体的固有免疫防御机制中发挥重要作用[17]。银屑病或其他局部炎症患者皮损处 Th17 细胞分泌的 IL-17A 与表皮角质细胞表面的 IL-17R 结合后使得角质细胞释放促炎症介质,招募更多的 Th17 细胞、中性粒细胞、树突状细胞以及淋巴细胞,从而建立了一个维持银屑病或其他局部炎症患者皮损处炎症反应的反馈回路。有研究者认为银屑病患者血清中 IL-17 的浓度与疾病的活动性相关[14]。因此,IL-17 是一个理想的局部炎症治疗靶点[18]。
2.2 银屑病关节炎
2.2.1 银屑病关节炎概述 银屑病性关节炎(psoriatic arthritis,PsA)是一种与银屑病相关的慢性、炎症性关节炎, 患者临床可表现为寡关节炎或多关节炎,部分患者可有骶 髂关节炎和(或)脊柱炎,附着点炎、指(趾)炎、非对 称性寡关节炎的特征性表现。PsA 的具体表现形式复杂、多变,且致残率非常高,严重影响患者的工作能力和生活质量[19]。
2.2.2 银屑病关节炎的流行病学 世界各国的 PsA 流行病学研究显示,PsA 在美国的患病率从 0.06% ~ 0.25% 不等,在土耳其和捷克的患病率约为 0.05%,瑞士的患病率约为 0.21%,在布宜诺斯艾利斯的患病率为 0.07%,在中国患病率为 0.02%;虽然 PsA 在普通人群中发病率较低,但在银屑病患者中很常见,患病率为 6% ~ 41% 不等;据估计,PsA 影响全球多达 5000 万人。在诊断为银屑病后,随着时间的延长,银屑病性关节炎患病率递增,据研究统计,诊断为银屑病后的 5年、10年和 20年,PsA 发病率分别为 1.7%、3.1% 和 5.1%[20]。
2.2.3 银屑病关节炎的现有治疗策略 PsA 治疗的主要目的是控制炎症、预防关节损伤和失能。治疗方法主要包括非药物治疗、对症治疗和药物治疗。通常而言,肿瘤坏死因子抑制剂(tumor necrosis factor inhibitor,TNFi)优于白细胞介素-17 抑制剂(interleukin-17 inhibitor,IL-17i),IL-17i 优于 IL-12/23i,生物制剂单药治疗优于联合治疗[21]。
2.3 强直性脊柱炎
2.3.1 强直性脊柱炎概述 强直性脊柱炎(ankylosing spondylitis,AS)是一种慢性炎症性疾病,主要侵犯骶髂关节、脊柱骨突、脊柱旁软组织及外周关节,并可伴发关节外表现。严重者可发生脊柱畸形和关节强直[22]。患者表现为腰背部疼痛、僵直,合并外周关节炎、眼葡萄膜炎、炎性肠病等[23]。
2.3.2 强直性脊柱炎的流行病学 AS 流行病学不同地区患病率有所不同。研究显示:AS 在中国的患病率约为 0.3%,在瑞典的患病率为 0.18%,在加拿大的患病率为 0.6%,在墨西哥的患病率约为 0.09%,美国的患病率约为 0.23%,在法国的患病率约为 0.43%。非放射性轴性脊椎骨关节炎患者可向 AS 进展,估计 5年内和 10年内进展为 AS 的患病率分别为 5.1% 和 19%[24]。该病患病率较高、且致残率高,是较严重的公共卫生问题。
2.3.3 强直性脊柱炎的发病原因及发病机制 AS 的发病原因及发病机制尚不十分明确,目前认为其病因及病机相关因素主要包括遗传、环境及免疫等。人类主要组织相容性复合体(MHC)中的 HLA-B27 基因的表达与 AS 有高度相关性,在发病因素中占主导地位[25]。AS 患者高表达 TNF-α、IL-17 和 IL-23 等细胞因子,是 AS 发病机制中重要的细胞因子[25-26]。
2.3.4 强直性脊柱炎的治疗策略 AS 的主要治疗手段包括:非药物治疗、药物治疗和手术治疗。2015年美国风湿病学会 AS 指南采用的策略为:①推荐将非甾体类抗炎药 NSAIDs 作为 AS 的首选用药;②对 NSAIDs 无反应的AS 患者推荐使用 TNF 抑制剂;③对于已经使用 NSAIDs仍病情活动,但又禁忌使用 TNF 抑制剂的 AS 患者推荐使用慢作用抗风湿药柳氮磺吡啶和帕米磷酸盐;④糖皮质激素不推荐全身使用,而对于符合条件的 AS 患者推荐局部应用糖皮质激素[27]。

表2 以 IL-17 为靶点的已上市单克隆抗体药物
3 IL-17 靶点的单抗类药物
随着人们对 IL-17 越来越了解,对其相关的疾病研究越来越深入,不少药企开始研究针对 IL-17 的治疗药物。以全球首个获批的 Secukinumab 为代表的 IL-17 抑制剂开启了银屑病等自身免疫疾病治疗的新篇章,突破了生物制剂只能作为二线系统性疗法的瓶颈。据了解,目前针对 IL-17A 和(或)IL-17F 的药物疗效显著,在研的和已上市的产品以单克隆抗体类药物为主。
3.1 已上市的 IL-17 抑制剂
目前,FDA 已批准上市的抗 IL-17A 单抗类药物有 Secukinumab(Cosentyx®)和 Ixekizumab(Taltz®),可用于治疗斑块型银屑病、银屑病关节炎和强直性脊柱炎,两者均于 2019年获得 NMPA 批准在中国上市;Netakimab(Efleira®)于 2019年在俄罗斯批准用于银屑病。此外,Brodalumab(Siliq®)为 IL-17RA 抑制剂,已于 2017年在美国批准上市,详见表 2。
IL-17 抑制剂在进入临床后,显示了疗效好、副作用小等优点。以中国上市的两个 IL-17 抑制剂为例:在 Cosentyx®(Secukinumab)的 III 期临床 FIXTURE 试验中, Secukinumab 150 mg、Secukinumab 300 mg 和 Etanercept(依那西普)组治疗 12 周后,3 组的 PASI75 分别为 67%、77% 和 44%,均显著高于安慰剂组 5%。IGA 改善率分别为 51%、63% 和 27%,也均显著高于安慰剂组 3%。同时,Secukinumab 150 mg 和 300 mg 组 PASI75 指标和 IGA 改善率均显著高于依那西普组。在 Ixekizumab(Taltz®)的 III 期临床试验 UNCOVER 的一项研究中,分为 Ixekizumab q2w 组(首剂量 160 mg,随后 80 mg, 2 周/次)、Ixekizumab q4w 组(首剂量 160 mg,随后 80 mg,4 周/次)、安慰剂组,依那西普 50 mg/次,2 周/次。治疗 12 周后,Ixekizumab 组的 PASI75 和 sPGA 改善率均显著优于依那西普。
Secukinumab 在中国 III 期研究的 52 周数据公布显示,这项多中心、随机、双盲、安慰剂对照的试验,入组中国患者 441 例,评估了 Secukinumab 治疗中国中重度斑块状银屑病患者的长期疗效和安全性。患者按照 2:1:1 随机 分组,分别皮下注射 Secukinumab 300 mg(n = 221),Secukinumab 150 mg(n = 110),安慰剂(n = 110)。经过 52 周的观察,Secukinumab 在中国患者中疗效持久,在安全性方面也表现良好。
Secukinumab 最常见(> 1%)的不良反应是鼻炎、腹泻和上呼吸道感染。Ixekizumab 最常见(≥ 1%)的不良反应是注射部位反应、上呼吸道感染、恶心和真菌感染。该类药物可能增加感染的风险,也可能加重克罗恩病,在临床使用中,还应对结核(TB)感染患者进行评估,且在治疗过程中应避免使用活疫苗[28-29]。
3.2 国内外在研的 IL-17 抑制剂
除了已上市的品种外,国内外还有多家机构投入资源开展针对 IL-17A 和(或)IL-17F 的药物研发,例如研发较快的单抗是 UCB 的 Bimekizumab、AbbVie 的 ABT-122,二者均已开展了临床 III 期研究,近期已申报上市。据报道,UCB 之前公布了评估 Bimekizumab 治疗中度至重度慢性斑块型银屑病成人患者 III 期临床研究 BE SURE 的阳性结果。该研究将 Bimekizumab 与 Humira(修美乐,通用名:阿达木单抗)进行了比较,结果显示,研究达到了全部主要和次要终点。Bimekizumab 是一种具有双重作用机制的分子,可同时中和 IL-17A 和 IL-17F。
同时,随着我国生物医药技术的高速发展,国内也有多家有实力的机构开展了针对 IL-17A 和(或)IL-17F 的单抗研发。国内目前已有 8 家企业申报 IND(收集自 NMPA 官方数据),见表 3。
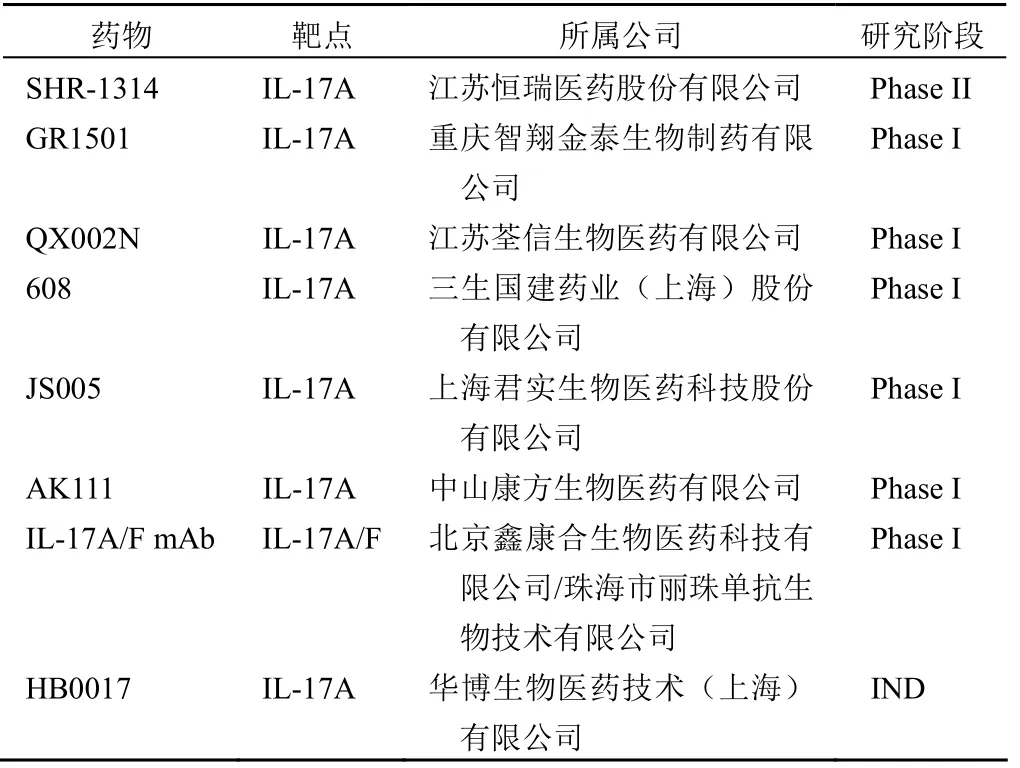
表3 我国在研的以 IL-17 为靶点的单克隆抗体药物
4 展望
目前,虽然临床上的药物治疗还不能彻底治愈银屑病等自身免疫疾病,但大部分药物能抑制临床症状,改善患者的生活质量。针对自身免疫疾病的生物制剂发现以来,以阿 达木单抗、依那西普、英夫利西单抗等为代表的 TNF 靶点抑制剂多年占据着主要市场。随着人们对自身免疫疾病的 相关靶点的更深入研究,以 IL-17 为靶标的药物在临床上表现日益突出,开启了自身免疫疾病的新时代。Cosentyx 和 Taltz 最初进入市场时的售价较高,虽然国内价格降低 3000 ~ 4000 元/支,但一年或长期使用的价格对大众而言仍然有负担。随着我国在生物医药领域的投入不断加大,专业人才培养的不断加强,国内涌现出大批拥有自主知识产权、自主研发能力的机构,在策略上能够迅速布局跟进新靶点药物的研发。相信在不久的将来,由我国自主研发的 IL-17 靶点的单抗类药物也会进入市场,为广大患者提供更多经济实惠、疗效保障的选择。

