程序性细胞死亡配体1蛋白的表达对非小细胞肺癌生存率的影响
朱婉凌 魏然 贾金广
肺癌死亡率位居恶性肿瘤第一位,根据病理类型将其分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占肺癌的80%[1]。近年来,尽管治疗NSCLC的方法在不断改善,但患者的总生存率仍没有显著提高[2]。免疫疗法为新兴的治疗方法,可提高早期(或晚期)NSCLC转移性患者的生存率[3]。免疫疗法主要通过恢复宿主的免疫能力进而识别和根除肿瘤细胞,PD-1/PD-L1是肿瘤细胞获得免疫逃逸的重要检查点,阻断PD-1或PD-L1均可提高抗肿瘤免疫反应[4]。NSCLC的临床特征除了PD-L1表达改变外,还与致癌基因和抑癌基因的改变相关[5]。NSCLC中可能涉及的突变致癌基因为丝裂原活化蛋白激酶途径的组成部分,例如Kirsten大鼠肉瘤病毒致癌基因和B-Raf原癌基因突变[5]。在多种癌症中高肿瘤突变负担,包括NSCLC在内对免疫治疗反应较敏感,尤其是PD-1/PD-L1/CTLA-4的免疫治疗[6-8]。本研究主要检测PD-L1的表达与NSCLC相关的常见体细胞突变(EGFR、KRAS)的关系,并分析PD-L1表达与接受化疗的NSCLC患者预后的影响。
资料与方法
一、一般资料
选取2013年1月-2015年1月在郑州人民医院接受手术治疗的NSCLC患者132例,男性95例,女性37例,年龄(62.4±11.7)岁。收集患者的一般临床资料主要包括:性别、年龄、吸烟指数、病理类型、临床化疗、肿瘤分期、淋巴结转移和EGFR,KRAS类型。行肺癌楔形切除术、CT引导下经皮肺穿刺活检术取材,术后石蜡切片常规HE染色或免疫组化(immunohistochemistry,IHC)证实为NSCLC。排除手术前接受放疗、化疗、靶向基因治疗或免疫治疗的患者。术后均接受以顺铂为基础的化疗,包括多西他赛联合顺铂、长春新碱联合顺铂和紫杉醇联合顺铂,治疗周期为21d,化疗3个周期,纳入研究的患者均按化疗计划完成。本研究经过医院伦理委员会批准,患者同意并签署知情同意书。
二、方法
1 IHC检测NSCLC组织中PD-L1表达的水平
石蜡切片置于60℃烘箱中30min,室温放凉后置于二甲苯中脱蜡,然后将玻片依次置于梯度酒精中水化,最后用PBS冲洗。取一定量EDTA缓冲液加入耐高温微波盒中,将组织切片置于配套的塑料玻片架上,放入缓冲液中加热。室温自然冷却,从缓冲液中取出玻片用PBS冲洗。吸水纸将组织周围多余水分吸干,每张玻片加100 μl 5%BSA室温封闭30 min。直接吸去切片上多余的BSA液体,每张切片加20 ul稀释的PD-L1一抗(1:1000)置于湿盒中 4℃冰箱孵育过夜。从冰箱中取出,室温复温10 min,用PBS冲洗3次,每次5min。吸去组织周围多余水分,每张切片加50 ul相应种属二抗(1:4000),室温下孵育60 min,PBS冲洗3次,每次5min。每张切片加100 ul新鲜配制的DAB显色液,在显微镜下观察组织颜色变化,出现棕褐色时立即将切片置于自来水中终止显色。1%盐酸酒精中分化3-5s,自来水冲洗10 min返蓝(避免直接冲刷组织),切片经梯度酒精脱水,二甲苯透明,中性树胶封固,通风橱中晾干,显微镜下观察。肿瘤细胞膜PD-L1阳性细胞数>25%定义为PD-L1的高表达,肿瘤细胞膜PD-L1阳性细胞数≤25%定义为PD-L1的低表达。
2 EGFR、KRAS突变检测
提取肿瘤组织样本中DNA,PCR扩增EGFR基因18 ~ 21外显子、KRAS 基因2 ~ 3外显子区域,使用PSTAR-Ⅱplus高通量基因测序仪(华因康,IDN01-M-P3)进行测序,采用软件Pstar-Ⅱ6.0.4 build3 进行生物学分析。
三、统计分析
采用SPSS21.0进行数据分析,计数资料用百分数(%)表示,组间比较采χ2检验,组间生存率比较采用Log rank检验,单因素和多因素logistic回归分析影响NSCLC患者生存率的危险因素,P<0.05为差异有显著性。
结 果
一、PD-L1的表达水平与患者临床特点的关系
PD-L1高表达患者47例,低表达患者85例,两组患者在性别、年龄、吸烟指数、病理类型、临床化疗和KRAS类型差异均无统计学意义(P>0.05),在肿瘤分期、淋巴结转移和EGFR类型之间差异具有统计学意义(P<0.05)(见表1)。
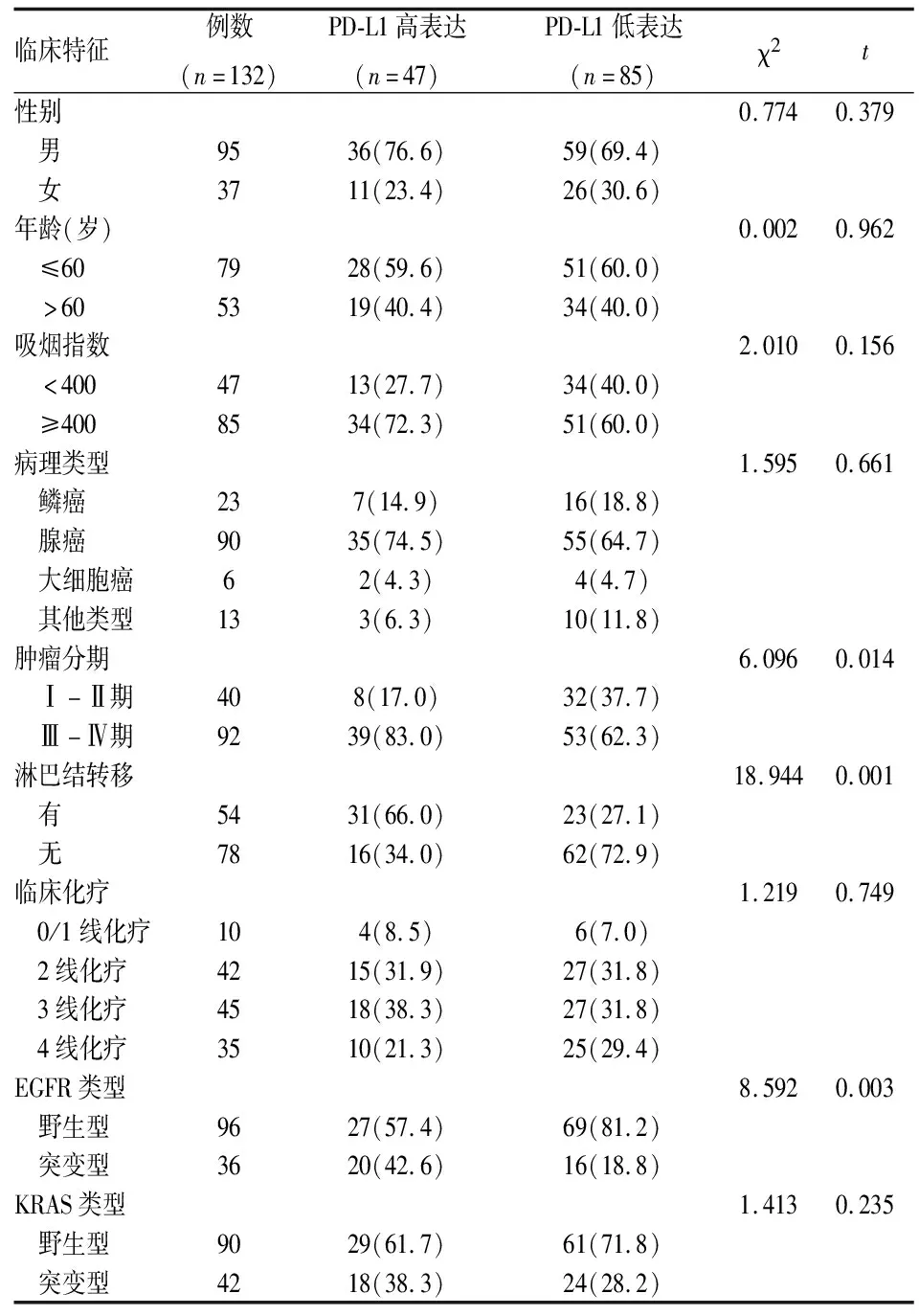
表1 PD-L1的表达水平与患者临床特点的关系[n(%)]
二、PD-L1高表达组与低表达组患者生存率的比较
PD-L1高表达组患者的5年无进展生存率为36.2%,显著低于PD-L1低表达组56.5%(log-rank=4.849,P=0.028),PD-L1高表达组患者的5年生存率为44.9%,显著低于PD-L1低表达组63.5%(log-rank=3.897,P=0.048)(见图1)。
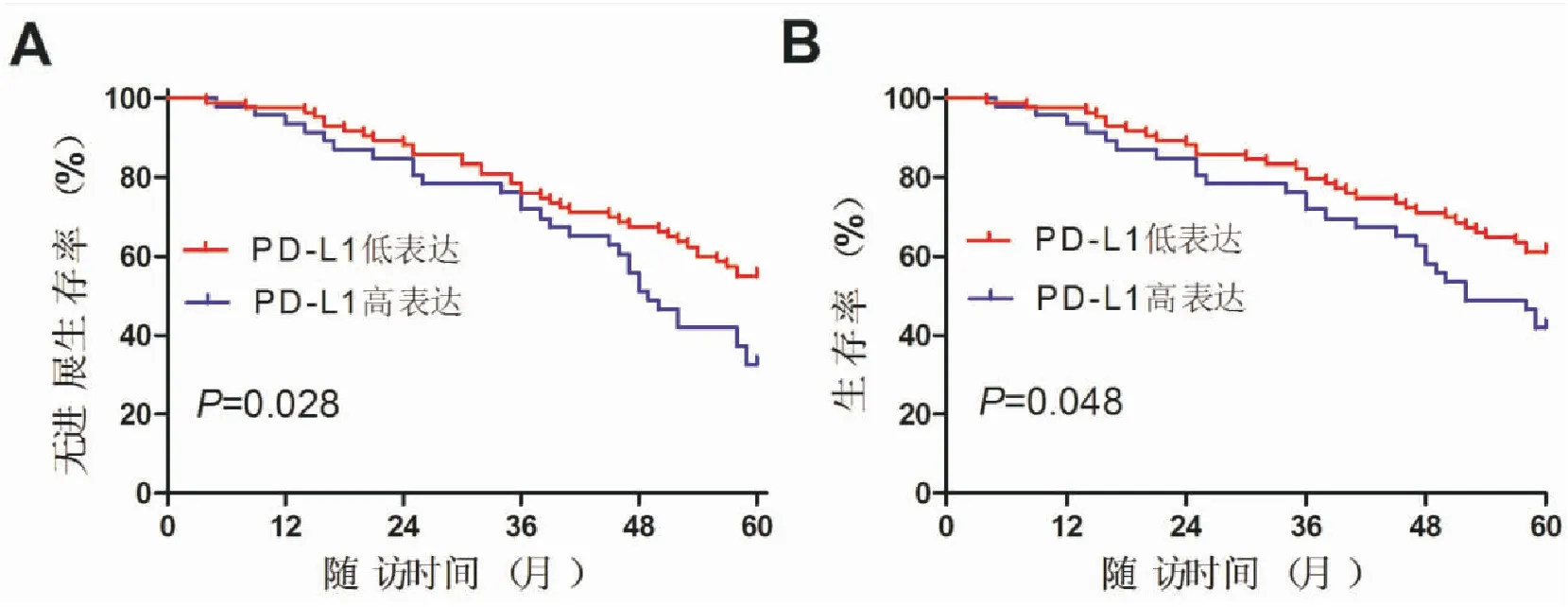
图1 PD-L1高表达组与低表达组患者5年无进展生存率和总生存率的比较
三、单因素和多因素回归分析影响NSCLC患者生存率的危险因素
经单因素和多因素回归分析显示,肿瘤分期III-IV期、EGFR突变和PD-L1高表达为影响NSCLC患者生存率的独立危险因素(见表2)。
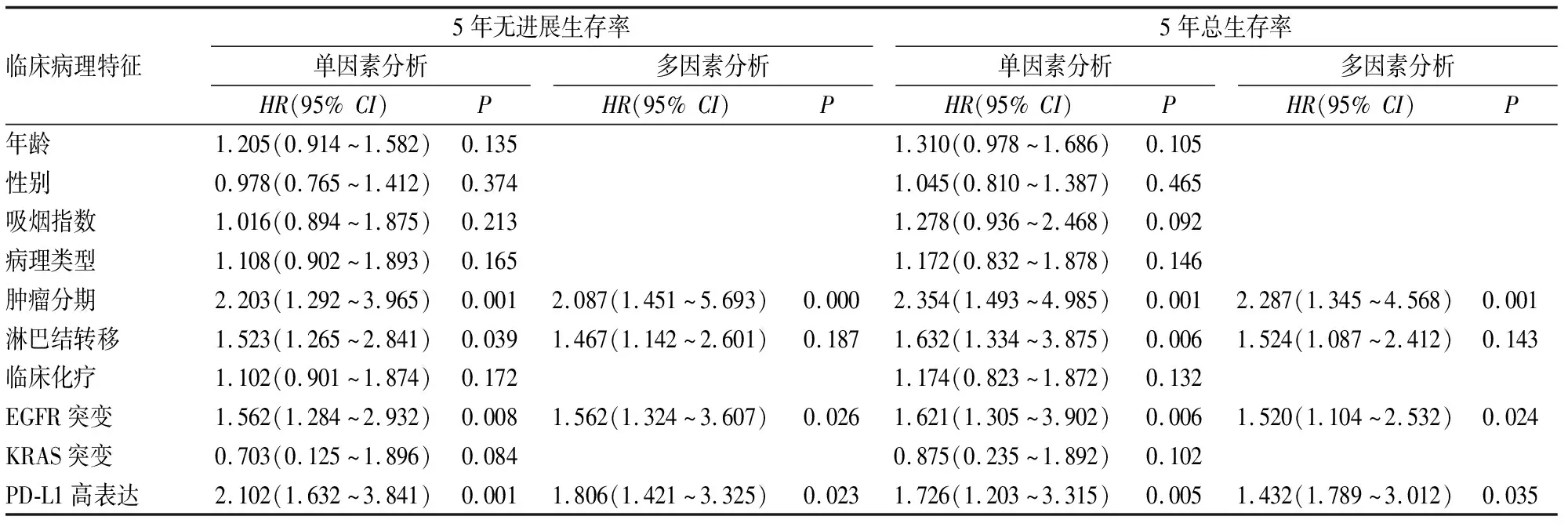
表2 单因素和多因素回归分析影响NSCLC患者生存率的危险因素
讨 论
目前,越来越多的研究显示PD-L1的表达情况与肿瘤的抑癌基因或致癌基因的突变状态显著相关。在NSCLC中尤其是肺腺癌,EGFR基因突变是最常见的突变类型,PD-L1的表达与EGFR基因突变密切相关[9-10]。Chen N等的研究报道显示,通过激活EGFR信号通路可导致PD-L1的表达水平上调,EGFR-TKIs不仅可直接减弱肿瘤细胞的生存能力,还可以通过下调PD-L1间接增强抗肿瘤免疫力[11]。同时NSCLC细胞系试验证实,EGFR突变状态与PD-L1表达情况显著相关[12]。本文的实验数据结果显示,在132例患者中EGFR突变率27.3%(36/132),其中PD-L1阳性患者20例,PD-L1阴性患者16例,PD-L1阳性表达与EGFR突变相关。本研究中PD-L1的阳性表达率为35.6%,明显低于EL-GUINDY等研究NSCLC中PD-L1的阳性表达率65.5%[13],而与Chen等研究1071例NSCLC患者PD-L1的阳性表达率33.7%的阳性率相当[14]。结合本研究结果提示,对于PD-L1阳性表达和EGFR突变的NSCLC患者,采用EGFR-TKIs和PD-L1免疫检查点抑制剂联合治疗,可能会达到理想的临床效果。
PD-L1是肿瘤细胞中检测的关键免疫点,可与T细胞上的PD-1相结合,有效抑制机体的抗肿瘤免疫反应,从而使得癌细胞逃避T细胞介导的免疫杀伤[15]。已有多项研究显示,PD-L1的表达与恶性肿瘤患者的生存率相关,包括肾癌、食管癌、肝癌、胃癌、胰腺癌、结、直肠癌等。但是,PD-L1的表达情况与NSCLC患者临床预后的相关性还有一定的争议,有研究表明,PD-L1表达阳性的NSCLC患者的OS低于PD-L1阴性表达患者[16]。另外还有研究显示,PD-L1高表达NSCLC患者预后更佳[17]。本文的研究结果显示PD-L1高表达NSCLC患者的无进展生存率和总生存率均低于PD-L1低表达患者。多因素回归分析表明,肿瘤分期III-IV期、EGFR突变和PD-L1高表达为NSCLC患者生存率的独立危险因素。PD-L1的高表达伴有EGFR突变可能为患者接受EGFR-TKIs治疗的潜在预测指标。综上所述,PD-L1在NSCLC患者中表达水平升高,与患者的肿瘤分期、淋巴结转移、EGFR突变密切相关。PD-L1高表达和EGFR突变为影响患者5年生存率的独立危险因素,EGFR-TKIs和PD-L1免疫检查点抑制剂联合治疗可能为一种有效的联合治疗方案。

