盐酸雷尼替丁胶囊溶出一致性评价方法的探索研究
刘涛 王群葆 曹旭 杨凤巧 李斌
【摘 要】本文建立了盐酸雷尼替丁胶囊溶出一致性评价试验方法,并进行了相应的方法学验证,该方法可以用于国内盐酸雷尼替丁胶囊的溶出一致性考察。
【关键词】盐酸雷尼替丁胶囊 溶出度 一致性评价
【中图分类号】R19【文献标识码】B【文章编号】1672-3783(2020)11-33--02
盐酸雷尼替丁胶囊为抗酸药及抗溃疡病药,是一种临床上广泛应用的胃药。目前,我国正在进行药物溶出一致性评价工作,比较仿制药与原研药品的质量。盐酸雷尼替丁胶囊现行标准并未收载溶出度试验方法,对各企业均采用自己制定的溶出方法进行评价,由于方法的不统一,导致企业的评价并不具有代表性和可比性。本实验室通过对SandozInc和DRREDDYSLaboratoriesLimitied(简称DR)两家参比制剂和11个国内生产厂家的盐酸雷尼替丁胶囊溶出行为进行考察,建立了溶出度检查方法。本文以此为依据,建立科学有效的溶出度一致性评价方法。
1 仪器与试药
1.1 仪器 智能溶出仪(天大天发RC12ADK);紫外分光光度计(日本岛津UV-2450);电子天平(梅特勒MS205DU)。
1.2 试药 盐酸雷尼替丁对照品:批号为100163-201607,来源为中国食品药品检定研究院;盐酸雷尼替丁胶囊样品:厂家A(批号:LN17040102),厂家B(批号:B07170207),规格均为0.15g/粒,
2 溶出一致性评价方法建立
2.1 溶出介质 溶出介质选择水、盐酸溶液(pH1.2)、醋酸盐缓冲液(pH4.5)和磷酸盐缓冲液(pH6.8)四种。
2.2 溶出一致性评价方法 取本品12粒,溶出介质1000ml,转速50转/分钟,篮法,取样时间点为5、10、15、30、45min(如有必要增加取样点60、90、120、180、240min),精密量取滤液5ml,置50ml量瓶中,用水稀释至刻度,摇匀,(溶出介质为pH1.2盐酸溶液时,直接量取滤液进行测量),照紫外-可见分光光度法(通则0401),吸光度测量波长为314nm;另取对照品适量,用溶出介质溶解并定量稀释成相应浓度的溶液,同法测定,并将结果乘以0.8961,计算每粒溶出量。以时间为横坐标,不同时间点的平均溶出量为纵坐标,得出溶出曲线。
2.3 专属性 取常用辅料淀粉、滑石粉等,按照2.2方法稀释,在30分钟取样并测量,辅料的测量值对样品测量无影响。
2.4 胶囊壳 取相应样品的空胶囊壳,清洗干净,照2.2方法,在30分钟取样测定,胶囊壳的测量值对样品测量无影响。
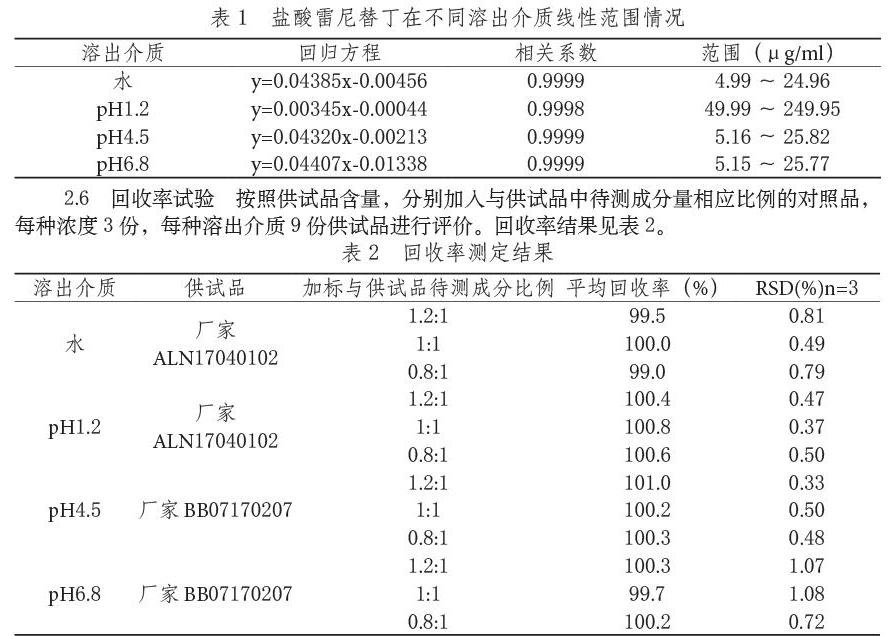
2.5 线性范围 取盐酸雷尼替丁对照品用溶出介质稀释至相应浓度,线性范围情况见表1。
2.7 精密度试验 取2.2中对照品溶液,连续测定6次,在水中吸光值的RSD值为0.16%、pH1.2中为0.17%、pH4.5中为0.13%、pH6.8中为0.05%。
2.8 溶液稳定性试验 取2.2中对照品溶液,吸光度测定时间为0h、0.5h、1h、2h、4h、6h、8h、10h,在水中吸光值的RSD值為0.29%、pH1.2中为0.31%、pH4.5中为0.08%、pH6.8中为0.12%。
3 讨论
3.1 盐酸雷尼替丁胶囊现行标准未收载溶出度试验方法,现行标准的盐酸雷尼替丁含量测定为液相色谱法,该方法为30分钟梯度,完成一个批次的溶出一致性评价至少需要7200分钟,流动相为高盐溶液,对连续长时间使用对色谱柱损害较大,使用液相色谱法作为溶出一致性评价含量测定方法时间长,成本高,因此,本文以紫外分光光度法建立了盐酸雷尼替丁胶囊溶出一致性评价试验方法,并进行了专属性等方法学验证,该方法可以用于国内盐酸雷尼替丁胶囊的溶出一致性考察。
3.2 在本文建立的方法中,pH1.2(盐酸溶液)溶出介质的稀释方法与其他三种介质不同。《中国药典》规定,紫外分光光度法测量的吸光度读数应该在0.3-0.7之间。盐酸雷尼替丁在pH1.2(盐酸溶液)溶出介质中的吸光度要低于其他三种溶出介质,如果按其他三种溶出介质稀释方法,吸光度测得值仅为0.05左右,因此,其稀释倍数比其他三种溶出介质少稀释十倍,供试品在四种介质中的吸光度读数才能符合要求。
参考文献
乔满辉.盐酸雷尼替丁原料工艺改进的研究[D].天津:天津大学,2008.
国家药典委员会,中华人民共和国药典:2015版.二部[M].,北京:中国医药科技出版社,2015:1106-1107.
袁艳,不同溶出介质评价盐酸雷尼替丁胶囊内在质量[J].海峡药学,2014,26(11):94-96.
文丽丽,柏学敏,盐酸雷尼替丁胶囊溶出度检查方法研究[J].黑龙江医药,2011,24(6):879-880.

