疏叶骆驼刺与花花柴互作对氮素固定和根际微生物的影响
郭平林,刘 波,张志浩,荆瑞雪,张 波,曾凡江,*
1 中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室,乌鲁木齐 830011 2 山东省水土保持与环境保育重点实验室,临沂大学资源环境学院,临沂 276005 3 中国科学院新疆生态与地理研究所新疆荒漠植物根系生态与植被修复实验室,乌鲁木齐 830011 4 新疆策勒荒漠草地生态系统国家野外科学观测研究站,策勒 848300 5 中国科学院大学,北京 100049
植物的种间互作以及植物与土壤间的养分循环直接或间接地影响着土壤微生物的群落结构[1],合理的种间搭配也可提高互作植物的生物量和对各种资源的利用效率[2-3]。这种植物之间的相互作用与土壤的性质、土壤微生物和植物的生理可塑性密切相关[4-7]。植物之间以及植物与土壤微生物群落之间的资源交换是生态系统功能、演替和干扰恢复的基础,是生态系统应对全球变化至关重要的驱动力。
土壤微生物群落演替在调节生态系统发展的各种变化中发挥着重要作用[8-10]。以往关于植物微生物与生态系统演替相互作用的研究多集中于土壤微生物群落如何受到早期演替物种的制约,以及同一或不同演替阶段的同种或异种植物对土壤微生物后续定殖过程的影响[11-13]。相关研究已经确定了植物微生物的正反馈和负反馈对驱动植物群落组成中的重要性[14-16],并发现植物间的相互作用主要表现在土壤细菌群落结构和氮素循环上[17]。然而,这类研究还需要明确植物之间的相互作用在不同区域、植被之间的差异,以及与氮素转移相关的节点是如何变化的。
植物的根系对于植物间、植物-土壤、植物-微生物的相互关系至关重要[18]。植物根系具有不同的功能模块[19],其中细根(1—2级根)的吸收功能较强,粗根(3—5级根)承担着营养运输的功能[20]。植物细根对环境变换敏感,温度、水分和氮素等都会影响细根的特征[21-22]。因此,在研究植物之间、植物与土壤微生物之间的相互关系时,有必要考虑根系不同功能模块在其中所发挥的作用。
豆科和非豆科之间的相互作用是研究植物相互作用的理想模式[23]。氮素在株间的转移是豆科和非豆科植物互作的显著特征,氮素的转移量是衡量两者之间互作强度的有效指标。豆科植物将大气中的14N以生物固氮的方式固定到生物体内。植物体内的15N/14N比值越低,表明该植物的固氮能力越强。这些氮素最终以植物凋落物或分泌物的形式在土壤中流动,通过微生物的作用,优先分解轻氮(14N),而将重氮(15N)留在土壤中[24]。而非豆科植物只能通过根系对土壤氮素的吸收来满足其生长发育需要,从而导致其体内的15N/14N比值偏高。因此,可以利用15N/14N比值来评判植物固氮能力的强弱[25-26]。δ15N以非固氮植物的15N/14N比值为标准,来计算豆科植物的固氮能力,δ15N值越小固氮能力越强,计算公式如下:δ(‰)=(Rsq/Rst-1)×1000,其中Rsq为样品的15N/14N比值,Rst为标准植物的15N/14N比值。
豆科植物疏叶骆驼刺(Alhagisparsifolia Shap.)和非豆科植物花花柴(Kareliniacaspia(Pall.)Less)是塔克拉玛干沙漠荒漠地区的主要建群种,在生态稳定和防治绿洲沙漠化中起到屏障作用,两者常相伴而生,广泛分布于沙漠-绿洲过渡带上。因此,揭示疏叶骆驼刺和花花柴互作机理对塔克拉玛干沙漠植被保护与恢复具有重要意义。为此,本研究在自然和小区(控制土壤水分)两种试验条件下,拟研究:(1)疏叶骆驼刺对氮素的固定和利用特性;(2)花花柴各器官的氮素利用特性;(3)疏叶骆驼刺和花花柴互作对不同根际土壤微生物的影响。
1 研究区域和方法
1.1 研究区域概况
研究区位于塔克拉玛干沙漠南缘的策勒绿洲外围(地理位置:80°03′24″—82°10′34″E,35°17′55″—39°30′00″ N),平均海拔1360 m,年均降雨量34 mm,主要是夏季降雨,年平均气温11.9℃,极端最高气温41.9℃,植被覆盖度低,以荒漠灌丛为主。实验小区已被利用20多年,间断种植过疏叶骆驼刺,红柳,盐生草等植物。在本实验开始前2年(2015—2016年)小区种植疏叶骆驼刺,2016年底清除。
1.2 实验设计
本实验依托策勒国家沙漠研究站,于2017年7月至2018年9月,设置9个4 m×4 m的试验小区,每个小区之间有1.5 m的间隔带,依次为疏叶骆驼刺单作、疏叶骆驼刺与花花柴互作、花花柴单作各3个小区。为了避免1年疏叶骆驼刺幼苗的生物量小和根系不发达对实验结果的影响,我们在疏叶骆驼刺种植1年后种植花花柴。2017年4月底播种(种子采集于距离实验区1 km的荒漠区)于育苗杯中,待长势稳定后,移栽到其中6个小区,行间距1 m×1 m。花花柴采用块根育苗,于2018年3月20日,挖掘荒漠区自然生长的花花柴的块根,切成5 cm的小块,分别栽培6个小区(其中一部分单独种植,另一部分与疏叶骆驼刺种在一起)。4月到9月间,统一管理,充分灌溉,及时清除杂草。
1.3 样品采集与指标测定
1.3.1植物
2018年9月,采集自然和小区内疏叶骆驼刺和花花柴的健康成熟叶片,低温烘干(60℃),粉碎后使用Mat253 同位素比率质谱仪(德国Finnigan公司)测定并计算出δ15N。在小区实验,移除花花柴的地上部分,将茎和叶分开收集,再分层挖掘采集疏叶骆驼刺和花花柴的根系,直到60 cm土深(自然疏叶骆驼刺和花花柴的根系在3 m以下,无法采集到)。从上到下对根进行编号,未分级的主根记为1号,每分一级,编号加1,最后将编号一样的混合到一起。所有植物样放入75℃的烘箱24 h,经球磨仪粉碎后,使用元素分析仪测定C、N含量。
1.3.2微生物
在采集根系之前(新鲜挖出来的10—30 cm处的根系),采用抖土法收集疏叶骆驼刺和花花柴根际土,立即放入放有冰袋的保温箱中,带回实验室无菌条件下过2 mm筛,零下20℃保存,用于16S rRNA扩增子测序。DNA提取步骤参照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒使用说明书(网址链接:http://omegabiotek.com/store/product/soil-dna-kit/)。使用Miseq 2×300bp测序平台测序(上海生物工程有限公司),细菌扩增区域为V3—V4,正向引物为341F, 序列为CCTACGGGNGGCWGCAG;反向引物为805R,序列为GACTACHVGGGTATCTAATCC;真菌扩增区域为NS1—fung,正向引物NS1,序列为GTAGTCATATGCTTGTCTC;反向引物为Fung,序列为ATTCCCCGTTACCCGTTG。将配对序列用FLASH(V1.2.3)进行合并,然后用QIIME[27]进行质量检测。去除嵌合sequences[28]后,其余序列使用UPARSE以97%的相似性分配给OTUs[29]。RDP分类器以80%的置信度为每个OTU的一个代表性序列标注分类信息[30]。并对细菌的功能在基于GenBank的功能基因数据库(http://fungene.cme.msu.edu/)下,采用PICRUSt功能分析,预测细菌功能。
1.3.3土壤
2018年9月采集自然和小区内的10—30 cm处土壤样品,混匀后分成3份,一份测定土壤含水量;风干后,一份过1 mm的筛后,测定土壤速效磷和全氮含量,剩余部分过2 mm的筛,用于测定土壤pH。采集小区内花花柴和疏叶骆驼刺根系附近2—5 cm的土壤。测定土壤的C、N、P的含量,以及pH和含水量(处理方法同上)。
1.4 数据处理分析
使用SAS 9.4软件对不同条件下的土壤性质,植物C、N及δ15N进行统计分析。采用OriginPro 8软件绘图。
2 结果与分析
2.1 氮素固定与利用
表1为不同条件下两种植物的δ15N值比较。从表中可以看出,单独生长的疏叶骆驼刺叶片的δ15N值均显著高于其与花花柴互作的情况。自然生境下与花花柴互作的骆驼刺叶片δ15N值相比单独的降低了37%,而在小区中只降低了10%。说明疏叶骆驼刺的固氮能力在互作条件下更强,且在自然生境中促进了疏叶骆驼刺的固氮能力。自然生境与小区生境相比骆驼刺叶片δ15N平均降低30%,互作和单独种植分别增加了42%和18%(图1)。
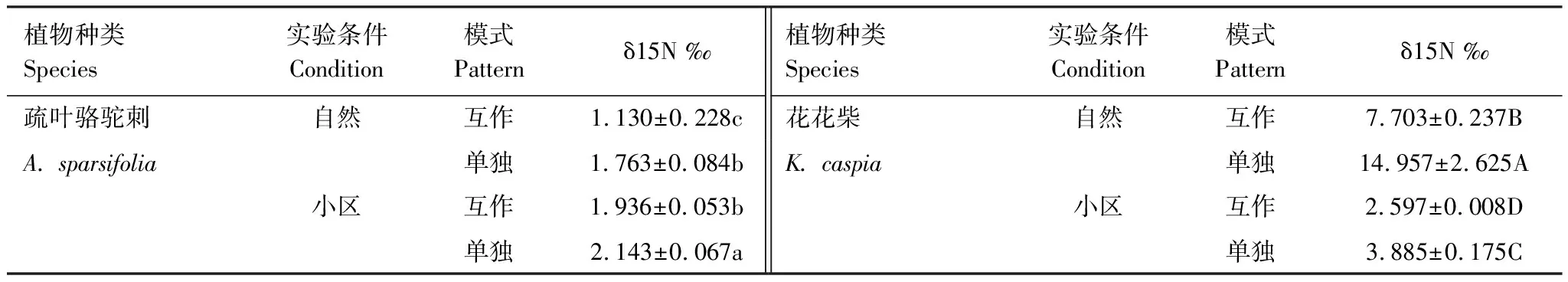
表1 不同条件下两种植物的δ15N值比较
花花柴与疏叶骆驼刺互作是其获取氮素的另一重要途径,自然条件下花花柴通过与疏叶骆驼刺互作获取氮素更多。无论是在自然或是小区生境下,单独存在的花花柴叶片δ15N值均显著高于互作的花花柴叶片δ15N值。在自然生境下花花柴叶片的δ15N值显著高于小区生境中的花花柴叶片的δ15N值。自然生境下互作花花柴叶片的δ15N值相比单独的降低了49%,而在小区中互作花花柴叶片的δ15N值只降低了33%。自然生境与小区生境相比δ15N平均降低了71%,互作和单独种植分别降低了66%和74%(图1)。以上结果说明花花柴和骆驼刺互作受环境因素和生物因素的共同调节,且环境因素对氮素转移的影响大于生物因素。
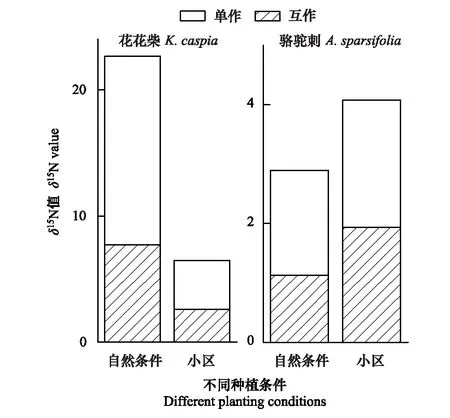
图1 两种植物叶片的 δ15N值变化
2.2 互作对营养元素分配的影响
疏叶骆驼刺和花花柴叶片δ15N值的分析结果表明,疏叶骆驼刺将固定下来的部分氮素转移给了花花柴,但是这部分氮素被花花柴吸收后对花花柴的影响还不清楚。
因此对比分析两种种植模式下花花柴不同器官的C、N营养元素(图2)。结果表明花花柴与疏叶骆驼刺互作显著改变了花花柴各个组织的氮素含量。花花柴各部分氮含量依次是根的氮含量<茎的氮含量<叶的氮含量。互作种植的花花柴叶片氮含量显著高于单独种植的;互作种植的花花柴茎的氮含量显著低于单独种植的,两种种植模式下的花花柴根系氮含量没有显著差异。互作花花柴叶片的碳含量显著高于单独的花花柴,但是根系碳含量显著低于单独花花柴根系碳含量。花花柴根:茎:叶的氮含量比值,由单种的1∶2.4∶6.6变为互作的1:2:7,互作花花柴的碳含量也向叶片有转移趋势。研究结果表明,从疏叶骆驼刺转移到花花柴的氮素影响了花花柴的元素分配,向叶片中运输的氮素增多。
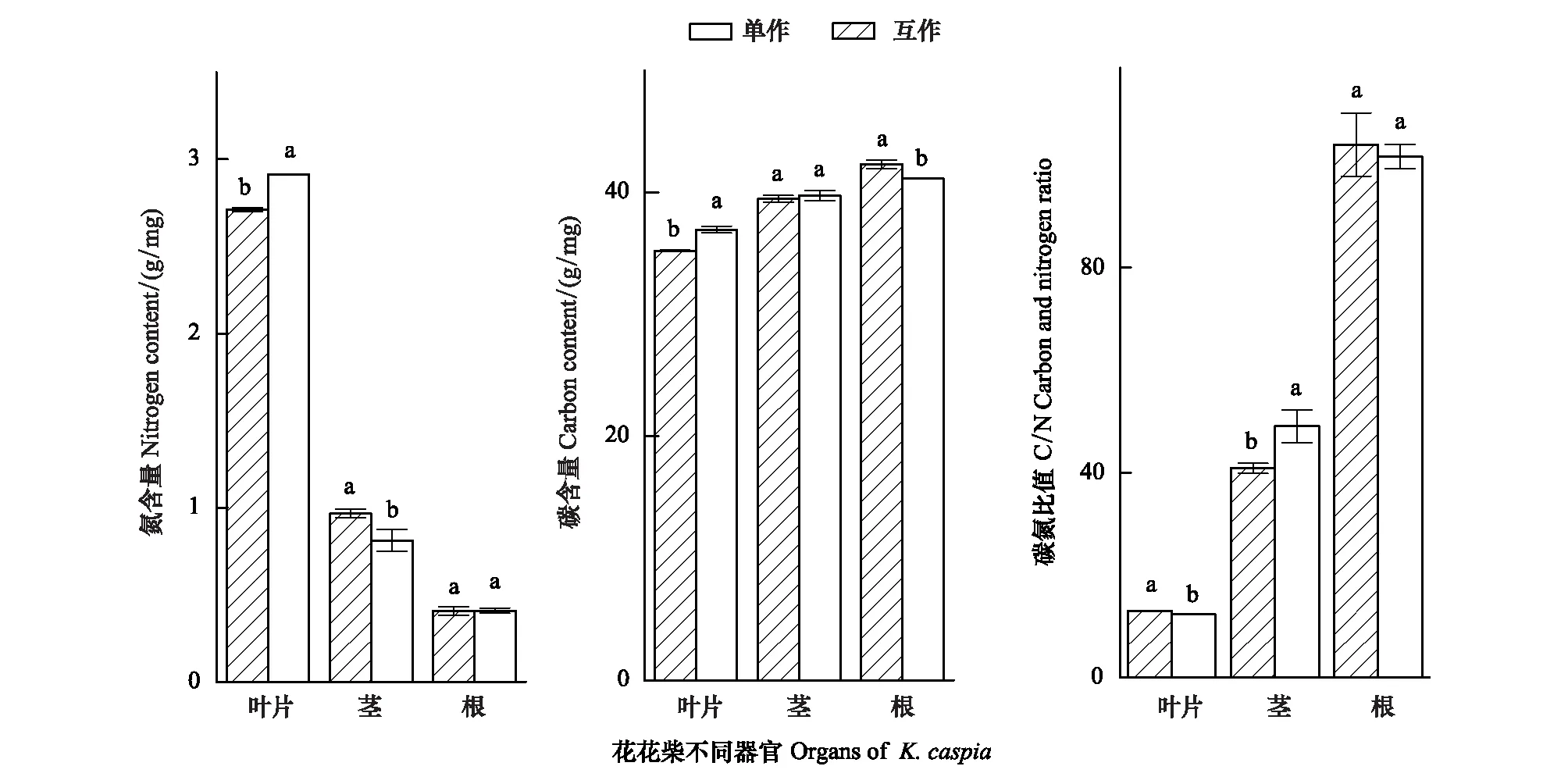
图2 不同种植模式下花花柴各组织的碳氮元素含量变化
互作降低了疏叶骆驼刺根系的氮含量,促进了碳元素向细根的运输(图3)。疏叶骆驼刺细根(1—2级根)的氮含量最高,显著高于3—5级根的氮含量。互作对疏叶骆驼刺不同级根氮含量都有影响,对4—5级根的氮含量影响最大,互作能够降低疏叶骆驼刺细根20%的氮含量,4—5级根30%以上的氮含量。疏叶骆驼刺单独种植的4—5级根的碳含量显著高于其他根系,互作增加了细根的碳含量,降低了4—5级根的碳含量。疏叶骆驼刺细根的C/N比值低于30,显著低于3—5级根的C/N比值。
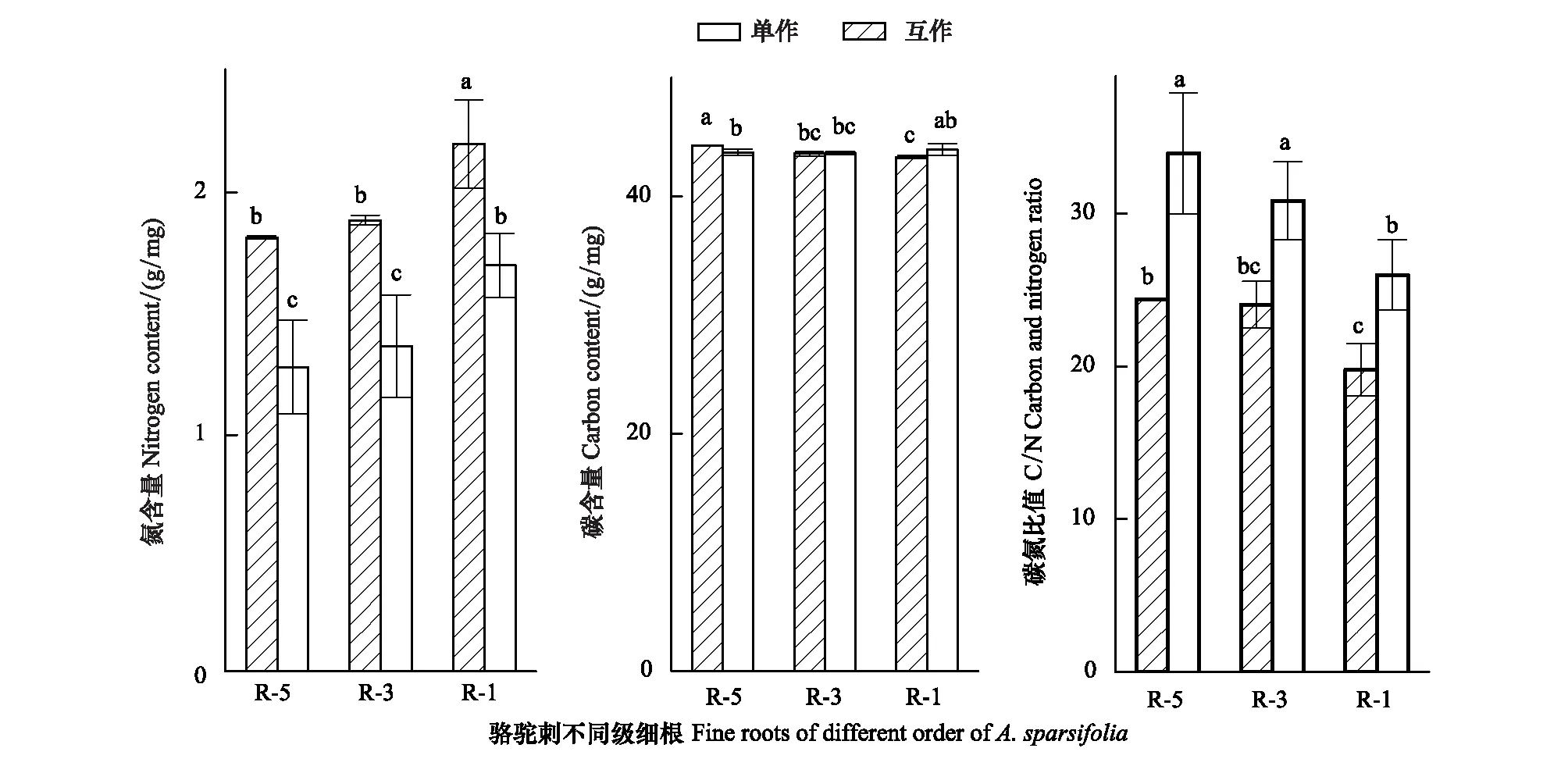
图3 不同种植模式下疏叶骆驼刺根系的碳氮元素含量变化
2.3 互作对根际细菌群落结构与功能特征的影响
疏叶骆驼刺根际细菌群落主要由变形菌门(Proteobacteria)61.44%、厚壁菌门(Firmicutes)9.86%、放线菌(Actinobacteria)13.64%、拟杆菌门(Bacteroidetes)4.01%、酸杆菌门(Acidobacteria)3.04%和芽单胞菌门(Gemmatimonadetes)1.5%组成。其中变形菌门以α,γ变形菌为主;花花柴根际细菌群落主要由变形菌门(Proteobac teria)71.88%、厚壁菌门(Firmicutes)8.59%、放线菌(Actinobacteria)10.95%、拟杆菌门(Bacteroidetes)2.52%、酸杆菌门(Acidobacteria)1.44%和芽单胞菌门(Gemmatimonadetes)0.62%组成。
2.3.1互作对疏叶骆驼刺和花花柴根际细菌多样性的影响
互作改变了疏叶骆驼刺根际细菌α多样性,但是对花花柴根际细菌α多样性无显著影响。Simpson指数是指示微生物群落的α多样性的,Simpson 指数值越大,说明群落多样性越低。疏叶骆驼刺与花花柴互作显著增加了Simpson指数(表2)。花花柴根际细菌多样性在单种和互作条件下没有显著差异,这可能与花花柴根系较为光滑,土壤不易附着且根毛极少等特性有关。
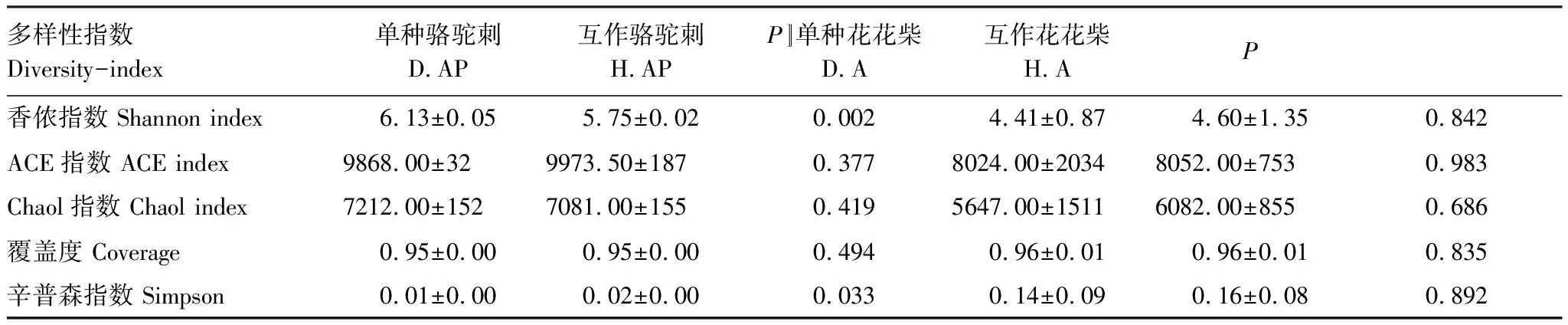
表2 不同处理下疏叶骆驼刺和花花柴根际细菌α多样性指数
互作改变了疏叶骆驼刺细根(1—2级)根际细菌的α多样性,对4—5级根没有显著影响。疏叶骆驼刺细根,3级根和4—5级根的根际土壤细菌群落多样性指数Shannon index逐渐减少,3级根的物种丰富度指数ACE index最高。疏叶骆驼刺与花花柴互作,整体上降低了疏叶骆驼刺不同根级的根际土壤微生物α多样性,但是没有改变多样性变化的规律。互作显著降低了细根根际细菌的Shannon index,增加了细根根际细菌的Simpson指数。综上所述,骆驼刺与花花柴互作改变了细根根际土壤细菌群落的α多样性指数,对粗根没有显著影响(图4)。
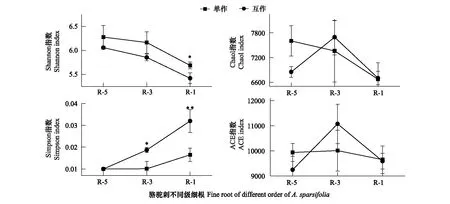
图4 疏叶骆驼刺根际土壤细菌的α多样性
疏叶骆驼刺根际细菌群落与环境因子的CCA分析结果表明(图5),互作改变了疏叶骆驼刺不同根际细菌群落组成。单独种植的疏叶骆驼刺细菌群落与土壤氮含量和C/N比值关系密切;而植物的C、N以及C/N比值与互作条件下的疏叶骆驼刺根际细菌群落关系密切。不同种植模式下疏叶骆驼刺细根,3级根和4—5级根的根际微生物的主导环境因子不同。互作条件下,1—3级根的根际微生物主要与根系的C/N比值关联较大,而在单独种植模式下,受土壤的有机碳含量和C/N比值的影响较大;粗根与土壤含水率,以及土壤和根系的氮含量相关性在单种种植时更大。
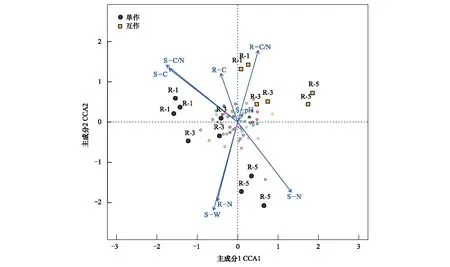
图5 不同种植模式下疏叶骆驼刺根际细菌群落的CCA分析
2.3.2互作对疏叶骆驼刺根际细菌群落基因功能的影响
采用COG基因功能注释法预测疏叶骆驼刺根际细菌的基因功能特性,结果表明互作显著改变了疏叶骆驼刺根际细菌的基因功能。互作与单种的基因功能的差异主要体现在与运输氮素物质相关的基因上,如氨基酸和碳水化合物转运与代谢的相关基因在互作条件下显著高于单独种植的疏叶骆驼刺;而单独种植的疏叶骆驼刺的核苷酸转运与代谢相关基因显著高于互作的(图6)。我们知道以游离氨基酸的形式转移氮素是植物体内转移氮素的重要途径,在转移氮素的同时,转运碳水化合物为氮素提供碳骨架。因此,可以看出与花花柴互作的疏叶骆驼刺根际微生物群落的结构和功能都发生了变化,向着更有利于运转氮素的微生物群落在演替。
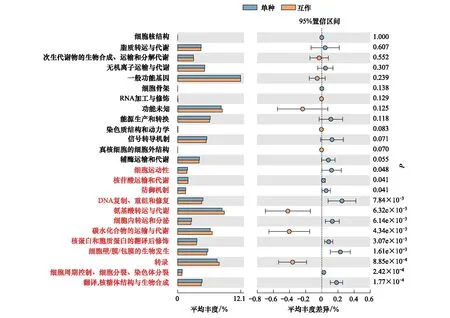
图6 不同种植模式下疏叶骆驼刺根际细菌群落的功能预测
疏叶骆驼刺不同根系的根际土壤细菌的基因功能不同(图7)。疏叶骆驼刺细根的氨基酸和碳水化合物转运与代谢的相关基因丰度显著高于4—5级根,核苷酸转运与代谢相关基因显著低于4—5级根。分析单独和互作条件下细根根际土壤细菌的基因功能,结果表明,互作条件下细根的氨基酸和碳水化合物转运与代谢的相关基因显著高于4—5级根。
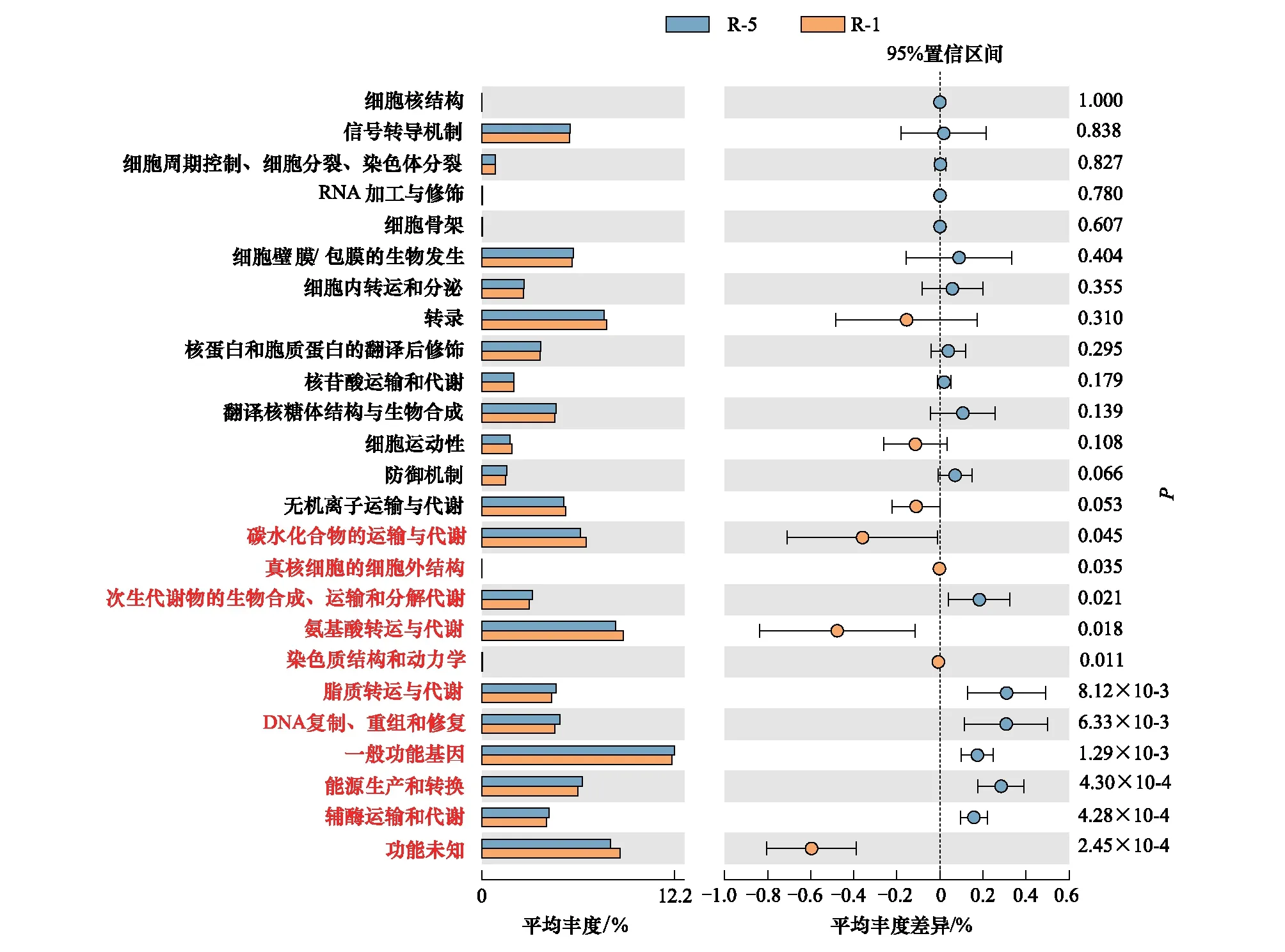
图7 疏叶骆驼刺不同根际土壤细菌基因功能
3 讨论
3.1 互作对豆科植物氮素固定和利用的影响
氮素的利用与分配直接影响着植物的生长[31]。大多数植物的生长都受到土壤氮素有效性的限制[32],在氮限制系统中,豆类植物通过减少对氮的竞争[33]或氮素转移来促进其他植物物种的生长。豆科植物可以利用生物固氮为植物提供氮素,非豆科植物通过与豆科植物互作也可获得氮素[34],从豆科植物转移到邻近植物的氮量可能占非豆科植物总氮的8%—39%[32]。本研究结果表明疏叶骆驼刺与花花柴在自然和小区两种生存环境下都有氮素转移特征,自然生境下疏叶骆驼刺和花花柴的互作关系更为紧密。疏叶骆驼刺和花花柴的δ15N值在不同生境下变化幅度更大。这是因为小区土壤含水率,速效磷和土壤氮含量要高于自然荒漠土壤,pH低于自然条件,小区的土壤环境更有利用植物生长(表3),非生物因子决定了植物互作关系的强弱[35-37],氮素及水分胁迫可能决定了疏叶骆驼刺和花花柴的互作。在互作条件下,花花柴各组织的氮含量更多的向叶片转移。观察花花柴的物候发现,与疏叶骆驼刺互作的花花柴的生长季要比单种的长,互作的花花柴更高的叶片氮含量可能与之相关[38-40]。

表3 土壤主要性质的差异
3.2 土壤微生物与植物互作
植物的相互作用通过相关微生物直接或间接的影响来实现[41]。研究表明豆科植物与禾本科植物互作能提高生物量、增加土壤微生物多样性和功能多样性[42-44],而紫云英(豆科)与油菜互作,降低了油菜根际土壤细菌多样性[45]。本研究发现疏叶骆驼刺与花花柴互作降低了疏叶骆驼刺根际细菌群落的Shannon index,但对骆驼刺根际真菌群落以及花花柴根际微生物群落没有显著影响(表2和表4)。可能原因是互作改变了疏叶骆驼刺氮素的获取方式,使疏叶骆驼刺从大气固氮,减少从土壤中吸收氮素的比例,形成了氮素“节约”型的氮素获取方式[46],改变了疏叶骆驼刺根际的微环境。由于花花柴根系与疏叶骆驼刺根系相距较远,且小区土壤水分状况良好,对花花柴根际微环境影响不大。植物互作关系,主要反映在细菌群落和氮素水平上[17]。豆科植物通过根系分泌物(氨基酸)将氮素转移到土壤之后,被非豆科植物吸收利用[35]。本研究发现互作改变了疏叶骆驼刺根际细菌中与氮素运转相关的基因,包括氨基酸和碳水化合物的转运与代谢基因。这可能说明在疏叶骆驼刺和花花柴相互作用下,土壤微生物作为一个智能媒介将氮素从疏叶骆驼刺转移到了花花柴中,并进一步被运输到叶片中。
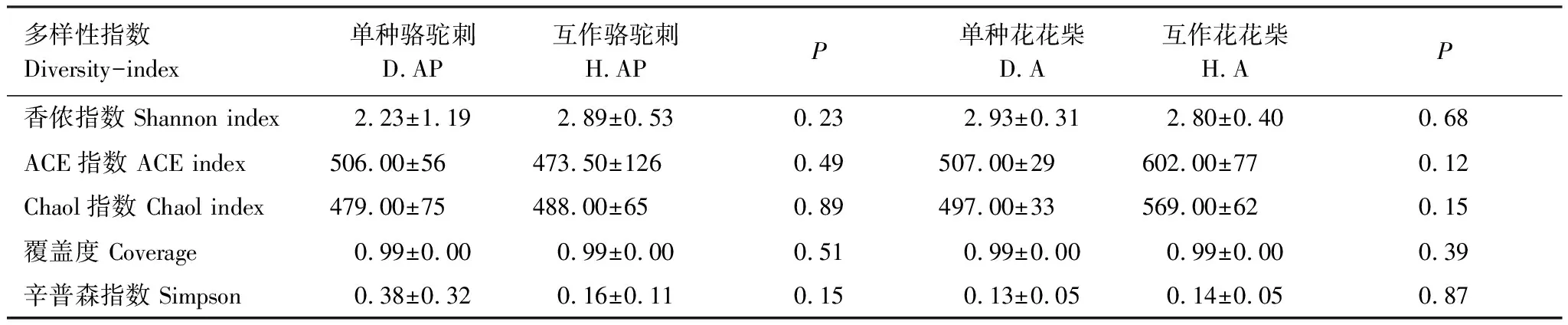
表4 骆驼刺和花花柴根际土壤真菌群落的α多样性
3.3 植物互作对细根的影响
植物根系有两种不同的功能模块,包括1—3级具有吸收功能的细根和三级以上的运输根[47-48],细根一般具有较高的氮素含量,较短的寿命,在资源利用方面具有可塑性[19,49]。疏叶骆驼刺细根的氮含量显著高于3级根和4—5级根,与花花柴互作显著降低了疏叶骆驼刺细根的氮含量,细根氮含量的减少幅度小于粗根的,保证了细根生命活动对氮素的需求。互作降低了疏叶骆驼刺根际土壤细菌的多样性,使骆驼刺细根根际微生物向着专一性的功能群落演替。基因功能预测发现,互作改变了疏叶骆驼刺细根根际土壤细菌的基因功能,细根中参与转运氮素的相关基因在互作条件下显著高于单独种植。因此,细根可能是疏叶骆驼刺和花花柴互作的关键部位。
4 结论
疏叶骆驼刺与花花柴在自然和小区两种生存环境下都有氮素转移特征,自然生境下疏叶骆驼刺和花花柴的互作关系更为明显。环境因素对骆驼刺固氮,骆驼刺和花花柴互作的影响更大。在自然生境中,从疏叶骆驼刺转移到花花柴的氮素占花花柴总氮50%左右。小区互作种植的疏叶骆驼刺固氮作用降低,转移到花花柴的氮素降低到30%左右,花花柴各组织的氮含量更多地向叶片转移。疏叶骆驼刺与花花柴互作降低了疏叶骆驼刺根际细菌群落的Shannon index,改变了疏叶骆驼刺细根根际土壤细菌的基因功能,细根中参与转运氮素的相关基因在互作条件下显著高于单独种植,但对花花柴根际微生物群落没有显著影响。互作降低了疏叶骆驼刺细根氮含量和细根根际土壤细菌多样性及其基因功能,疏叶骆驼刺细根可能是疏叶骆驼刺和花花柴互作的关键部位。综上所述,骆驼刺和花花柴互作增加了固氮量,有利用荒漠生态系统的稳定。

