大麦叶粉防治高尿酸血症及肾脏保护作用研究
吴 婷,赵泽安,陈演瑜,李咏梅,徐赫笛,高 尚,庞建新(南方医科大学药学院,广东广州 510515)
高尿酸血症与高血压、高血糖、高血脂共称为“四高”代谢性疾病,以人体血清尿酸水平异常升高为特征[1]。高尿酸血症与尿酸生成和(或)尿酸排泄减少有关[2-3],可引起痛风、高血压、心血管疾病及肾脏病变等[4]。
体内尿酸主要经肾脏排出,依赖于多种表达于肾小管上皮细胞的尿酸转运体的协同作用[5-6],包括尿酸转运体1(urate transporter 1,URAT1)、有机阴离子转运体1~4(organic anion transporter 1~4,OAT1~4)、有机阴离子转运体10(organic anion transporter 10,OAT10)、葡萄糖转运体9(glucose transporter 9,GLUT9)和腺苷三磷酸结合盒转运体G2(ATP binding cassette subfamily G member 2,ABCG2)等。其中,主要以尿酸为底物的转运体是URAT1和GLUT9,对肾脏尿酸排泄过程起重要调节作用[7-8]。肾小球滤过的尿酸90%由URAT1和GLUT9在近曲小管重吸收,10%由其它转运体在远端吸收和分泌,如OAT1与ABCG2。URAT1分布在肾小管上皮细胞顶质膜上,负责将肾小管腔内的尿酸转运至上皮细胞内,再由基质膜侧的GLUT9转运入血。
与多种多样可供选择的降压、降糖、降脂药物不同的是,目前临床使用的降尿酸药物种类极少,且主要以促尿酸从肾脏排泄,或抑制XOD活性的药物为主。国内最常用的促尿酸排泄药物为苯溴马隆,其通过抑制尿酸在肾小管的重吸收,促进尿酸从肾脏排泄从而发挥降尿酸作用。但因选择性低,毒副作用大,尤其是可引起爆发性肝炎[9],FDA一直没批准该药在美国上市,欧洲也曾经一度叫停[10]。另一临床常用的抑制XOD活性的降尿酸药物为别嘌呤醇(allopurinol,AP),其通过抑制尿酸生成发挥降尿酸作用。但长期服用别嘌呤醇会导致肝肾损害、过敏、骨髓抑制、胃肠道反应等[11-12],且服用该药的的患者只有不到40%可将血清尿酸浓度降低至目标水平,因此在一定程度上限制了其临床应用。饮食干预在防治多种慢性疾病(如癌症、糖尿病、高尿酸血症)中受到了越来越多的关注[13-15]。许多研究人员也试图从天然产物或食品中寻找防治高尿酸血症的方法[16]。
大麦(Hordeumvulgare),属大麦属(Hordeum)早熟禾科(Poaceae)一年生草本植物[17]。其嫩苗富含类黄酮、维生素、抗氧化酶及蛋白质等多种功能营养成分,在日本与中国被广泛用于制备大麦叶粉(BLP)作为一种健康饮品。国外研究表明,大麦具有抗糖尿病、抗炎、抗氧化、抗抑郁等作用,是防治人类慢性病最佳的功能性食品[18]。Hokazono等[19]的研究已表明,发酵的大麦提取物可降低高尿酸患者血清尿酸,但该研究并未阐明其作用机制,且未报道BLP对高尿酸诱发的肾脏损伤的保护作用。本文将系统评价大麦叶粉(Barley leaf powder,BLP)对氧嗪酸钾诱导的高尿酸血症小鼠体内尿酸水平的影响及其肾脏保护作用,为大麦叶粉在食品中的实际应用提供理论与实验依据。
1 材料与方法
1.1 材料与仪器
SPF级昆明种雄性小鼠(体重18±2 g) 购自南方医科大学实验动物中心,在(23±2) ℃,相对湿度50%~80%(每天12 h日光灯照射)条件下饲养,通过南方医科大学伦理委员会同意(批准号:No.44002100008061);BLP 郑州真好集团;别嘌呤醇(allopurinol,AP) 美国Sigma公司;尿酸(uric acid,UA)、肌酐(creatinine,CR)、尿素氮(blood urea nitrogen,BUN)测定试剂盒 美国BioAssay Systems;氧嗪酸钾(potassium oxazinate,PO)、黄嘌呤氧化酶(xanthine oxidase,XOD)测定试剂盒 南京建成生物工程研究所;RNA提取试剂盒 中国Foregene;逆转录试剂盒 日本Takara;引物合成 生工生物工程(上海)股份有限公司。
Mill-iQ型纯水系统 美国Millipore;Sigma 3K30高速低温离心机 德国Sigma;Infinite M200型酶标仪 瑞士TECAN;7500型实时荧光定量PCR仪 美国Applied Biosystems ABI。
1.2 实验方法
1.2.1 模型制备 小鼠高尿酸血症模型制备参考文献中的方法[20-22],并做适当改动。300 mg/kg氧嗪酸钾混悬液的配制:称取适量PO溶于0.5%羧甲基纤维素钠(sodium carboxyl methyl cellulose,CMC-Na)中,超声30 min使其充分混悬。连续腹腔注射14 d,正常组则腹腔注射等体积溶媒。
1.2.2 实验分组与给药 48只雄性昆明小鼠适应性喂养1周后随机分为正常对照组、模型组、别嘌呤醇组(阳性对照组,10 mg/kg)、BLP低中高三个剂量组(50、100、200 mg/kg),每组8只动物。Takano等[23]表明1500 mg/kg BLP对大鼠是安全的,因此,本文初步探索了150 mg/kg BLP的降尿酸效果,发现其降尿酸作用十分明显,因此后续在此基础上设置了上述三个剂量组。此外,BLP作为一种已上市产品,安全性高,其在人体中的推荐每日使用剂量约为43 mg/kg,换算成小鼠则为391 mg/kg,可见本实验采用剂量是安全的。造模前,给BLP各组小鼠分别灌胃不同剂量BLP(溶于0.9%生理盐水),持续7 d。第8 d开始,除正常组腹腔注射生理盐水外,其余组均腹腔注射PO溶液。除正常对照组外,其余各组动物在造模后1 h分别灌胃给以相应药物,造模与给药共持续14 d(整个实验共持续21 d)。第20 d给药后,将各组小鼠置于代谢笼中收集24 h尿液与粪便样品。第21 d末次给药后1 h,取血并处死小鼠,3000 r/min离心15 min分离血清。快速于冰上取肝脏与肾脏组织,分别保存于-80 ℃用于检测目的基因mRNA相对表达水平或用4%多聚甲醛固定。实验流程见图1。

图1 实验流程Fig.1 The experimental design of this study
1.2.3 指标分析 用试剂盒测定血清UA、CR、BUN水平、尿液UA、粪便UA水平、血清与肝脏中XOD活性。
1.2.4 肾脏与肝脏病理学观察 将1.2.2中固定于4%多聚甲醛溶液中的组织样品用石蜡包埋,制作病理切片,进行苏木精-伊红染色(hematoxylin-eosin staining,HE),用显微镜观察组织切片的变化情况。
1.2.5 实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR) 利用RNA提取试剂盒提取肾皮质中RNA,逆转录为cDNA后,进行PCR扩增,具体程序参考文献[16]。引物序列见下表1(引物序列参考网址https://pga.mgh.harvard.edu/primerbank/)。利用2-ΔΔCt法计算目的基因相对表达量(内参基因为β-Actin)。

表1 引物序列 Table 1 Primer sequences
1.3 数据处理
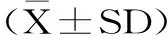
2 结果与分析
2.1 BLP对高尿酸血症小鼠血清、尿液、粪便UA、血清CR与BUN水平的影响
由表2可知,同空白组比较,造模14 d后模型组小鼠血清UA高度显著增加(P<0.001),表明高尿酸血症模型造模成功;与模型组相比,BLP各剂量组均能高度显著降低其血清UA水平(P<0.001)。模型组的24 h尿液UA极显著低于空白组(P<0.01),粪便UA水平显著低于空白组(P<0.05),而200 mg/kg BLP分别高度显著增加尿液UA(P<0.001),极显著增加肠道排泄量(P<0.01)。体内次黄嘌呤和黄嘌呤在XOD的催化下生成UA,阳性药AP为XOD抑制剂,可通过抑制XOD活性而减少体内UA的生成[24]。表2结果显示,与模型组相比,AP对UA排泄的影响不显著(P>0.05)。
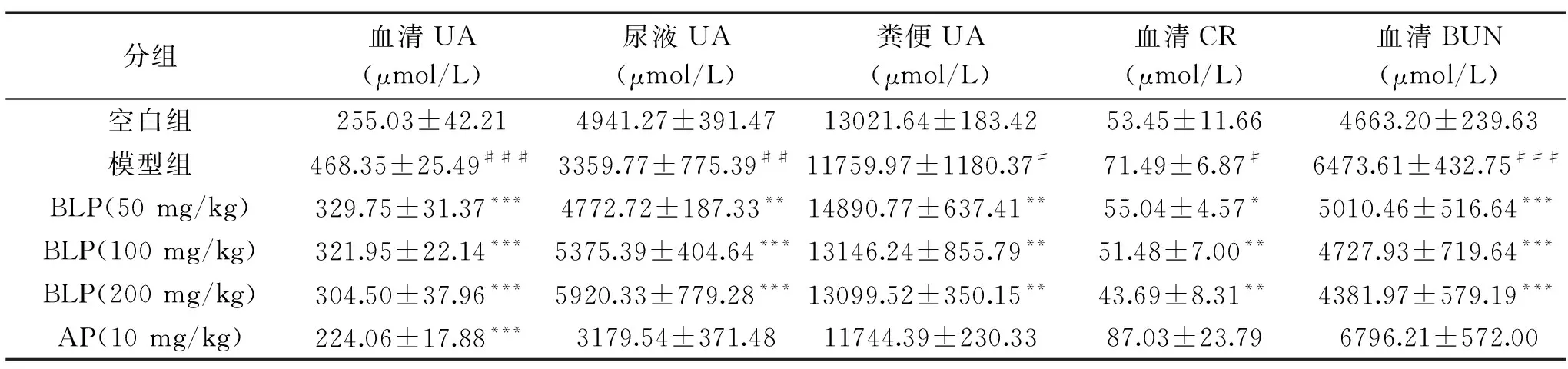
表2 BLP对高尿酸血症小鼠血清、尿液、粪便UA、血清CR与BUN水平的影响Table 2 Effects of BLP on serum,urinary,fecal UA,serum CR and BUN levels in PO-induced hyperuricemic mice
血清CR与BUN是临床评估肾脏损伤的常用指标。肾脏受损会伴随两者水平升高[25]。如表2所示,同空白组相比,造模14 d后模型组血清CR水平显著升高(P<0.05),BUN水平高度显著升高(P<0.001),表明持续的高尿酸可一定程度引起肾脏损伤。阳性对照组AP并未使CR与BUN降低,反而一定程度升高两者水平,提示AP长期用药可能对肾脏产生损伤,与文献报道相符[26-27]。相反,BLP给药3周能极显著降低血清CR水平(P<0.01),高度显著降低BUN水平(P<0.001),表明BLP在保护肾功能方面具有一定作用。
2.2 BLP对高尿酸血症小鼠血清与肝脏XOD活性、肝脏UA的影响
XOD主要位于肝脏,是一种催化次黄嘌呤生成尿酸的关键酶。该酶主要存在于哺乳动物的肝脏中,正常人血清中不能检出或含量甚微。当肝脏内尿酸水平明显增高时,XOD释放入血清[28],因此,本文通过同时检测血清与肝脏XOD活性,并结合肝脏UA水平评价BLP对尿酸生成的影响,旨在阐明其降尿酸的机制之一。由表3可知,BLP各剂量组与阳性药AP能高度显著降低高尿酸血症小鼠血清与肝脏XOD活性(P<0.001),200 mg/kg BLP同时高度显著减少肝脏UA的生成(P<0.001)。

表3 BLP对高尿酸血症小鼠血清与肝脏XOD活性、肝脏UA水平的影响Table 3 Effects of BLP on serum and hepatic XOD activities,hepatic UA levels in PO-induced hyperuricemic mice
2.3 BLP对高尿酸血症小鼠肾脏组织病理学的影响
图2显示,模型组肾脏炎症浸润明显,而BLP能明显改善上述症状,200 mg/kg剂量组最为明显。与表2中血清CR和BUN水平结果一致,AP组并不能降低高尿酸导致的肾脏损伤,反而升高血清CR与BUN水平,加重肾脏损伤。如图2F所示,AP显著加剧肾小管扩张。
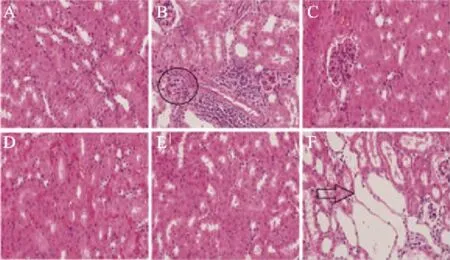
图2 BLP对氧嗪酸钾诱导的高尿酸血症小鼠肾脏的影响(×400)Fig.2 Effects of BLP on the pathological changes of kidney in hyperuricemia mice induced by PO(×400).注:A:空白组;B:模型组;C:BLP 50 mg/kg;D:BLP 100 mg/kg;E:BLP 200 mg/kg;F:AP 10 mg/kg;○表示炎性浸润;表示肾小管扩张。
2.4 BLP对高尿酸血症小鼠肾脏尿酸转运体mRNA表达水平的影响
由图3可见,模型组小鼠肾皮质URAT1与GLUT9 mRNA水平高度显著增加(P<0.001),OAT1与ABCG2表达高度显著减少(P<0.001)。200 mg/kg BLP能高度显著下调URAT1与GLUT9的mRNA表达水平(P<0.001),高度显著上调OAT1 mRNA表达水平(P<0.001),对ABCG2的表达无显著影响(P>0.05),提示其可能通过抑制URAT1与GLUT9从而减少UA的重吸收,同时上调OAT1功能从而增加尿液UA排出量,继而使血清UA水平明显降低。

图3 BLP对高尿酸血症小鼠肾皮质URAT1、GLUT9、OAT1与ABCG2 mRNA表达水平的影响(n=4)Fig.3 Effects of BLP on the mRNA expressions of URAT1,GLUT9,OAT1 and ABCG2 in the kidney cortex tissues(n=4)注:###P<0.001表示与空白组相比;*P<0.05,**P<0.01,***P<0.001表示与模型组相比;n.s.表示与模型组相比,无统计学差异。
3 讨论与结论
HUA是体内嘌呤类物质代谢紊乱所导致的疾病,越来越多研究者从天然食品中发现可用于防治HUA的潜在药物,如柠檬水[16]、姜黄素[20]等。本研究发现了纯天然健康食品BLP的体内降尿酸活性,可通过抑制XOD活性降低UA的产生,通过下调肾脏URAT1和GLUT9的表达,增加UA的肾脏排泄,从而显著降低血清UA。
人体内UA主要经肾脏排泄(2/3),同时可经肠道排泄(1/3)。肾脏中的多种尿酸转运体共同调控着体内尿酸稳态。其中位于肾近端小管细胞顶端和基底外侧膜上的URAT1和GLUT9是将UA从肾小管腔重吸收到血液的重要转运蛋白,而OAT1和ABCG2则是分别位于基底外侧膜和顶端,负责将尿酸从血液中转运到肾小管腔中,促进尿酸的分泌[7-8]。从图3可以看出,BLP显著降低了URAT1和GLUT9 mRNA的表达水平,抑制了UA的重吸收,上调OAT1 mRNA表达水平,最终促进多余的UA随尿液排出体外。
本文除发现BLP可促进尿酸排泄外,还发现BLP可极显著促进肠道排泄尿酸,但并未呈现出剂量依赖性。BLP的降尿酸作用还可能与其影响HUA小鼠的肠道菌群有关,因其含有丰富的膳食纤维[18],而膳食纤维在体内能够调节肠道细菌组成[29]。近几年的研究发现,HUA或痛风与肠道菌群失调密切相关[30]。肠道内菌群中存在一些能够分解尿酸的细菌,可将尿酸进一步分解为易于排出体外的尿囊素[31]。本文所研究的BLP可能同时影响了某些菌群的组成,改变了某些分解尿酸的细菌的丰度,使得更多尿酸经细菌分解而直接以尿囊素的形式排出体外,因此本文未能在肠道尿酸中检测到BLP的剂量效应。此外,BLP还可能影响了肠道菌群代谢产物的含量,通过这类代谢产物发挥其降尿酸作用,如短链脂肪酸。目前本课题组正开展相关的工作,以期进一步阐明BLP的降尿酸机制。
持续的高尿酸将损伤肾脏。本研究发现BLP在发挥降尿酸的作用时能逆转高尿酸导致的血清CR与BUN水平升高,而别嘌呤醇并无此作用,表明BLP具有一定的肾脏保护作用。
综上,本研究发现BLP可通过抑制体内XOD活性减少体内UA生成,同时下调URAT1、GLUT9,上调OAT1的表达从而促进UA的排泄,最终表现出显著的降尿酸与肾脏保护作用。本实验可为开发BLP成为降尿酸功能性食品提供实验基础。

