高良姜素对肝癌细胞HepG2的凋亡效应
刘 政,王 会(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
肝癌是发生在肝细胞或胆管细胞的恶性肿瘤,具有治愈难、预后差等特征,其治疗是临床亟待解决的问题。寻找安全有效、靶点明确、低毒的天然抗肿瘤药物是科学界研究的焦点,从中草药中筛选有效的活性物质治疗肝癌是中药发展的重要渠道。
高良姜素是天然的黄酮醇类化合物(3,5,7-三羟基黄酮,图1),可从植物高良姜植株的地上部分[1]及根茎[2-3]和蜂胶[4]中提取得到。研究发现,高良姜素具有镇痛、止呕、抗氧化作用[5]及抗肿瘤作用[6-7]。高良姜素可抑制皮肤癌[8]、人骨瘤MG-63[9]、肝癌BEL-7402[10]肿瘤细胞的增殖和转移,能够诱导肺癌A549细胞的凋亡[11]。本实验检测高良姜素对肝癌细胞HepG-2的细胞毒性,应用形态学分析、凋亡率检测进行凋亡作用测定,并初步探讨高良姜素对细胞周期、线粒体膜电位及胞内钙离子稳态的影响。本文研究高良姜素对肝癌细胞HepG-2增殖及凋亡作用,为高良姜的开发利用提供实验依据。
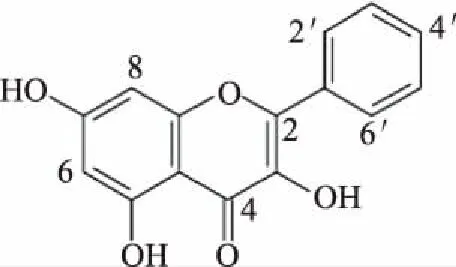
图1 高良姜素的结构式Fig.1 The structural formula of galangin
1 材料与方法
1.1 材料与仪器
高良姜素(纯度≥98.0%)、喜树碱(纯度≥98.0%) 成都曼斯特生物科技有限公司;人肝癌HepG-2 细胞 中国农业科学院北京畜牧兽医研究所遗传资源实验室提供;胎牛血清、DMEM高糖培养基 美国GIBCO公司;碘化丙啶(propidium iodide,PI) 美国Sigma公司;Annexin V-FITC Apoptosis Detection试剂盒、JC-1探针 美国BD公司;Fluo-3/AM 美国Invitrogen公司。
BB15 CO2培养箱 德国Heraeus公司;IX-71倒置相差显微镜 日本Olympus公司;Multiskan FC酶标仪 美国Thermo Fisher公司;FC-500流式细胞仪 美国Beckman公司。
1.2 实验方法
1.2.1 细胞培养 HepG-2 细胞培养于含10% 胎牛血清的 DMEM 高糖培养基中,培养环境为37 ℃、5% CO2、饱和湿度。当细胞达到70%~80%融合度时用0.25%胰酶消化细胞并传代,取对数生长期细胞进行实验。
1.2.2 药物配制 高良姜素和喜树碱先用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解,然后再溶于培养基(DMSO终浓度小于0.05%)。配制培养基分别含有高良姜素浓度为2.7、5.4、10.8和21.6 μg/mL;含有喜树碱浓度为6.96、13.92和27.84 μg/mL,备用。
1.2.3 细胞毒性分析 取180 μL细胞悬液接种于96孔培养板,细胞进入对数生长期时分别换用含有2.7、5.4、10.8和21.6 μg/mL高良姜素的培养基培养,设置空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.05%)和阳性对照组(以喜树碱为阳性对照,6.96、13.92和27.84 μg/mL)[12-13],每组设5个重复,作用时间分别为12、24、36、48 h,然后每孔加入3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)20 μL(5 mg/mL),继续培养4 h,弃培养基。每孔加入200 μL DMSO,充分振荡,酶标仪于490 nm波长处检测吸光度OD值。
1.2.4 细胞形态学分析 细胞接种于六孔板(3.0×105cell/孔),待24 h后细胞进入对数生长期[14],分别用2.7、5.4、10.8和21.6 μg/mL高良姜素处理细胞24 h,并设空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.5%)和阳性对照组(以喜树碱为阳性对照,27.84 μg/mL)。应用倒置相差显微镜观察并拍照。
1.2.5 Annexin V-FITC/PI双染检测细胞凋亡率 细胞接种24 h进入对数生长期,收集经2.7、5.4、10.8和21.6 μg/mL高良姜素和27.84 μg/mL喜树碱(阳性对照)处理12、24、36、48 h的各组细胞及空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.5%)细胞,调整细胞浓度为5.0×105cell/样品,每个样品分别加入100 μL缓冲液和5 μL AnnexinV-FITC及5 μL PI。混匀,避光孵育10 min,流式细胞仪检测。
1.2.6 细胞周期检测 细胞接种24 h进入对数生长期,经高良姜素处理24 h,收集经2.7、5.4、10.8和21.6 μg/mL高良姜素处理的细胞和空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.05%)细胞,调整细胞浓度为5.0×105cell/样品,细胞于70%无水乙醇,4 ℃处理12 h。PBS洗涤2次,加入0.5 mL PI染液,4 ℃ 避光孵育15 min,流式细胞仪检测。
1.2.7 线粒体膜电位检测 细胞接种24 h进入对数生长期,经高良姜素处理24 h,收集经2.7、5.4、10.8和21.6 μg/mL高良姜素处理的各组细胞和空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.5%)细胞,调整细胞浓度为1.0×106cell/样品,加入0.5 mL JC-1染色液,于培养箱避光孵育20 min,用37 ℃预热的磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤,0.5 mL PBS 悬浮,流式细胞仪检测。
1.2.8 细胞内钙离子浓度的测定 细胞接种24 h进入对数生长期,收集经2.7、5.4、10.8和21.6 μg/mL高良姜素处理24 h的各组细胞和空白对照组(用含DMSO的培养基处理,DMSO终浓度为0.5%)细胞,调整细胞浓度为1.0×106cell/mL。加入Fluo-3/Am(终浓度为8 μmol/L),于培养箱避光孵育30 min,期间振荡4次,设置阴性对照(不加Fluo-3/Am)。用无钙离子PBS漂洗2次,PBS重悬至0.5 mL,流式细胞仪检测。
1.3 数据处理
2 结果与分析
2.1 细胞毒性分析
MTT法细胞毒性分析是检测细胞存活和增殖活性的最常规、最经典的方法。不同浓度高良姜素分别作用HepG-2细胞12、24、36、48 h,OD490值反映的是活细胞数量,OD490值减小,显示活细胞数量减少。高良姜素处理细胞12 h时,21.6 μg/mL高良姜素处理组OD490值与空白对照组比较减小,差异显著(P<0.05)。其中,5.4 μg/mL浓度组OD490值大于2.7 μg/mL浓度组OD490值,但两组相比较差异不显著,推测出现这种现象的原因可能是两个浓度的高良姜素作用细胞12 h未对细胞产生差异的毒性作用。高良姜素处理细胞24 h时,10.8 μg/mL高良姜素处理组OD490值与空白对照组比较减小,差异显著(P<0.05);21.6 μg/mL高良姜素处理组OD490值与空白对照组比较减小,差异极显著(P<0.01)。高良姜素处理细胞36 h时,5.4、10.8、21.6 μg/mL高良姜素处理组OD490值分别与空白对照组比较均减小,差异极显著(P<0.01)。高良姜素处理细胞48 h时,5.4、10.8、21.6 μg/mL高良姜素处理组OD490值分别与空白对照组比较均减小,差异极显著(P<0.01)(表1)。在同一作用时间,随着高良姜素浓度的增大其OD490值逐渐减小,显示活细胞数量减少,呈现量效关系。阳性对照喜树碱处理的各组细胞OD490值随其浓度增大也减小,高良姜素处理组与阳性对照组比较,表现出良好的细胞毒性作用,该实验结果与高良姜素对人肝癌SMMC-7721细胞增殖的作用结果一致[12],为后续的凋亡作用研究提供基础。

表1 高良姜素对HepG-2细胞生长的影响(n=3)Table 1 Effect of galangin on growth of HepG-2(n=3)
2.2 细胞形态学观察
对照组细胞饱满、立体感好,排列紧密,边缘清晰,细胞折光度好。高良姜素处理24 h后,2.7 μg/mL处理组细胞未出现明显变化;5.4 μg/mL处理组细胞出现空泡,胞体缩小;10.8 μg/mL处理组细胞形态变得模糊不清,空泡及细胞碎片增多;21.6 μg/mL处理组细胞间连接几乎消失,胞体缩小,细胞膜皱缩,细胞膜表面凹凸不平,细胞裂解成较小的碎片,出现细胞坏死。喜树碱27.84 μg/mL处理组细胞凋亡现象和高良姜素21.6 μg/mL处理组相似(图2)。随着高良姜素处理浓度的增大细胞发生凋亡作用的形态表现愈加严重。

图2 高良姜素处理HepG-2细胞24 h细胞形态(40×)Fig.2 Cell morphology of HepG-2 treated with galangin at 24 h(40×)
2.3 细胞凋亡率的测定
双标记法能够定量分析细胞凋亡,并可定量分析凋亡细胞和坏死细胞。检测结果显示,高良姜素处理细胞12 h时,10.8 μg/mL高良姜素处理组凋亡率与空白对照组比较增高,差异显著(P<0.05),21.6 μg/mL高良姜素处理组凋亡率与空白对照组比较增高,差异极显著(P<0.01)。高良姜素处理细胞24 h时,5.4、10.8、21.6 μg/mL高良姜素处理组凋亡率分别与空白对照组比较增高,差异极显著(P<0.01)。高良姜素处理细胞36 h时,5.4、10.8、21.6 μg/mL高良姜素处理组凋亡率分别与空白对照组比较增高,差异极显著(P<0.01)。高良姜素处理细胞48 h时,5.4、10.8、21.6 μg/mL高良姜素处理组凋亡率分别与空白对照组比较增高,差异极显著(P<0.01)。随着高良姜素作用浓度的增大,凋亡率逐渐增大,且呈现浓度依赖性。各处理时间的阳性对照喜树碱27.84 μg/mL处理组凋亡率高于高良姜素21.6 μg/mL处理组(表2)。

表2 高良姜素处理HepG-2细胞凋亡率(%)(n=3)Table 2 The apoptosis rate of HepG-2 treated with galangin(%)(n=3)
2.4 细胞周期检测
细胞周期是个连续的动态过程,如某环节受到干扰,必将影响细胞增殖进而影响整个生命活动。细胞周期的不同时相必须高度精确有条不紊的进行,细胞必须在完成上一次时相后才能进入下一个时相。将细胞周期的理论应用于药物研究,其作用机制为时相特异性,将细胞阻止在特定的时相。高良姜素诱导肝癌BEL-7402细胞凋亡的研究结果表明,高良姜素阻断细胞于G1期,且呈现剂量依赖性[15]。本文检测结果显示,高良姜素处理细胞24 h时,5.4 μg/mL高良姜素处理组,处于G1期细胞的数量增多,与空白对照组比较差异显著(P<0.05);10.8、21.6 μg/mL高良姜素处理组,处于G1期细胞的数量增多,与空白对照组比较差异极显著(P<0.01);10.8、21.6 μg/mL高良姜素处组,处于S期细胞的数量增多,与空白对照组比较差异极显著(P<0.01);21.6 μg/mL高良姜素处理组,处于G2期细胞的数量减少,与空白对照组比较差异显著(P<0.05)。随着高良姜素浓度的增大,处在G1期细胞数增多,S期细胞数下降,G2期细胞数下降,表明细胞经高良姜素处理后增殖停滞在G1期,DNA合成受阻,这种关系随着高良姜素剂量的增大而愈加明显,呈现剂量依赖性(表3)。

表3 高良姜素处理HepG-2细胞24 h,细胞周期的变化(n=3)Table 3 Changes in the cell cycle of HepG-2 treated with galangin for 24 h(n=3)
2.5 线粒体膜电位检测
随着对细胞凋亡机制不断研究,细胞器线粒体得到了前所未有的关注。线粒体在细胞凋亡的过程中起着调控器的作用。线粒体跨膜电位的下降被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转。研究显示,高良姜素诱导肝癌BEL-7402细胞线粒体膜电位下降[15]。本文检测结果显示,高良姜素处理细胞24 h时,5.4、10.8、21.6 μg/mL高良姜素处理组线粒体膜电位下降,与空白对照比较差异极显著(P<0.01)(表4)。随着高良姜素处理浓度的增大线粒体膜电位越低,呈现剂量依赖性,表明细胞发生凋亡作用程度越严重。

表4 高良姜素处理HepG-2细胞24 h,线粒体膜电位变化(n=3)Table 4 Mitochondrial membrane potential changes of HepG-2 treated with galangin for 24 h(n=3)
2.6 细胞内游离钙离子测定
钙离子作为第二信使在细胞乃至整个有机体生命活动中起着重要的调控作用。细胞内钙离子浓度的变化直接影响细胞的增殖、分化及凋亡等生命现象,因此,钙作为第二信使在细胞凋亡中的作用一直是细胞生物学研究的重点。细胞质内游离钙离子的增多和内质网内钙离子的排空均可激活凋亡启动因子。目前认为钙离子信号可能是通过细胞或线粒体钙超载和钙依赖酶激活这两种方式来控制凋亡的。检测结果显示,高良姜素作用细胞24 h时,5.4 μg/mL高良姜素处理组细胞内游离钙离子浓度增高,与空白对照比较差异显著(P<0.05);10.8、21.6 μg/mL高良姜素处理组细胞内游离钙离子浓度增高,与空白对照比较差异极显著(P<0.01)(表5)。随高良姜素浓度增大,细胞内游离钙离子浓度逐渐增高,呈现剂量依赖性,表明细胞发生凋亡作用程度越严重。

表5 高良姜素处理HepG-2细胞24 h,胞内Ca2+浓度的变化(n=3)Table 5 Intracellular Ca2+ concentration changes of HepG-2 treated with galangin for 24 h(n=3)
3 讨论与结论
肿瘤的发生、发展是复杂的基因调控失调所致,是细胞增殖和凋亡平衡被打乱的结果。随着人们对凋亡机理的研究,发现促进肿瘤细胞凋亡是治疗肿瘤的有效途径之一。
细胞毒性结果表明,高良姜素可以抑制人肝癌HepG-2细胞生长,并呈现时间-效应和剂量-效应依赖关系,这与先前的研究结果相似,高良姜素可体外抑制多种癌细胞增殖,如乳腺癌[16]、肺癌[17]、口腔癌[18]和白血病细胞[19]。细胞形态学分析及凋亡率检测结果和细胞毒性结果一致。
肿瘤是一种细胞周期失控性疾病,细胞无限增殖,导致细胞恶性转化,最终形成肿瘤[20],对细胞周期进行检测是研究细胞凋亡的重要指标之一,通过干扰细胞周期进程来诱导凋亡也作为抗肿瘤研究的一个新思路[21]。检测高良姜素对HepG-2细胞周期的影响,发现细胞发生G1期阻滞,导致进入G2期细胞数量减少,造成进入M期的细胞数量减少,细胞分裂受阻,细胞发生凋亡。本实验结果与先前研究结果存在差异,有报道显示,高良姜素导致肝癌HepG-2[22]、肺癌A549细胞[23]和胃癌SGC-7901细胞[24]发生G2/M期细胞周期停滞,从而抑制其增殖。推测高良姜素通过干扰细胞周期时相的分布从而促进细胞凋亡,这为以后开展高良姜素诱导肝癌细胞凋亡机理的研究提供了重要实验依据。
线粒体与细胞凋亡过程中许多重要事件相关,并在其中发挥着重要的调控作用[25],线粒体膜电位下降,膜通透性转运孔开放,线粒体内的细胞色素C、凋亡诱导因子外流进入细胞质,从而激活Caspase凋亡途径启动凋亡程序[26]。研究表明,高良姜素可使人肝癌细胞线粒体膜电位降低,从而促进细胞色素C释放到细胞质中,诱导细胞凋亡[27-28]。本实验采用JC-1探针标记应用流式细胞仪检测线粒体膜电位变化,发现经高良姜素处理后的HepG-2细胞线粒体膜电位降低,并呈现剂量-效应依赖关系。推测高良姜素诱导HepG-2细胞凋亡与细胞凋亡线粒体途径有关。
在正常生理状态下,细胞中Ca2+主要与蛋白质结合形成结合态封存在线粒体和内质网中,游离的Ca2+很少,当收到外界刺激时结合态变为游离态充当信号分子。游离Ca2+在细胞内的过度累积可以致使细胞凋亡的发生[29-30]。当高良姜素处理HepG-2细胞时,细胞质内游离Ca2+浓度升高且呈现剂量-效应依赖关系,Ca2+稳态被打破,适当浓度的高良姜素可诱导HepG-2细胞发生凋亡。结合线粒体膜电位下降的结果,推测与线粒体内钙离子的释放有关,但其具体机理还需进一步的研究。
综上所述,高良姜素可阻滞细胞增殖、诱导细胞凋亡,其机制可能是通过干扰细胞周期进程及钙离子稳态和降低线粒体膜电位来诱导细胞凋亡的。

