红橘响应褐斑病菌侵染的转录组学分析
唐科志,周常勇
(西南大学柑桔研究所,重庆 400712)
0 引言
【研究意义】由链格孢菌橘致病型(Alternaria alternatatangerine pathotype)引起的柑橘褐斑病(Alternaria brown spot,ABS)可危害柑橘的嫩梢、嫩叶及果实,常对部分宽皮柑橘生产带来严重问题[1-3]。澳大利亚于1903年首次报道该病害[4],随后在美国、哥伦比亚、土耳其、以色列等柑橘产地相继发现。2010年,在我国云南的栽培品种上首次鉴定到柑橘褐斑病菌[5],此后,在国内其他柑橘产区也陆续暴发该病[6-8]。近年来,柑橘褐斑病在敏感品种红橘(Citrus reticulataBlanco, cv. Hongjv)上的暴发已造成局部地区橘类产业巨大的经济损失。国内外对柑橘褐斑病菌部分功能基因研究已取得一定进展[9-12],但其流行规律、致病机理以及寄主应答机制仍不清楚,有待进一步深入研究。【前人研究进展】WANG等[13-14]对链格孢菌橘致病型菌株 Z7进行了全基因组测序分析,证明柑橘褐斑病菌功能基因主要为ACT毒素合成基因、信号转导基因、次级代谢相关基因、ROS解毒相关基因等,并通过转录组测序研究了主要转录因子对菌株产孢及致病性的调控;WU等[15]通过对霜霉病菌(Plasmopara viticola)侵染葡萄前后的叶片样品进行RNA-seq测序,共获得15 249个候选的差异表达基因;XU等[16]通过RNA-seq研究了棉花受黄萎病菌(Verticillium dahlia)侵染后的转录组变化,共鉴定到3 442个与防御相关的基因,其中木质素合成相关基因的表达在抗病品系中表达显著上调,推测木质素可能在棉花抗病中发挥重要作用;WARD等[17]借助 RNA-seq技术研究了覆盆子根腐病抗病及感病品系受到病原菌Phytophthora rubi侵染后的基因表达差异,结果显示WRKY转录因子、三羧酸循环、木质素合成及编码病程相关蛋白的基因等均表现为转录表达上调;WANG等[18]利用RNA-seq技术研究了葡萄柚的抗病及感病品系在黄龙病菌(CandidatusLiberibacter asiaticus)侵染后的转录表达差异,发现两个品系在转录因子、次级代谢、受体激酶及激素信号转导等多个途径相关基因均存在表达差异,通过后续验证,推测出与黄龙病菌抗性相关的两个基因DMR6-like和 NPR1-like;李湘龙等[19]通过 RNA-seq技术分析水稻与稻瘟病菌(Magnaporthe oryzae)互作早期的转录表达谱,为研究稻瘟病菌效应蛋白基因及其功能打下了基础。【本研究切入点】RNA-seq可为植物响应胁迫过程中基因表达调控、蛋白质功能和代谢通路等研究提供大量信息,在植物病原菌的致病机理、植物对病原菌的胁迫应答,以及病原菌与植物寄主相互作用的机制机理等研究中应用十分广泛。但利用RNA-seq技术进行链格孢菌橘致病型与柑橘互作的研究尚未见报道。【拟解决的关键问题】利用RNA-seq技术对链格孢菌橘致病型侵染红橘前后的基因表达变化进行分析,找到红橘响应链格孢菌橘致病型侵染的关键基因,为柑橘的抗病育种提供理论依据。
1 材料与方法
试验于 2018—2019年在西南大学柑桔研究所国家柑桔苗木脱毒中心实验室完成。
1.1 供试材料及样品采集
链格孢菌橘致病型菌株 Z7由浙江大学李红叶教授提供,保存于国家柑桔苗木脱毒中心实验室。寄主材料为红橘,种植于国家柑桔苗木脱毒中心网室。取活化后的链格孢菌橘致病型菌株 Z7于 PDB培养基上,30℃、150 r/min摇菌48 h。收集单个菌丝球接种大小、叶龄和成熟度均一致的红橘离体叶片,将处理组和未接种菌丝的对照组叶片于 28℃培养箱保湿培养。接种28 h后,叶片出现轻微反应,未见明显症状,此时采集样品,利用RNA-seq技术分析红橘对链格孢菌橘致病型的早期防御机制。每个样本同时取两份,一份送交公司测序,另一份液氮中速冻后保存于-80℃冰箱用于后期试验验证。对照和处理组分别设置3个生物学重复(对照样本名称分别为C0_1/2/3,接种菌株样本名称分别为ZC_1/2/3)。
1.2 转录组测序
1.2.1 总RNA提取及质量检测 采用Trizol(Invitrogen)提取寄主叶片总RNA[11],并用RQ1 RNase-Free DNase(Promega)处理去除DNA。利用1.2%琼脂糖凝胶电泳进行 RNA条带初步分析。使用分光光度计NanoDropTM(ThermoFisher)进行样本纯度的检测,通过OD260/280及OD260/230比值进行判断。采用Agilent 2100 Bioanalyzer(Agilent RNA 6000 Nano Kit)检测样品总RNA的浓度、完整性(RIN值、28S/18S)及片段大小,主要根据真核生物rRNA的完整性来判断,包括28S rRNA、18S rRNA及5.8S rRNA的峰值及电泳条带完整性。
1.2.2 文库构建与上机测序 样品提取总RNA后,用Dynalbeads oligo(dT)磁珠富集有polyA尾巴的mRNA,加入 fragment buffer将 RNA片段化,再以片段化的mRNA为模板,采用随机的N6 primer进行反转录生成cDNA一链,再合成cDNA二链,纯化并经DNA末端修复,加碱基A,加测序接头,再经琼脂糖凝胶电泳回收目的片段,完成文库构建。利用BGISEQ-500平台采用双末端法(Pair-End)对文库进行测序。
1.3 转录组数据分析
1.3.1 原始测序数据处理 测序得到的原始序列中含有带接头的、低质量的reads,为了保证后续信息分析质量,需要对原始测序数据进行过滤,得到 clean reads,以保证后续分析数据的可靠性。
1.3.2 参考基因组比对 针对上述得到的 clean reads,使用HISAT[20]将clean reads比对到甜橙参考基因组序列(http://www.ncbi.nlm.nih.gov/genome/10702),然后统计比对上的基因组的比对率以及 reads在染色体上的分布,从整体上了解样品差异。
1.3.3 表达量分析及差异表达基因检测 使用Bowtie 2将clean reads比对到上述较为完整的参考序列,再使用RSEM计算基因和转录本的表达水平。使用PossionDis算法进行差异基因检测,参数为|log2fold change (FC)|≥1,q-value≤0.01。
1.3.4 差异表达基因功能分析 利用 GO数据库对差异表达基因进行功能分类,利用KEGG分析代谢途径,使用P-value<0.05作为显著富集基因的阈值,使用MapMan软件对差异基因进行图形化分析。
1.4 qRT-PCR验证
采用与转录组测序相同的样品材料,随机选取差异表达基因进行qRT-PCR分析,验证转录组测序分析数据的可靠性。
通过 DNAman软件设计引物,然后由英潍捷基(上海)贸易有限公司进行引物的合成,并通过电泳及qRT-PCR熔解曲线检测引物特异性。相关验证基因扩增引物序列见表 1。使用 2-ΔΔCT法计算基因的相对表达并换算成log2FC。
2 结果
2.1 与参考基因组比对结果
测序 reads经过数据质控后,将各样品过滤后的clean reads与甜橙基因组进行比对分析,各样品的比对率及唯一比对率都相对比较均匀,详细的比对结果见表2。经测序得到的6个转录组文库中的数据与甜橙参考基因组进行比对后获得的 mapped reads占总reads的74%以上,根据样品间分析可知,对照样品中的mapping率接近90%,说明在接菌后随着菌体在叶片内增殖,病原菌的转录本影响总的mapping。
2.2 差异表达基因筛选
根据差异基因筛选条件q-value≤0.01,差异倍数|log2FC|≥1,链格孢菌橘致病型接种红橘28 h后获得上调差异基因5 173个,下调差异基因为6 555个(图1)。

表2 比对参考基因组结果统计Table 2 Summary of genome mapping

图1 链格孢菌橘致病型侵染引起红橘差异表达基因火山图Fig. 1 Volcano plot of DEGs of tangerine inoculated with A. alternata tangerine pathotype
2.3 差异表达基因GO功能富集分析
红橘受链格孢菌橘致病型侵染的差异基因根据GO分类的规则分为3大类:分子功能、细胞组分和生物学过程(图2)。在生物学过程中差异基因主要属于蛋白磷酸化、代谢过程、氧化还原过程和跨膜运输。细胞组分中只包括两类与膜相关的条目。分子功能相关的基因富集最多,其中更多基因富集在蛋白结合、ATP结合、催化活性、蛋白激酶活性和氧化还原活性。
对所有富集的GO term进行筛选,筛选条件为多重检验校正q-value<0.05,利用WEGO通过比较所有富集的基因和差异基因占基因总数的百分比,可以得出哪些差异的比例高出一般基因富集的水平,如图 3所示,在代谢过程、膜系统、抗氧化活性、转运及核酸绑定相关基因GO富集程度高于平均水平。
将差异基因分成表达上调和表达下调基因,图 4显示在同病原菌互作过程中,红橘不同代谢途径的基因均呈现上调或下调,值得注意的是碳水化合物代谢过程中上调基因91个而下调基因146个,说明病原菌侵染直接破坏红橘的碳水化合物代谢。叶绿体相关的基因和调控光系统的基因也主要呈下调状态,说明光合作用也受到负面影响。微管相关基因也是以下调状态为主,说明细胞骨架也被病原菌攻击受损。DNA绑定的转录因子活性增强,说明大量转录因子被激活调控下游抗病基因表达,蛋白激酶活性也以上调为主,说明免疫相关的PTI和ETI中大量受体激酶也被病原菌激活。
2.4 差异表达基因KEGG功能富集分析
以KEGG Pathway为单位,应用超几何检验,分析鉴别差异表达基因中显著富集的代谢通路或信号转导途径。Pathway富集到的通路涉及到6 975个差异基因,对所有富集的KEGG Pathway进行筛选,共获得20条显著富集的Pathway,分别为代谢途径(ko01100)、次生代谢物合成(ko01110)、碳循环(ko01200)、糖酵解/糖异生(ko00010)、丙酮酸代谢(ko00620)、光合作用(ko00195)、柠檬酸循环(ko00020)、光合作用-天线蛋白质(ko00196)、脂肪酸降解(ko00071)、卟啉和叶绿素代谢(ko00860)、甘氨酸、丝氨酸和苏氨酸代谢(ko00260)、氨基糖和核苷酸糖代谢(ko00520)、谷胱甘肽代谢(ko00480)、α-亚麻酸代谢(ko00592)、苯丙烷类生物合成(ko00940)、植物激素信号转导(ko04075)、抗坏血酸代谢(ko00053)、双酚降解(ko00363)、柠檬烯和蒎烯的降解(ko00903)、二苯乙烯、二芳庚烯和姜辣素的生物合成(ko00945)(图5)。
2.5 红橘响应链格孢菌橘致病型侵染差异表达基因
2.5.1 植物激素信号转导途径及相关基因 接种链格孢菌橘致病型28 h RNA-seq结果显示,红橘防御相关的植物激素信号转导途径中多个基因表达具有差异,乙烯(ET)、水杨酸(SA)和生长素(AUX)等重要防御相关的植物激素信号通路受到影响(图6)。
在红橘响应链格孢菌橘致病型的激素信号转导中乙烯起了主导作用。首先,乙烯受体ETR的3个成员Cs9g08850、Cs5g33560和Cs5g14390被该菌不同程度激活,ETR下游的激酶CTR1中Cs6g15490、Cs3g17090表达量也随之升高,随后受MPK-MEKK将信号进一步放大,到信号下游Cs4g17960和Cs7g05390(编码EBF 1/2),Cs3g06940、Cs3g06930、orange1.1t04381、Cs2g29100(编码EIN3)和最终的转录调控因子乙烯响应因子ERF 1/2均表现出表达量升高趋势。

图2 差异表达基因GO富集Fig. 2 DEGs GO enrichment

图3 差异表达基因WEGO分类Fig. 3 WEGO classification of DEGs

图4 差异表达基因GO分类Fig. 4 GO classification of DEGs

图5 差异表达基因的KEGG通路分析Fig. 5 KEGG pathway analysis of DEGs
而在生长素信号中大部分的关键基因表达下调,AUX作为生长素信号的最上游,大量的红橘同源基因Cs8g16440、Cs3g05470、Cs2g05440、Cs3g05500、orange1.1t00508等均呈现下调表达趋势,而生长素响应蛋白编码基因Cs8g16440、Cs3g05470、Cs2g05440、Cs3g05500、orange1.1t00508等也随AUX信号诱导剧烈上升,在生长素信号途径重要转录因子家族中的生长素响应因子ARF是具有多个成员的基因家族,而红橘中绝大部分成员如Cs8g16440、Cs3g05470、Cs2g05440、Cs3g05500、orange1.1t00508、Cs5g32400都表现出受链格孢菌橘致病型诱导的负调控表达。
在 SA合成-降解途径中,Cs2g18260编码的UGT74F1在体外将UDP-葡萄糖转移至水杨酸(形成葡糖苷)、苯甲酸、槲皮素和草酸盐。Cs2g18240对应S-腺苷-L-甲硫氨酸依赖性甲基转移酶超家族蛋白,具有甲基转移酶活性参与水杨酸合成,Cs5g21260(编码UGT74F1)由水杨酸、病毒、真菌和细菌诱导,参与色氨酸合成途径。这些参与水杨酸合成途径的基因受链格孢菌橘致病型诱导后均表达下调,推测在该菌侵染过程中有大量SA合成。在SA信号转导途径中大量的TGA转录因子同样受该菌诱导,而下游的PR基因不同成员既有表达上调也有表达下调,这些基因除了受SA调控外也受其他信号影响。
2.5.2 红橘响应链格孢菌橘致病型的转录调控 转录因子(TF)是开启基因转录过程的“主要开关”。图 7显示本研究在差异表达基因中发现来自不同 TF家族的多个成员。最具代表性的TF类是WRKY系列,在红橘中大概有50个成员,大部分成员均受链格孢菌橘致病型诱导正调控,其中WRKY22、WRKY33、WRKY72、WRKY75、WRKY28都相较于对照上调 10倍以上,同时也包括WRKY13在内的一些成员响应该菌并表达下调。bZIP类转录因子能与WRKY蛋白发生互作,通常与 WRKY参与相同的调控模式。转录组数据显示在差异表达基因中 bZIP家族的大部分成员(Cs1g26010、Cs3g10860、Ccs7g29820)也受该菌侵染上调表达,只不过表达显著性稍低于 WRKY转录因子。由于乙烯信号途径基因的大量表达,在转录因子中有一类称为乙烯响应因子的蛋白与该信号途径联系紧密,而差异表达分析也验证了相关的数据,在该菌侵染28 h后的样品中超过50%的ERF家族成员(Cs3g23270、Cs4g06410、Cs5g33540)表达上调,其他 TF家族也不同形式的被诱导差异表达,包括NAC、MYB、ZF-HD、B3、HB、C2H2、TiFy和bHLH家族。

图6 KEGG map分析植物激素信号转导相关的差异表达基因Fig. 6 DEGs involved in plant hormone signal transduction analyzed by KEGG map

图7 MapMan分析转录因子相关的差异表达基因Fig. 7 DEGs involved in transcription factor analyzed by MapMan
2.5.3 次级代谢产物生物合成相关基因 在响应链格孢菌橘致病型过程中,与黄酮醇、花青素、萜类化合物和生物碱生物合成相关的基因受该菌诱导产生剧烈变化(图 8)。萜类合成中大部分基因表现下调,而黄酮类合成相关的差异表达基因既有表达上调又有表达下调,总体来说表达上调基因的数量和表达趋势均强于表达下调基因,其中黄烷酮-3-羟化酶(Cs1g03950)、2-oxoglutarate(Cs5g29930、Cs9g02930、Cs9g14520、Cs9g14500)和 Fe(II)/ascorbate oxidase(orange1.1t03581、orange1.1t03576、orange1.1t03582)均在侵染过程中积累,UDP-糖基转移酶家族则在黄酮和花青素合成过程中表达下调。硫代葡萄糖苷有抗虫和抑菌的作用,在该菌的影响下总体呈现上调趋势,而生物碱相关基因和类胡萝卜素代谢相关基因表达趋势与此相反。此外,该菌还诱导了涉及木质素生物合成的基因 PAL(Cs8g16290、Cs7g24940)、4CL(Cs5g06990)、HTC(Cs1g14450),表明在受侵染的组织中木质素沉积,木质化可作为限制病原菌定殖的有效防御机制,转录组数据呈现出感染组织中细胞壁活动剧烈变化,支持了植物在感染期间感知病原并激活防御机制的观点。
2.5.4 病原与植物互作途径相关基因 MAPK信号途径中CsMPK7、CsMKK3、CsMAP3Ka信号级联均受链格孢菌橘致病型激活表达,同时表达量上调的还有下游主要转录因子成员ERF、WRKY、bZIP、MYB。ETI中的 R 蛋白基因(Cs5g21850、Cs5g21860、orange1.1t03118),TIR-NBS-LRR类抗病蛋白编码基因(Cs1g26330)和NB-ARC类抗病蛋白编码基因(orange1.1t03734)均响应该菌正向调控表达,NB-LRR家族也是由该菌侵染诱导引起寄主细胞程序性死亡并产生过敏反应(HR)。
植物跨膜受体能感知细胞外微生物相关分子,跨膜受体对应不同的受体激酶,激酶有不同的胞外结构域对应识别不同的胞外分子。本研究结果显示,受感染的红橘显著富集受体激酶和受体蛋白质,在被链格孢菌橘致病型侵染28 h后,红橘多个LRR类受体基因(Cs2g04320、Cs2g04330、Cs6g10370)被激活,此外还有DUF受体激酶、LRK受体激酶、LysM类受体激酶、WAK受体激酶和凝集素受体激酶这些不同类型的激酶基因都有超过 5个以上的家族成员被剧烈诱导。此外多种基因编码抗菌蛋白也在该菌激活下引起上调,这些基因属于病程相关(PR)超家族,包括多个家族组成的抗病群体构成植物诱导防御机制,编码PR基因的转录本PR-1、PR-2(β-1-3-葡聚糖酶)、PR-3、PR-4、PR-8、PR-11(几丁质酶)、PR-5(thaumatin)、PR-6(蛋白酶抑制剂)、PR-9(过氧化物酶)和PR-10(核糖核酸酶)在链格孢菌橘致病型侵染期间累积。高等植物中的保护酶系统在遭受胁迫过程中保护植物不受细胞内ROS造成的氧化损伤,调控抗氧化活性清除ROS对植物的伤害依赖于过氧化物酶(POD)家族蛋白。显然,在红橘受到链格孢菌橘致病型侵害的过程中需要积累大量的 POD 基因,因此Cs2g09310、Cs2g28680、Cs7g20700等22个POD成员基因均受到活性氧信号激发大量表达。其他上调防御基因包括转录因子、蛋白酶抑制剂和NADPH氧化酶负责产生超氧离子,这些结果证实柑橘内部启动了完全的防御反应(图9)。
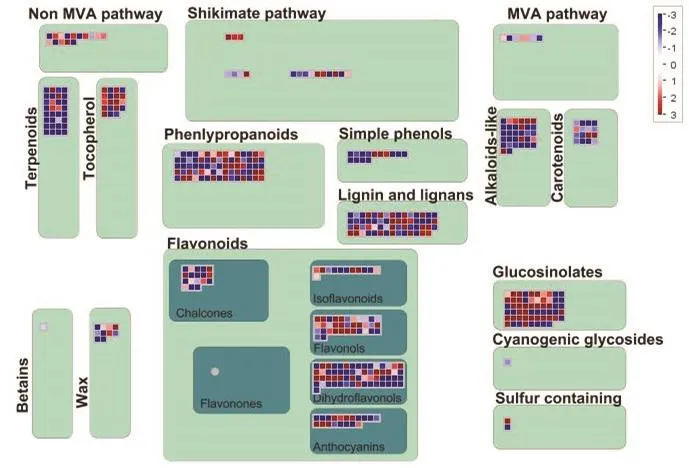
图8 MapMan分析次级代谢产物合成相关的差异表达基因Fig. 8 DEGs involved in secondary metabolite biosynthesis analyzed by MapMan

图9 MapMan分析寄主-病原互作相关的差异表达基因Fig. 9 DEGs involved in host-pathogen interaction analyzed by MapMan
2.6 qRT-PCR验证
为检测转录数据的真实性和可靠性,根据转录组的差异基因,选取了一些已报道明确与植物抗病相关的基因且在差异表达分析中log2FC接近10的成员,通过qRT-PCR技术检测其表达水平。由图10可以看出调控抗氧化活性的POD基因(Cs2g09310、Cs7g20700)和谷胱甘肽转移酶基因(orange1.1t03618)在接种链格孢菌橘致病型的样品中均显著表达上调,细胞壁代谢相关的漆酶(Cs6g07410)和果胶转移酶(Cs3g10430)受该菌攻击也呈现上调趋势,PTI响应的受体激酶 LRR(orange1.1t05311)也受该菌诱导,同样ETI调控的R基因NB-ARC 蛋白(Cs1g01180)也上调,几丁质酶(Cs5g21860、orange1.1t03118)作为主要的抗病蛋白上调倍数均超过 10倍,转录因子 NAC(Cs5g15470)、MYB(Cs4g12760)和WRKY(Cs6g20850)均为植物抗逆过程中重要的调控因子,qRT-PCR和转录数据显示所检测的3个转录因子均受该菌诱导显著上调,qRT-PCR结果与转录组显示基因表达变化趋势一致。
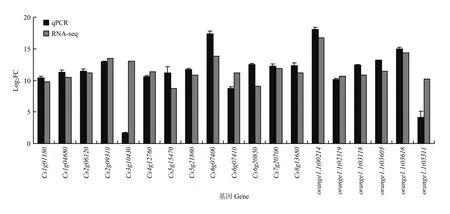
图10 差异表达基因qRT-PCR鉴定Fig. 10 Identification of DEGs by qRT-PCR
3 讨论
3.1 植物防御反应中的激素平衡
本研究中的 MPK信号通路和乙烯信号途径均富集大量上调的差异基因,MPK家族成员接受链格孢菌橘致病型信号从而控制红橘 ET信号合成,通过ET信号调控下游ERF类转录因子起到激活抗病基因的作用。本氏烟的Ca2+结合蛋白Calreticulin 3a在识别源自致病疫霉(Phytophthora infestans)的MAMP后参与ET的诱导产生,进一步证明ET信号传导是产生抗微生物毒素所必需的[21]。Ca2+信号(CDPK和 CML)在本研究中被激活,因此 Ca2+也参与响应链格孢菌橘致病型入侵信号并激活 ET产生来调控抗病反应。
通过MapMan和KEGG所注释的差异基因显示,红橘茉莉酸(JA)途径中的激素合成及信号转导相关基因均发生剧烈变化,其中编码JA生物合成所需12-氧代二亚油酸还原酶的7个基因全部上调,JA受链格孢菌橘致病型侵染后大量合成作为抗病信号激活下游基因表达。关于 JA参与防御反应的报道很多,如通过激发子和病原体攻击增加内源性 JA和茉莉酸甲酯(MeJA)水平,外源性应用JA或MeJA诱导防御反应基因表达[22-23]。本研究中的JA下游PR基因和相关次生代谢产物合成基因均受到不同程度诱导。芸薹生链格孢(A. brassicicola)感染上调JA生物合成和JA诱导的防御基因[24]。通过直接对拟南芥喷雾接种芸薹生链格孢分生孢子能激活JA相关基因表达[25]。JA在小麦冠腐病菌(Fusarium pseudograminearum)攻击期间延迟了小麦症状的产生[26],并且增强了对壳多胞(Stagonospora nodorum)感染的抗性[27],因此JA信号通路是植物对抗死体营养型真菌特别是链格孢真菌的主要信号转导途径。
3.2 转录因子调控植物防御反应
链格孢菌橘致病型侵染红橘的过程调控抗病基因表达的主要为WRKY和ERF转录因子,检测到的43个差异表达的 WRKY转录因子中只有 9个表达下调,其余成员均显著上调,其中WRKY22/28/72/75的log2FC接近10。由于受乙烯信号的刺激,乙烯响应因子 ERF(Cs7g19640、Cs7g04300、Cs1g04680和Cs1g04650)显著上调并且超过10倍以上。
WRKY转录因子可作为防御基因表达中的正或负调节因子,并且是不同防御信号途径的靶标[28]。拟南芥 WRKY70参与防御途径之间的交互作用,对坏死细菌软腐菌(Pectobacterium carotovorum)的抗性起重要作用,作为SA响应转录的激活因子又是JA响应转录的抑制剂[29]。AtWRKY70在灰葡萄孢(Botrytis cinerea)感染中被诱导,并且wrky70突变体表现出对此菌的敏感性增强,却对死体营养型真菌芸薹生链格孢具有抗性[30]。本研究中红橘的WRKY70作为拟南芥AtWRKY的同源基因,也受链格孢菌橘致病型激活,说明WRKY70对植物抵御死体营养型真菌的机制有一定相似性。拟南芥wrky33突变体对上述两种菌均非常敏感,表明WRKY33是对这些死体营养型真菌防御的关键正调控因子[31]。WRKY33整合寄主信号传导以赋予对病原体攻击抗性的作用模式,并且WRKY33与MAP4及MPK4的底物MKS1在细胞核相互作用来实现对抗病信号的调控[32-33]。在菊花中也筛选到一个响应链格孢的转录因子基因CmWRKY33.1,通过在菊花中过表达证实该基因亦能增强菊花对该菌的敏感性[34]。过表达菊花的另一个WRKY转录因子基因CmWRKY15可激活ABA相关下游基因,增加过表达植株对细极链格孢(A. tenuissima)的敏感性[35]。在甜橙基因组中预计有超过50个WRKY转录因子,本试验接种链格孢菌橘致病型28 h后通过MapMan注释到WRKY成员中80%以上显著上调,红橘受该菌胁迫后激活转录因子的主要成员为WRKY,其转录的部分成员可能是红橘对链格孢菌橘致病型的感病基因。
APETALA2/乙烯响应元件结合因子(AP2/ERF)家族构成一个大型植物特异性转录因子家族,拟南芥中有140多个成员,水稻中有160个成员[36]。转录分析揭示AP2/ERF型转录因子家族成员在病原菌攻击后被强烈诱导。ERF亚家族成员显示出对 GCC序列(AGCCGCC)的最大亲和力,并且参与对生物应激响应基因的调节,特别是与JA和ET信号传导途径相关的基因[37-39]。过表达ERF1的转基因拟南芥系足以赋予植株对灰葡萄孢、棉花枯萎病菌(F. oxysporum)和小不整球壳菌(Plectosphaerellacucumerina)的抗性[40-41]。ERF59/ORA59的过表达增强对灰葡萄孢的抗性,而RNAi-ORA59沉默的株系更易受影响[36]。ERF1和ERF59/ORA59似乎都是JA和ET信号通路的关键整合子[25]。ORA59被证明是抵消SA介导的JA/ET应答基因抑制的关键介质[42]。在链格孢菌橘致病型侵染过程中红橘的ERF家族成员受病原菌剧烈诱导,也说明红橘在响应该菌侵染的过程中ET水平改变作为信号刺激下游抗病基因表达来实现抗菌目的。
3.3 植物次级代谢产物介导的防御反应
苯丙烷代谢途径是参与植物防御反应的主要次级代谢产物通路之一,该途径主要通过诱导植物产生具有抗病原微生物活性的次级代谢产物[43]。ZHU等[44]在对苹果响应链格孢菌苹果致病型(A.alternataapple pathotype)的转录组研究中发现β-葡萄糖苷酶基因被诱导表达,该基因参加修饰多种植物抗毒素。氧脂素作为一种具有保护作用的分子,其相关的合成基因LOX也受该菌诱导。本研究中β-葡萄糖苷酶基因和LOX同源基因也受链格孢菌橘致病型诱导大量表达。另外,木质素合成相关的漆酶(Cs6g07400、Cs6g07410)、HCT(Cs7g29080)、COMT(Cs5g18010、orange1.1t05423、Cs5g24990、orange1.1t00578、Cs5g24910)表达量均超出对照 6倍以上。DORIA等利用双向电泳研究柑橘响应该菌的蛋白质组学也发现木质素合成相关基因 Caffeic acid 3-O-methyltransferase-like(COMT)和 Caffeoyl-coa O-methyltransferase-like(CCOMT)显著上调表达[45]。烟草在抵御链格孢菌烟草致病型(A. alternatatobacco pathotype)时能响应激发子诱导的JA信号苯丙烷途径中feruloyl-CoA 6′-hydroxylase 1表达生成东莨菪素[46]。此外,在红橘响应链格孢菌橘致病型的过程中,咖啡因代谢途径中的差异基因(Cs2g30140和Cs7g23340)均显著上调,因此次生代谢产物能直接或间接地参与红橘对该菌的抗病过程。
类异戊二烯或萜类化合物是一组用于生长和发育的化学物质,但也具有抵抗不同压力的特殊功能[47],烟草中的ERF转录因子受ET和JA信号调控,能激活下游的EAS12表达合成倍半萜类抗菌物质甜椒醇抑制链格孢菌烟草致病型[48]。水稻OsTPS19超表达帮助植株产生大量柠檬烯从而抵御稻瘟病菌[49]。正常状态下植物的萜类物质具有参与抑制病原菌生长并且在植物体内传递抗病信号的作用[50],然而红橘被链格孢菌橘致病型侵染过程中MapMan注释的萜类合成30个基因中22个呈现下调表达,而在激素信号中ET和JA信号又呈现出上调表达,表明该菌对红橘体内萜类骨架的破坏导致抗病的萜烯类物质合成受影响,造成萜类物质含量不足以抑制该菌导致感病。
3.4 红橘防御链格孢菌橘致病型侵染的 ROS信号及ROS清除
ROS产生与清理之间的平衡会受到许多不利因素的干扰,植物受到严重胁迫时 ROS平衡会被打破[51]。病原菌攻击会造成大量的ROS产生来抑制病菌在植物体内繁殖,病菌和植物体双方都通过清除ROS维持自身细胞活性,链格孢菌通过NADPH氧化酶和过氧化物酶耐受植物产生的 ROS保证其毒力[10]。NADPH氧化酶是植物-病原体互作过程中产生 ROS的主要因子之一,通过将电子从细胞内NADPH转移到质外体中的分子氧来催化超氧化物产生的跨膜蛋白[52],可通过自发歧化或细胞壁超氧化物歧化酶(SOD)的催化活性将超氧化物进一步转化为H2O2。ROS产生的主要来源是NADPH氧化酶[53]。本研究显示柑橘能通过识别链格孢菌橘致病型的PPR导致CDPK活性升高,促使下游NADPH氧化酶同源基因rboh-Cs8g12000和Cs3g14240显著升高来调控ROS抑制该病原菌生长。
过氧化物酶类如抗坏血酸过氧化物酶(APX)和谷胱甘肽过氧化物酶(GPX)被证实为植物受到病原菌侵染时产生的病程相关蛋白,是有效的活性氧清除剂,在植物调控细胞的氧化还原动态平衡、防御反应及胁迫响应中具有重要作用[54]。植物中的酶法 ROS清除机制还包括SOD和过氧化氢酶(CAT),在链格孢菌橘致病型接种后的红橘中检测到Cs2g09310、Cs2g28680和Cs7g20700等20多个POD成员均受到真菌毒素刺激活性氧信号激发大量表达,其他抗氧化途径中包括超过30个谷胱甘肽转移酶(GST)受ROS诱导,抗坏血酸合成酶和APX都有不同程度上调,而在不同品种柑橘响应链格孢菌橘致病型的双向电泳中筛选出的差异蛋白同样发现GSTAPX[45],从转录层面和蛋白层面说明感病柑橘通过保护酶系统调整自身内部的ROS平衡来对抗该菌。
4 结论
链格孢菌橘致病型的侵染引起红橘大量基因差异表达。利用qRT-PCR验证了19个差异基因的表达量变化,均与 RNA-seq分析结果一致。GO功能分类显示差异基因主要与分子功能、细胞成分和生物过程相关。KEGG和MapMan分析表明,受链格孢菌橘致病型诱导上调的差异表达基因可富集到病原菌识别、信号转导、活性氧消除、转录调控、次生代谢反应病程相关蛋白等生物胁迫相关基因类别。转录组数据分析显示,大量萜类合成酶在受链格孢菌橘致病型侵染后呈现下调表达,推测是红橘对该菌敏感的原因。

