陆地棉GhWRKY33的克隆及抗旱功能分析
魏鑫,王寒涛,魏恒玲,付小康,马亮,芦建华,王省芬,喻树迅
(1河北农业大学/棉花生物学国家重点实验室河北基地,河北保定 071001;2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000)
0 引言
【研究意义】棉花是重要的经济作物,经常遭受干旱、盐碱等恶劣环境条件的影响,造成棉花产量和品质下降。当植物受到干旱胁迫后,会启动一系列干旱胁迫相关基因的表达,从分子水平、细胞水平以及生理生化水平做出相应的应激反应,从而实现对干旱胁迫的抗逆反应[1-2]。转录因子通常作为一类调控因子参与植物的生长发育及干旱等各种胁迫应答过程,因此对转录因子的功能进行研究具有重要意义[3]。【前人研究进展】WRKY转录因子是植物中最大的转录因子家族之一,由1个或2个WRKY保守结构域构成,N端是一段高度保守的序列(WRKYGQK),由大约60个保守的氨基酸残基组成,而 C端是锌指结构(CX4-5CX22-23HX1H或 CX7CX23HX1C)[4-5]。根据保守的WRKY结构域数量和锌指序列不同的特点,可将WRKY蛋白归为3组。Ⅰ组有2个WRKY结构域,锌指结构类型为 C2H2,Ⅱ组和Ⅲ组包含 1个WRKY结构域,锌指结构类型分别为C2H2和C2HC。根据WRKY结构域的进化关系和某些氨基酸基序,Ⅱ组又可以分为5个亚组:Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe[6-8]。前人研究表明,许多 WRKY转录因子在植物的生长发育、各种胁迫反应中具有重要作用[9-12],尤其在干旱胁迫中充当着十分重要的角色。CHU等[13]通过将陆地棉GhWRKY41转化烟草,发现该基因过量表达提高了转基因烟草的抗旱性水平,且干旱条件下植株的丙二醛含量降低,抗氧化酶活性增强,促进了气孔的关闭。烟草中过表达GhWRKY25,干旱条件下丙二醛、活性氧含量升高,超氧化物歧化酶、过氧化物酶、过氧化氢酶活性降低,植株抗旱能力下降[14]。在拟南芥中,AtWRKY44通过糖信号通路调控其对干旱胁迫的响应[15];过表达AtWRKY57提高了拟南芥的抗旱性和耐盐性[16];AtWRKY46被证实调节干旱和盐胁迫,且参与调节光依赖性的气孔开放[17]。MtWRKY76的过表达显著提高了转基因植株的抗旱性[18]。在葡萄中,VIWRKY48在干旱胁迫下也被证明能够提高过氧化氢酶、过氧化物酶、过氧化物歧化酶的抗氧化酶活性,不仅增加了葡萄的抗旱性,同时在抗白粉病中也发挥着重要作用[19]。【本研究切入点】棉花是非常重要的经济作物,但其产量和品质严重受到干旱、盐碱的影响。WRKY转录因子作为植物中最大的转录因子家族之一,与众多的非生物胁迫相关,但在棉花中与干旱相关的研究较少。【拟解决的关键问题】本研究通过克隆棉花GhWRKY33,并进行亚细胞定位,分析其在干旱及不同激素处理下的表达模式,在拟南芥中过量表达,明确其在抗旱中的作用,为棉花抗旱机制解析及分子育种奠定基础。
1 材料与方法
1.1 材料
棉花材料中棉所 10号以及拟南芥哥伦比亚野生型(Col-0生态型)均由中国农业科学院棉花研究所早熟课题组提供。

表1 研究所用引物Table 1 Primers used in this study
1.2 GhWRKY33的克隆
通过在线网站CottonFGD(https://cottonfgd.org/)搜索并下载陆地棉GhWRKY33的 CDS序列,使用Oligo 7.0软件设计特异引物(GhWRKY33-F/R),以陆地棉中棉所10号叶片组织为材料,利用北京天根生化科技有限公司生产的 RNAprep Pure多糖多酚植物总RNA快速提取盒提取RNA,Nanodrop2000核酸分析仪测定RNA的纯度和浓度,10 mg·L-1琼脂糖凝胶电泳检测 RNA完整性;使用 TaKaRa公司的PrimerScript RT reagent Kit with gDNA Eraser反转录试剂盒将RNA反转录合成cDNA。利用GhWRKY33-F、GhWRKY33-R引物扩增得到GhWRKY33,PCR体系为 2×Spark Buffer 25 μL、dNTP 1 μL、上下游引物各 2 μL、cDNA 2 μL、Ploymerase 1 μL、无菌水 17 μL,反应程序为 95℃ 30 s;95℃ 15 s,72℃ 15 s,72℃ 90 s,共30个循环;72℃ 5 min。PCR产物回收、纯化,送河南尚亚生物技术公司测序,从而获得序列正确的GhWRKY33片段。
1.3 生物信息学分析
使用 SOPMA分析蛋白的二级结构;使用ProtScale(http://web.expasy.org/protscale)预测蛋白的亲疏水性;使用NetPhos2.0 Server(http://www.cbs.dtu.dk/services/NetPhos-2.0/)预测蛋白的磷酸化位点;通过 PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对基因上游2 000 bp序列进行分析;通过NCBI(https://www.ncbi.nlm.nih.gov/)中BLASTP搜索与该基因同源性较高的序列,并利用MEGA X中邻近法构建进化树,bootstrap值设置为1 000;利用DNAMAN V6进行多重序列比对。
1.4 GhWRKY33的亚细胞定位
利用MEGA 6.0设计引物GhWRKY33-GFP-F/R,以pBI121-GhWRKY33过表达载体质粒为模板进行扩增,用限制性内切酶XbaⅠ、SpeⅠ对pBI121-GFP载体进行双酶切,利用同源重组法构建融合蛋白瞬时表达载体35S::GhWRKY33-GFP,通过农杆菌渗透法将融合表达载体注射到本氏烟草叶片中,同时注射pBI121-GFP载体作为对照,暗培养24 h后再在正常条件下培养24 h,利用激光共聚焦显微镜观察荧光信号。
1.5 GhWRKY33的组织表达模式分析
为了研究GhWRKY33的组织表达模式,在开花期取中棉所10号的根、茎、叶片、雄蕊、雌蕊、顶芽、花瓣、萼片等组织,利用多糖多酚植物 RNA提取试剂盒提取各组织的 RNA,反转录合成 cDNA,使用ABI7500 Real Time PCR Systerm进行实时荧光定量PCR试验,反应体系为2×Ultra SYBR Mixture 10 μL、Primer F 0.4 μL、Primer R 0.4 μL、cDNA 0.8 μL、ddH2O 8.4 μL。反应程序为 95℃ 10 min;95℃ 15 s,60℃ 30 s,72℃ 32 s;95℃ 15 s,60℃ 1 min;95℃ 30 s,60℃ 15 s,30个循环。每种组织取3个生物学重复,并进行3次独立的试验,使用相对定量法2-ΔΔCt[20]进行数据分析。
1.6 不同激素处理和干旱胁迫下的基因表达分析
将中棉所10号种植于温室,正常生长至3叶期,对棉苗进行激素和干旱处理。激素处理:分别取茉莉酸(100 μmol·L-1)、脱落酸(100 μmol·L-1)、乙烯(0.2%ET)溶液各10 mL,均匀喷洒至叶片表面;干旱处理:用自来水将棉苗的根冲洗干净后,将棉苗放置于锥形瓶中,加入18%的PEG6000溶液100 mL模拟干旱。每个处理选取5株棉苗,在处理后0、3、6、12、24和48 h时取样,用于基因表达分析,qRT-PCR反应体系和条件同1.4所述。
1.7 转基因拟南芥的获得
将pBI121载体线性化,其酶切位点上游为XbaⅠ、下游为SacⅠ,利用同源重组的方法将目的片段与载体连接,并转化大肠杆菌DH5α,通过菌液PCR验证为阳性菌落后,送河南尚亚生物技术公司测序,从而获得序列正确的GhWRKY33片段。
通过农杆菌介导的蘸花法转化拟南芥。将侵染后的拟南芥暗培养24 h,然后转移至正常条件培养室培养,一个月左右收获拟南芥种子,将种子30℃烘干2 d,用1% NaClO、75%的乙醇消毒,灭菌ddH2O清洗5次以上,平铺至含有卡那霉素的 1/2MS培养板,4℃春化2 d,放置22℃、16 h光照/8 h黑暗的培养箱中培养筛选阳性植株,之后单株收获,以同样的方法筛选直至获得T3代纯合株系。
1.8 转基因拟南芥的抗旱性鉴定
1.8.1 干旱处理后拟南芥性状鉴定 分别取少量的Col-0野生型、3个转基因拟南芥株系OE-1、OE-2、OE-3种子洒在营养土中,一周之后挑选生长状态一致的幼苗移栽至营养钵中,每个株系移栽3盆,每盆4棵苗,作为重复,正常生长 2周左右,使用 20%的PEG6000溶液浇灌根系,每盆大约150 mL,处理12 h后观察野生型Col-0、转基因株系OE-1、OE-2、OE-3的萎蔫情况。
1.8.2 脯氨酸含量测定 抗旱性强的植株会积累较多的脯氨酸,可以作为抗旱鉴定的指标之一。取干旱处理的野生型和 3个转基因株系的拟南芥叶片约 0.1 g,对照组和试验组均取3个生物学重复,按照试剂盒所述步骤操作:加入1 mL磺基水杨酸冰浴匀浆,沸水浴震荡10 min,10 000 r/min常温离心10 min,取上清静置冷却,取0.5 mL上清加入冰乙酸,0.5 mL脯氨酸提取液,沸水浴30 min,10 min震荡一次;冷却后加入1 mL甲苯震荡30 s,静置片刻,使色素转移至甲苯,于520 nm波长处比色,记录吸光值。标准曲线的制作:取试剂盒中标准品1 mg,分别配制为15、10、8、6、4、2、1和0 μg·mL-1,其余操作同样品的处理方法。
“图”是最直观的语言,最大的特点是可视化,将思维的过程和特征记录、固定下来,是一种化繁为简的思维方式。传统复习课主要针对中档学生,学困生畏难无趣、学优生不屑一顾,枯燥低效,绘图让人人参与,需要更深层次的思维拓展,激发了学困生的兴趣、学优生的潜能,取得多赢的局面。
1.8.3 丙二醛含量测定 丙二醛作为质膜过氧化的产物之一,与植物耐旱性呈负相关,也可作为耐旱性指标之一。取野生型和3个转基因株系的拟南芥叶片0.1 g,每组样品取3个重复,按照试剂盒所述步骤操作:将组织放到研钵中加入 1 mL提取液冰浴匀浆,8 000 r/min 4℃离心10 min,取上清置冰上待测;测定管中依次加入MDA检测工作液300 μL、样本100 μL、试剂三100 μL,空白管依次加入MDA监测工作液 300 μL、蒸馏水 100 μL、试剂三 100 μL;混合液在100℃水浴保温60 min,冰浴冷却,10 000 r/min常温离心10 min,取200 μL上清,测定各样品在450、532和 600 nm 处吸光度,计算 ΔA450=A450测定-A450空白、ΔA532=A532测定-A532空白、ΔA600=A600测定-A600空白。最终含量计算公式:MDA(nmol·mg-1)=5[6.45×(ΔA532-ΔA600)-0.56×ΔA450]/W。
2 结果
2.1 GhWRKY33的克隆与生物信息学分析
提取陆地棉中棉所 10号总 RNA,反转录后的cDNA作为模板,进行PCR扩增,得到目的片段与预期大小一致,约1 500 bp(图1),纯化后转入大肠杆菌并提取质粒。测序后,目的基因ORF全长1 533 bp,编码510个氨基酸残基,与参考基因组TM-1编号为Gh_D04G1318[21]的序列相似性达100%。

图1 GhWRKY33的PCR扩增Fig. 1 PCR amplification of GhWRKY33

图2 GhWRKY33编码蛋白的生物信息学分析Fig. 2 Bioinformatic analysis of GhWRKY33
SOPMA预测表明(图2-A),GhWRKY33蛋白的二级结构α螺旋(alpha helix)包含49个氨基酸残基,占 9.61%;延伸链(extened strand)的氨基酸残基有47个,占9.22%;β-转角(beta turn)包含14个氨基酸残基,占 2.75%;无规则卷曲(random coil)包含400个氨基酸残基,占78.43%,推测该蛋白的功能域主要由无规则卷曲构成。GhWRKY33蛋白含有26个苏氨酸(threonine)磷酸化位点(图 2-B),可能与磷酸化调控有密切关系。亲疏水性分析显示(图2-C),亲水蛋白所占比例较大,属于亲水蛋白,其亲水性平均系数为-1.180。
使用PlantCARE软件对基因上游2 000 bp序列分析,发现存在多个顺式作用元件(表 2)。如参与脱落酸调控反应的元件 ABER、参与光反应的元件G-box、参与干旱胁迫响应的MYB结合位点、与植物组织分生表达相关的元件CAT-box等。
2.2 GhWRKY33蛋白同源比对及进化分析
利用NCBI在线数据库,选取多条相似度较高的WRKY蛋白与GhWRKY33进行比对,结果显示目的蛋白有2个WRKYGQK保守域,且锌指结构为C2H2,属于第Ⅰ类WRKY转录因子(图3)。进一步构建系统发育树(图4),结果显示,其与GrWRKY33同源关系最近,同源性达到了99%,其次是拟南芥等,而与大豆的同缘关系最远。
2.3 GhWRKY33的组织特异性表达分析
以中棉所10号开花期的根、雄蕊、雌蕊、顶芽、叶片、茎、花瓣、萼片等组织为材料,对GhWRKY33进行组织特异性表达分析。结果显示,GhWRKY33具有明显的组织表达特异性,在芽中的表达量最高,其次是在雄蕊、雌蕊、叶片等组织,在根和茎中表达量最低(图5)。

表2 GhWRKY33启动子序列分析Table 2 Sequence analysis of GhWRKY33 gene promoter
2.4 干旱和不同激素处理条件下基因的表达分析
qRT-PCR结果表明,该基因表达受到PEG、乙烯、茉莉酸、脱落酸的诱导。随着PEG、乙烯、茉莉酸处理时间的推移,该基因的表达量呈上升趋势,在48 h达到高峰(图6-A、图6-B和图6-C);脱落酸处理24 h内,基因的表达变化趋势不明显,但48 h时基因的表达量急剧上升,较之前的各时间点上升了10倍左右(图6-D)。
2.5 GhWRKY33的亚细胞定位分析
以 pBI121-GFP空载体为对照,将其与融合表达载体35S::GhWRKY33-GFP通过农杆菌介导分别转入本氏烟草。结果显示,对照组在细胞核和细胞膜上均出现绿色荧光信号,而融合蛋白 35S::GhWRKY33-GFP只在细胞核中有绿色荧光信号(图7),表明该基因定位于细胞核中。
2.6 转基因拟南芥的抗旱性鉴定及抗旱相关生理生化指标分析
选取GhWRKY33表达量相对较高(图 8)的 3个T3代转基因拟南芥株系OE-1、OE-2、OE-3与野生型拟南芥同时浇灌等量的20% PEG6000溶液,发现12 h后野生型拟南芥和3个转基因株系都发生不同程度萎蔫,但是野生型较转基因株系萎蔫程度更加严重(图 9),表明基因过量表达可以提高拟南芥的抗旱性水平。

图3 GhWRKY33与其他物种WRKY蛋白序列比对分析Fig. 3 Sequence alignment of GhWRKY33 and WRKY proteins of other species

图4 不同WRKY蛋白的进化树分析Fig. 4 Phylogenetic analysis of different WRKY proteins
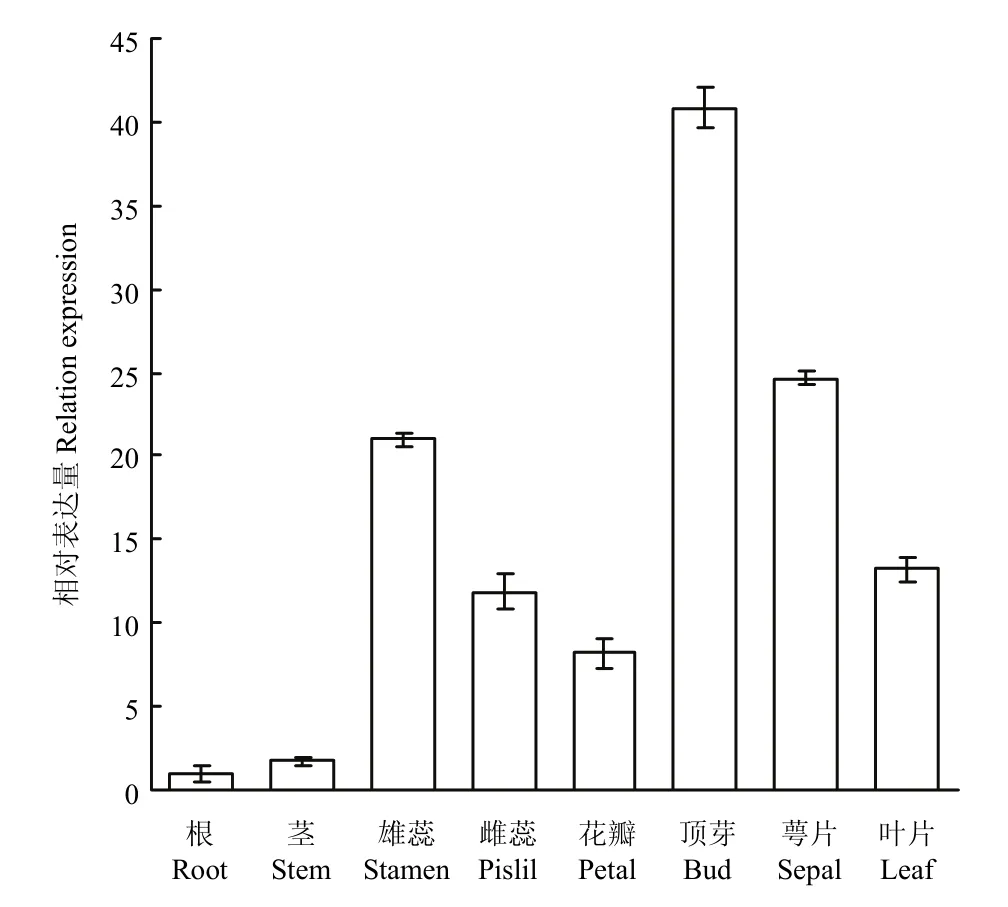
图5 GhWRKY33组织特异性表达分析Fig. 5 Tissue specific expression analysis of GhWRKY33

图6 不同处理下GhWRKY33的表达模式Fig. 6 Expression patterns of GhWRKY33 under different treatments
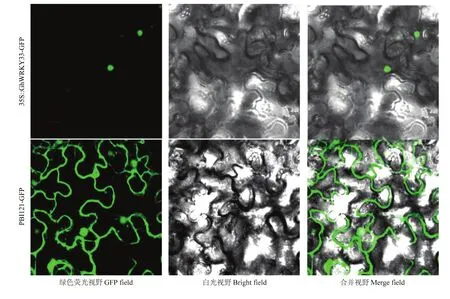
图7 35S::GhWRKY33-GFP融合蛋白的亚细胞定位Fig. 7 Subcellular localization of 35S::GhWRKY33-GFP fusion protein

图8 转基因拟南芥GhWRKY33的荧光定量表达分析Fig. 8 Quantitative expression level of GhWRKY33 gene in transgenic Arabidopsis
根据标准品的测定数据,建立脯氨酸的标准曲线(图10-A)。野生型拟南芥的吸光度为0.409,转基因拟南芥 3个株系的吸光度分别为 1.604、1.362和1.411,根据标准曲线得到野生型和3个转基因拟南芥株系的脯氨酸含量分别为3.843和26.875、22.062和22.997 μg·mL-1(图9-B),表明转基因株系的脯氨酸含量在干旱胁迫后极显著高于野生型。
丙二醛的测定结果表明,野生型拟南芥丙二醛含量为29.885 nmol·g-1,3个转基因株系中丙二醛含量为8.813、10.329 和 6.997 nmol·g-1,均极显著低于野生型(图11)。
2.7 GhWRKY33影响与干旱响应相关的基因表达
为了进一步研究GhWRKY33在干旱胁迫信号通路中的作用,鉴定了野生型和转基因拟南芥在PEG处理前后干旱响应基因AtRD29A、AtCOR15A、AtP5CS与GhWRKY33的表达水平(图 12)。结果显示,正常生长条件下,野生型与转基因拟南芥中,AtRD29A、AtCOR15A和AtP5CS的表达水平没有明显差异,但在20%的PEG6000处理后,这些基因在转基因拟南芥中的表达量均极显著提高,表明植株受到干旱胁迫后,通过诱导GhWRKY33上调表达,进而正向调控干旱响应相关基因的表达,最终提高了转基因植株的抗旱性水平。
3 讨论

图9 PEG6000处理12 h野生型与转基因拟南芥生长状态Fig. 9 Growth of wild-type and transgenic Arabidopsis thaliana treated with PEG6000 for 12 h

图10 野生型与转基因拟南芥干旱处理12 h脯氨酸含量Fig. 10 Proline contents of wild-type and transgenic lines under drought treatment for 12 h
本研究从陆地棉中克隆了GhWRKY33,序列分析发现目的基因包含1 533 bp的开放阅读框,编码510个氨基酸残基,与其他WRKY蛋白序列比对发现该基因有2个WRKYGQK保守结构域,锌指蛋白为C2H2型,证明该基因属于第一类WRKY转录因子。在GhWRKY33中亲水蛋白占很大比重,使得该蛋白具有较强的亲水性,这种亲水性能够保持细胞的水分含量,也可以防止与其他蛋白脱水或凝聚[22]。在二级结构预测中,GhWRKY33蛋白中存在的 α-螺旋,该结构的存在保障蛋白的柔韧性和流动性,在一定逆境下会发生结构变异[23],在受到干旱脱水影响时在一定程度上可以降低细胞所受伤害,这些蛋白结构的特性为该基因的抗旱性研究提供了一定的结构基础,亚细胞定位结果表明基因表达产物在细胞核内行使功能。通过对GhWRKY33的启动子区域的顺式元件分析,发现存在与干旱响应相关的MYB结合位点,并且在干旱处理下该基因的表达模式分析,证明其参与干旱胁迫相关的生物过程。
许多研究证明,WRKY转录因子受到外源激素的影响。陆地棉GhWRKY41可以通过ABA信号通路来调节植物的气孔关闭以及调节 ROS的表达水平响应干旱和盐胁迫反应[13];GhWRKY17被 ABA、H2O2、盐和干旱所诱导,在烟草中过量表达显著减低植株的耐盐性和耐旱性,证明了其通过 ABA信号转导,调节植物中ROS的含量进而调控对盐和干旱的反应[24];烟草中,TaWRKY1依赖ABA途径调节气孔活动,保证水分的含量来抵御干旱,ABA受体基因NtPYL8在该信号通路中的传导作用至关重要[25];菊花中过表达CmWRKY1,与野生型相比,增加了植株对聚乙二醇的耐受性,并且初步证明是通过 ABA信号通路响应干旱诱导[26];GmWRKY20在转基因拟南芥中增加了对ABA的敏感性,进而提高了对干旱胁迫的耐受性[27]。本研究分析了GhWRKY33在受到乙烯、茉莉酸和脱落酸诱导后的表达模式,结果表明,基因的表达量都呈现出显著的上调,推测该基因可能参与茉莉酸、乙烯以及脱落酸信号传导途径,进而参与调控植物的抗逆反应。

图11 野生型与转基因拟南芥干旱处理12 h丙二醛含量比较Fig. 11 MDA content of wild-type and transgenic lines under drought treatment for 12 h

图12 野生型与转基因株系中干旱胁迫相关基因的表达Fig. 12 Expression analyses of the genes related to drought stress in the wild-type and transgenic lines
前人研究表明,1-吡咯啉-5-羧酸合成酶(P5CS)是参与脯氨酸合成的关键酶,而脯氨酸可以稳定原生质体胶体中的代谢过程并防止细胞脱水,通过增强P5CS的酶活性进而增加脯氨酸的生物合成,提高植物的抗逆性[28-29]。RD29A编码亲水蛋白,可以被ABA、干旱等胁迫诱导表达[30]。COR15A是干旱胁迫中的标志基因,通过ABA信号诱导参与干旱胁迫响应[31]。为了进一步了解GhWRKY33调控机制,本研究检测了干旱响应基因AtP5CS(AT2G39800)、AtRD29A(AT5G52310)、AtCOR15A(AT2G42540)在20%PEG6000处理前后的表达水平。发现这些基因在转基因拟南芥中的表达较野生型显著升高,因此,推测GhWRKY33通过 ABA信号通路正向调控AtRD29A、AtCOR15A和AtP5CS的表达,从而提高了转基因拟南芥的抗旱性水平。关于GhWRKY33在棉花中的抗旱分子机制今后还需要进一步深入研究。
4 结论
从陆地棉中克隆获得GhWRKY33,属于典型的第Ⅰ类 WRKY转录因子,其编码蛋白属于亲水蛋白;在顶芽中表达量最高,具有明显的组织表达特异性;GhWRKY33定位于细胞核;该基因响应干旱、乙烯、茉莉酸、脱落酸等的诱导。推测GhWRKY33作为正调控因子通过ABA信号通路调控拟南芥的抗旱性。

