6-羟基染料木素和6,8-二羟基染料木素的简便合成
邵 瑾, 杨 颖, 何 蕾, 马慧萍, 贾正平, 景临林*
(1. 兰州大学 药学院,甘肃 兰州 730000; 2. 联勤保障部队第九四〇医院 药剂科,甘肃 兰州 730050)
异黄酮是一大类天然产物,广泛存在于豆科(Leguminosae)植物中[1]。据报道,异黄酮类化合物具有降血糖[2],抗氧化[3],抗肿瘤[4-5],抗炎[6],保护心血管[7]等多种生物学特性,在预防和治疗常见疾病方面起着重要作用。染料木素是大豆中最丰富的异黄酮,已有研究发现其对糖尿病[8],癌症治疗[9],认知功能[10],心血管[11]和骨骼健康[12]具有潜在的益处。
异黄酮分子结构中的酚羟基是主要活性基团,增加酚羟基的数量能够提高其抗氧化活性。6-羟基染料木素(6-hydroxygenistein,2b)和6,8-二羟基染料木素(6,8-dihydroxygenistein,3b)(Scheme 1)是结构上相似的多羟基异黄酮,它们之间的差异是羟基的数量,有学者[13]已经报道了2b的合成路线。因多羟基异黄酮在自然界的含量并不丰富,提取分离相对较难,并且当前对异黄酮结构的羟基化修饰较少。因此,采用化学合成的方法制备更简便和生物活性更强的多羟基异黄酮是十分重要的。
在前期研究[14]的基础上,以价廉易得的鹰嘴豆芽素A为原料,首先通过溴代反应得到6,8-二溴鹰嘴豆芽素A(1),再通过甲氧基化反应一次得到了6-甲氧基鹰嘴豆芽素A(2a)和6,8-二甲氧基鹰嘴豆芽素A(3a),最后去甲基化反应得到了6-羟基染料木素(2b)和6,8-二羟基染料木素(3b),其结构经1H NMR,13C NMR, IR和HR-MS(ESI)表征。
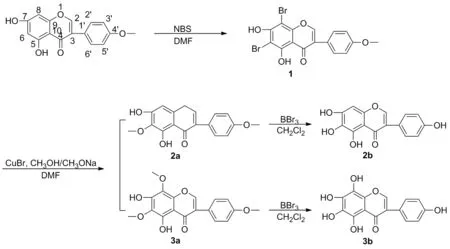
Scheme 1
1 实验部分
1.1 仪器与试剂
X-4B型显微熔点仪;Avance III HD 400 型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);ALPHA型红外光谱仪(KBr压片);Bruker micrOTOF-QⅡ型质谱仪。
鹰嘴豆芽素A(含量>98%,陕西慈缘生物技术有限公司);其余所用试剂均为分析纯。
1.2 合成
(1)1的合成
将鹰嘴豆芽素A 2.82 g(10 mmol)溶于DMF(50 mL),搅拌下加入NBS 3.92 g(22 mmol),室温反应1 h(TLC检测)。加入200 mL盐酸(2 mol/L)淬灭反应,过滤,滤饼用水洗至中性,干燥得淡黄色固体1,产率85%, m.p.234.7~235.6 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 8.62(s, 1H, 7-OH), 7.96(s, 1H, 2-H), 7.53~7.51(d,J= 8.8 Hz, 2H, 2′,6′-H), 7.02~7.00(d,J=8.8 Hz, 2H, 3′, 5′-H), 3.79(s, 3H, OCH3);13C NMR(DMSO-d6, 101 MHz)δ: 180.33(C4), 162.76(C5), 159.85(C7), 157.96(C4′), 155.43(C9), 153.00(C2), 130.69(C2′, C6′), 122.69(C1′), 122.63(C3), 114.23(C3′, C5′), 106.12(C10), 95.01(C6), 88.42(C8), 55.66(OCH3); IRv: 3447, 2925, 2843, 1645, 1614, 1584, 1517, 1374, 1281, 1261, 1178, 1028, 825, 689 cm-1; HR-MS(ESI)m/z: Calcd for C16H11O5Br2{[M+H]+}440.8968, found 440.8956。
(2)2a和3a的合成
将CuBr 0.7 g(5 mmol)溶于DMF(15 mL),室温搅拌 30 min后,加入25%甲醇钠/甲醇溶液(50 mL),继续搅拌1 h得亮蓝色悬浮液。将11.80 g(5 mmol)溶解于DMF(25 mL),升温至120 ℃后将上述亮蓝色悬浮液加至反应体系中,回流4 h(TLC检测)。冷却至室温,倾至2 mol/L盐酸(500 mL)中,减压除去溶剂,水相用乙酸乙酯(3×50 mL)萃取,合并有机相,用50 mL饱和NaCl洗涤一次,无水Na2SO4干燥,过滤,减压浓缩,剩余物经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=3/1]纯化得2a和3a。
2a: 白色固体,收率21%, m.p.189.8~190.4 ℃[15];1H NMR(CDCl3, 400 MHz)δ: 13.13(s, 1H, 5-OH), 7.86(s, 1H, 2-H), 7.46~7.44(d,J=8.6 Hz, 2H, 2′, 6′-H), 6.99~6.97(d,J=8.6 Hz, 2H, 3′, 5′-H), 6.56(s, 1H, 8-H), 4.03(s, 3H, OCH3), 3.84(s, 3H, OCH3);13C NMR (CDCl3, 101 MHz)δ: 181.37(C4), 159.80(C4′), 155.16(C6), 153.47(C2), 152.84(C5), 152.63(C9), 130.37(C6), 130.15(C2′, C6′), 123.10(C1′), 122.90(C3), 114.13(C3′, C5′), 106.47(C10), 93.18(C8), 60.89(OCH3), 55.38(OCH3). IRv: 3450, 2959, 2834, 1659, 1623, 1575, 1514, 1459, 1371, 1231, 1153, 1069, 812 cm-1; HR-MS(ESI)m/z: 314.1{[M+H]+}。
3a: 白色固体,收率42%, m.p.164.3~165.0 ℃ ;1H NMR(CDCl3, 400 MHz)δ: 12.81(s, 1H, 5-OH), 7.94(s, 1H, 2-H), 7.46~7.44(d,J=8.8 Hz, 2H, 2′, 6′-H), 6.99~6.97(d,J=8.8 Hz, 2H, 3′, 5′-H), 4.03(s, 3H, OCH3), 3.97(s, 3H, OCH3), 3.84(s, 3H, OCH3);13C NMR(CDCl3, 101 MHz)δ: 181.39(C4), 162.24(C4′), 159.86(C2), 152.58(C7), 148.86(C5), 146.17(C9), 130.76(C6), 130.19(C2′, C6′), 126.99(C8), 123.24(C1′), 122.75(C3), 114.14(C3′, C5′), 105.30(C10), 61.87(OCH3), 61.04(OCH3), 55.38(OCH3); IRv: 3373, 2939, 2836, 1655, 1606, 1579, 1512, 1456, 1381, 1296, 1176, 1077, 1031, 834 cm-1; HR-MS(ESI)m/z: Calcd for C18H16O7{[M+H]+}345.0969, found 345.0973。
(3)2b和3b的合成
将化合物2a313 mg(1 mmol)溶于无水CH2Cl2(10 mL),冷却至-15℃,缓慢滴加2 mL BBr3/CH2Cl2(1 mol/L)溶液,室温下反应过夜(TLC检测)。冷却至0 ℃,加入10 mL水淬灭反应,减压除去溶剂后有沉淀析出,过滤,干燥得2b,用类似方法合成3b。
2b: 淡黄色粉末固体,收率92%, m.p.267.4~277.1 ℃[16];1H NMR(DMSO-d6, 400 MHz)δ: 12.81(s, 1H, 5-OH), 10.52(s, 1H, 4′-OH), 9.57(s, 1H, 7-OH), 8.30(s, 1H, 2-H), 7.40~7.38(d,J=8.6 Hz, 2H, 2′, 6′-H), 6.84~6.82(d,J=8.6 Hz, 2H, 3′, 5′-H), 6.50(s, 1H, 8-H);13C NMR(DMSO-d6, 101 MHz)δ: 180.81(C4), 157.75(C4′), 154.31(C2), 154.01(C7), 150.50(C9), 147.85(C5), 130.64(C2′, C6′), 129.67(C6), 121.99(C1′), 121.99(C3), 115.49(C3′, C5′), 105.21(C10), 93.95(C8); IRv: 3397, 1663, 1616, 1579, 1518, 1474, 1370, 1280, 1234, 1056, 827 cm-1; HR-MS(ESI)m/z: MS(ESI)m/z: 286.1{[M+H]+}。
3b: 橘红色粉末固体,收率93%, m.p.310.7~311.3 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.32(s, 1H, 5-OH), 9.96(s, 1H, 4′-OH), 9.56(s, 1H, 7-OH), 8.87(s, 1H, 8-OH), 8.35(s, 1H, 2-H), 7.41~7.39(d,J=8.6 Hz, 2H, 2′, 6′-H), 6.84~6.82(d,J=8.0 Hz, 2H, 3′, 5′-H);13C NMR(DMSO-d6, 101 MHz)δ: 181.16(C4), 157.69(C4′), 154.18(C2), 143.96(C9), 140.46(C5), 139.83(C7), 130.70(C2′, C6′), 129.87(C8), 125.73(C6), 122.21(C1′), 121.65(C3), 115.47(C3′, C5′), 103.98(C10); IRv: 3411, 3243, 1664, 1615, 1572, 1518, 1479, 1379, 1290, 1251, 1069, 824 cm-1; HR-MS(ESI)m/z: Calcd for C18H16O7{[M+Na]+}325.0319, found 325.0303。
2 结果与讨论
2.1 FT-IR
化合物1的IR谱图中,3447 cm-1为典型羟基吸收峰,峰形相对于母体较尖锐;2925 cm-1和2843 cm-1处为甲基的伸缩振动峰;1645 cm-1为异黄酮结构中C=O的特征吸收峰;1400~1600 cm-1为苯环骨架振动吸收峰;1260 cm-1和1030 cm-1处为强C—O吸收峰;689 cm-1处出现吸收峰,说明有溴原子的引入。当其转变为化合物2a时,其680 cm-1处吸收峰消失,说明溴原子脱落。当化合物1转变为化合物2b时,2920 cm-1和2840 cm-1吸收峰消失,表明分子结构中不存在甲基,去甲基化反应完全。
2.2 1H NMR
化合物1的1H NMR谱中,低场区给出一个典型的异黄酮C-7位羟基质子信号δ8.62,一个典型的异黄酮C-2位烯氢质子信号δ7.96,两组1,4取代的苯环氢信号δ7.50(d,J=8.8 Hz, 2H),δ7.00(d,J=8.8 Hz, 2H),一个甲基信号δ3.79,结合以上信息可推测该化合物为6位和8位被取代的异黄酮类化合物,与化合物1分子结构吻合。当化合物1转变为2a时,1H NMR谱中出现了一个C-8位氢质子信号δ6.56, 两个甲基信号,说明与1相比,化合物2a中C-6位有一个甲氧基;而当化合物1转变为3a时,1H NMR谱中出现了3个甲基信号单峰,说明与1相比,化合物3a中C-6位和C-8位处各有一个甲氧基。当2a转换为2b时,在1H NMR谱中δ4.0附近的两个甲氧基质子信号消失,并且在δ12.81和10.52处各出现一个羟基质子信号的单峰;同理当3a转换为3b时,在1H NMR谱中,δ4.0附近的3个甲氧基质子信号消失,并且在δ12.81, 10.52和8.87处各出现一个羟基质子信号单峰,表明分子结构中没有甲基。
2.3 溴代反应
在常温条件下以DMF为溶剂,NBS为溴代试剂对鹰嘴豆芽素A进行溴代反应,结果表明: 此反应在均相体系中进行,条件温和,产率较高。
2.4 溴代异黄酮的甲氧基化反应
溴代异黄酮的甲氧基化反应是合成路线的关键步骤,该反应在无水DMF-CH3ONa/CH3OH-溴化亚酮体系中进行,反应温度为120 ℃,以较高产率得到了化合物2a和3a。在实验中发现,化合物1上C8位的溴原子出现了脱落,生成了2a,其可能的原因是C8位上形成的铜离子与溴原子的中间体不稳定,从而甲氧基未能进攻。
2.5 去甲基化反应
使用BBr3/CH2Cl2溶液,在-15 ℃条件下将化合物2a和3a中的甲氧基去甲基化,具有产率高和后处理简单等优点。
以价廉、易得的鹰嘴豆芽素A为原料,经过溴代、甲氧基化和去甲基化3步反应得到了6-羟基染料木素和6,8-二羟基染料木素。该合成方法操作简单,反应条件温和,且产率较高。

