植物病原丝状真菌寄生性与RGS蛋白的关系研究
祝友朋,韩长志
西南林业大学生物多样性保护学院/云南省森林灾害预警与控制重点实验室,昆明 650224
植物病原丝状真菌在实现对植物侵染的过程中,为了更好地在植物中实现定殖和扩展等过程,会分泌大量的效应分子,包括分泌蛋白以及CAZymes蛋白等,与植物中的防卫反应相关蛋白分子发生相互作用[1]。以往的研究发现,众多细胞信号转导途径参与上述过程,其中鸟嘌呤核苷酸结合蛋白信号途径所发挥的作用较大[2],主要作用为将外界信号传递到细胞内。G蛋白信号调控因子(regulators of G-protein signaling,RGS)作为该途径的负调控因子[2],其主要功能是通过促进G蛋白α亚基(Gα)偶联的GTP水解,促进Gα和Gβγ亚基的再聚合,导致G蛋白失活,使上述信号通路迅速关闭[3-4]。
研究发现众多真菌中都含有RGS蛋白,如构巢曲霉Aspergillusnidulans有5个[5],轮枝镰刀菌Fusariumverticillioides有6个,酿酒酵母SaccharomycescerevisiaeS288c有4个[6],稻瘟病菌Magnaportheoryzae有8个,新型隐球菌Cryptococcusneoformans有3个,玉米赤霉菌Gibberellazeae有7个,禾谷炭疽菌Colletotrichumgraminicola有6个[7],希金斯炭疽菌C.higginsianum有6个,引起橡胶炭疽病的胶孢炭疽菌RGS蛋白的数量有10个。另外,对胶孢炭疽菌RGS蛋白的生物学功能进行解析,发现RGS蛋白在胶孢炭疽菌的菌丝发育、产孢、次生代谢产物及色素合成,以及致病性和有性生殖调控等方面发挥着重要作用。同时,前人研究发现,相对于专性寄生性真菌而言,非专性寄生植物病原丝状真菌编码的分泌蛋白占基因组编码基因的比例较高,在CAZymes家族中糖苷水解酶家族GH和多糖裂解酶家族PL所占比例也较高[8]。然而,上述研究更多关注的是某种真菌中RGS蛋白的数量和功能,以及植物病原丝状真菌寄生性与CAZymes之间的关系,对于植物病原真菌寄生性与RGS蛋白之间关系的研究尚未见报道。本研究基于比较基因组学,对OrthoVenn2真菌数据库中49个丝状真菌开展全基因组同源基因对比分析,同时,利用SMART在线软件对所获得的蛋白序列开展保守结构域预测分析,以期明确49个真菌RGS蛋白的数量和类型,分析植物病原丝状真菌寄生性与RGS蛋白之间的关系,旨在为今后进一步解析RGS蛋白在病原真菌的生长发育与致病过程中的功能研究奠定理论基础。
1 材料与方法
1.1 真菌及其基因组数据
选择16个目共49个真菌开展研究,包括模式生物(构巢曲霉A.nidulans、酿酒酵母S.cerevisiae、粗糙脉孢霉Neurosporacrassa);植物病原菌(活体营养型:玉米丝黑穗病菌Sporisoriumreilianum、玉米黑粉菌Ustilagomaydis、松杨栅锈菌Melampsoralaricipopulina、禾本科布氏白粉菌Blumeriagraminis、小麦秆锈病菌Pucciniagraminis、叶锈菌Pucciniatriticina、花药黑粉菌Microbotryumviolaceum;半活体营养型:稻瘟菌M.oryzae、禾谷镰刀菌Fusariumgraminearum、禾谷炭疽菌C.graminicola、小麦壳针孢叶枯病菌Zymoseptoriatritici、希金斯炭疽菌C.higginsianum、藤黑镰刀菌Fusariumfujikuroi、西瓜炭疽菌Colletotrichumorbiculare、胶孢炭疽菌Colletotrichumgloeosporioides、小麦颖枯病菌Parastagonosporanodorum、圆核腔菌Pyrenophorateres、斑点小球腔菌Leptosphaeriamaculans、松穴褥盘孢菌Dothistromaseptosporum;死体营养型:核盘菌Sclerotiniasclerotiorum、灰霉菌Botrytiscinerea、大丽轮枝菌Verticilliumdahlia、尖孢镰刀菌Fusariumoxysporum、假禾谷镰刀菌Fusariumpseudograminearum、串珠镰刀菌F.verticillioides、腐皮镰刀菌Fusariumsolain、小麦全蚀病菌Gaeumannomycesgraminis、草坪斑枯病菌Magnaporthepoae);非致病菌(土曲霉Aspergillusterreus、棒曲霉Aspergillusclavatus、烟曲霉Aspergillusfumigatus、费氏曲霉Aspergillusfischeri、米曲霉Aspergillusoryzae、黄曲霉Aspergillusflavus、黑曲霉Aspergillusniger、里氏木霉Trichodermareesei、绿木霉Trichodermavirens、毕赤酵母Komagataellapastoris、解脂耶氏酵母Yarrowialipolytica、棉阿舒囊霉Ashbyagossypii、日本裂殖酵母Schizosaccharomycesjaponicus、粟酒裂殖酵母Schizosaccharomycespombe、嗜冷裂殖酵母Schizosaccharomycescryophilus、八孢裂殖酵母Schizosaccharomycesoctosporus、银耳Cryptococcusneoformans、松露Tubermelanosporum)。
1.2 真菌中RGS蛋白获得
首先,通过文献资料,收集前人关于S.cerevisiae、A.nidulans[5,9-11]、M.oryzae、C.graminicola[7]、C.higginsianum等报道的RGS蛋白登录号,并利用OrthoVenn2[12]在线软件(https://orthovenn2.bioinfotoolkits.net/task/create)对本研究中49个真菌开展全基因组直系同源基因簇对比分析;其次,利用真菌蛋白数据库,根据S.cerevisiaeS288C的4个RGS蛋白[6,13]氨基酸序列在线BLASTp比对,所有参数均选择默认值;同时,利用NCBI数据库(http://www.ncbi.nlm.nih.gov),输入“菌名 Regulators of G-protein signaling”、“菌名 RGS”检索RGS;再次,通过合并、去重,获得其他真菌所含有的RGS蛋白序列;最后,利用SMART预测上述RGS蛋白序列的保守结构域,最终明确上述真菌中的RGS蛋白序列。
1.3 系统进化树构建
对得到的RGS蛋白序列,用ClustalX进行多重比对分析,然后用MEGA 7.0.14软件采用邻近法构建系统进化树,距离计算采用p-Distance模型,重复1 000次[14]。
2 结果与分析
2.1 不同寄生性丝状真菌中RGS蛋白数量预测及对比分析
利用OrthoVenn2在线软件对49个真菌中RGS蛋白同源基因簇进行对比,共获得224条RGS蛋白相关序列,根据S.cerevisiaeS288C的RGS蛋白序列在线BLASTp比对,共发现238条序列,同时,利用NCBI数据库,进行关键词检索,共发现314条序列,对上述所获得的全部RGS蛋白序列进行合并、去重,并结合SMART保守结构域分析,最终得到229条含有RGS保守结构域的典型RGS蛋白序列。进一步对上述序列进行分析,明确不同真菌中所含有的RGS蛋白数量为3~9个,其中F.oxysporum中所含RGS蛋白最多,有9个,其次为C.graminicola,有8个;S.cerevisiae、U.maydis、P.graminis、A.niger、S.pombe等数量最少,都为3个。
按照模式生物、植物病原真菌及非致病菌3种类别进行RGS蛋白数量统计,发现植物病原真菌中存在的RGS蛋白数量较多(图1A)。为了进一步明确植物病原真菌寄生性与RGS蛋白之间的关系,将植物病原菌按照活体营养型、半活体营养型、死体营养型等寄生性类型进行分类,结果发现,死体营养型病原菌中RGS蛋白数量最多,其次为半活体营养型病原菌、模式生物,活体营养型病原菌数量最少(图1B)。

A. 模式生物、病原菌及非致病菌RGS数量对比。 B.不同营养类型病原菌RGS数量对比。A.Comparison of RGS quantities of model organisms,pathogenic fungi and non-pathogenic fungi; B.Comparison of RGS quantities of pathogens of different nutritional types.
2.2 不同寄生性真菌中RGS蛋白种类及对比分析
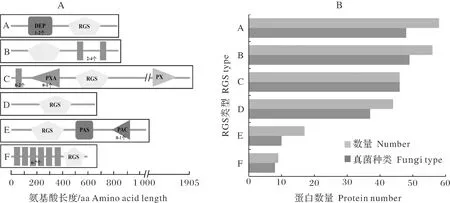
对229个RGS蛋白序列进行保守结构域预测分析,发现主要存在6种类型(图2A),其中有4种为大多数真菌所共有,分别为DEP-RGS、RGS-TM(跨膜区)、PXA-RGS-PX、RGS,数量分别为58、56、46、44个;其他2种分别为RGS-PAS-PAC(17个)、TM-RGS(8个)(图2B)。进一步分析,明确上述RGS蛋白均具有1个RGS保守结构域,其中DEP结构域用于膜靶向[15],是1个约80个残基组成的球形结构域,大多数的真菌RGS在氨基端包含2个DEP结构域,其主要功能是将含有DEP结构域的蛋白质靶向特定的亚细胞膜位点,在靶向G蛋白偶联的信号传导途径中发挥选择性作用;PX结构域,是一个约120个残基组成的结构域,发挥着多种功能,如细胞信号传导、水泡运输、蛋白质分选和脂质修饰等,能够与PXA结构域结合,作用于液泡形态分化和将蛋白定位在液泡;PAS结构域参与许多信号蛋白的传递,在其中被用作信号传感器,PAC域出现在所有已知PAS域的C末端,有助于PAS结构域折叠。
进一步分析6种类型RGS蛋白在49个真菌中的存在情况,结果显示,类型Ⅰ、Ⅱ、Ⅲ的RGS蛋白存在于多数真菌中,类型Ⅴ和Ⅵ的RGS蛋白主要集中在半活体营养型病原菌和死体营养型病原菌中。具体而言:类型Ⅰ除S.sclerotiorum外,其他48个真菌中均存在;类型Ⅱ在49个真菌中都存在,类型Ⅲ除Z.tritici、S.cerevisiae、A.niger外,其他46个真菌中都存在;类型Ⅳ除V.dahlia、S.japonicus、S.pombe、S.cryophilus、S.octosporus、M.laricipopulina、P.graminis、P.triticina、S.reilianum、U.maydis、C.neoformans、M.violaceum外,其他37个真菌中都存在;类型Ⅴ在C.graminicola、F.solain、C.higginsianum、G.graminis、C.orbiculare、M.poae、C.gloeosporioides、M.oryzae、S.sclerotiorum、B.cinerea等10个真菌中存在;类型Ⅵ在A.fumigatus、A.fischeri、T.reesei、C.graminicola、V.dahlia、C.orbiculare、C.gloeosporioides、P.nodorum等8个真菌中存在,类型Ⅴ和Ⅵ的数量和种类都较少,且集中在植物病原菌中。
2.3 遗传关系分析
对49个真菌的229条RGS蛋白序列进行遗传关系分析,结果发现,229个序列聚为6类,该结果与通过保守结构域预测结果所分类别一致。其中类型Ⅰ、Ⅵ和Ⅲ亲缘关系上较近,类型Ⅱ和Ⅳ在亲缘关系上较近,Ⅴ类单独为一支(图3)。
A. 丝状真菌中6种RGS的类别; B. 丝状真菌中6种RGS的数量。A.Categories of 6 RGS in filamentous fungi; B.Number of 6 RGS in filamentous fungi.

图3 不同真菌中RGS蛋白序列之间的遗传关系
2.4 已报道真菌中RGS蛋白数量的差异分析
对已报道真菌的RGS蛋白数量与此次发现的RGS蛋白数量进行对比分析,发现存在着一定的差异,其中S.cerevisiae、A.nidulans、F.verticillioides和M.oryzae的RGS数量减少,C.graminicola、C.higginsianum和C.gloeosporioides的RGS蛋白增多(表1)。
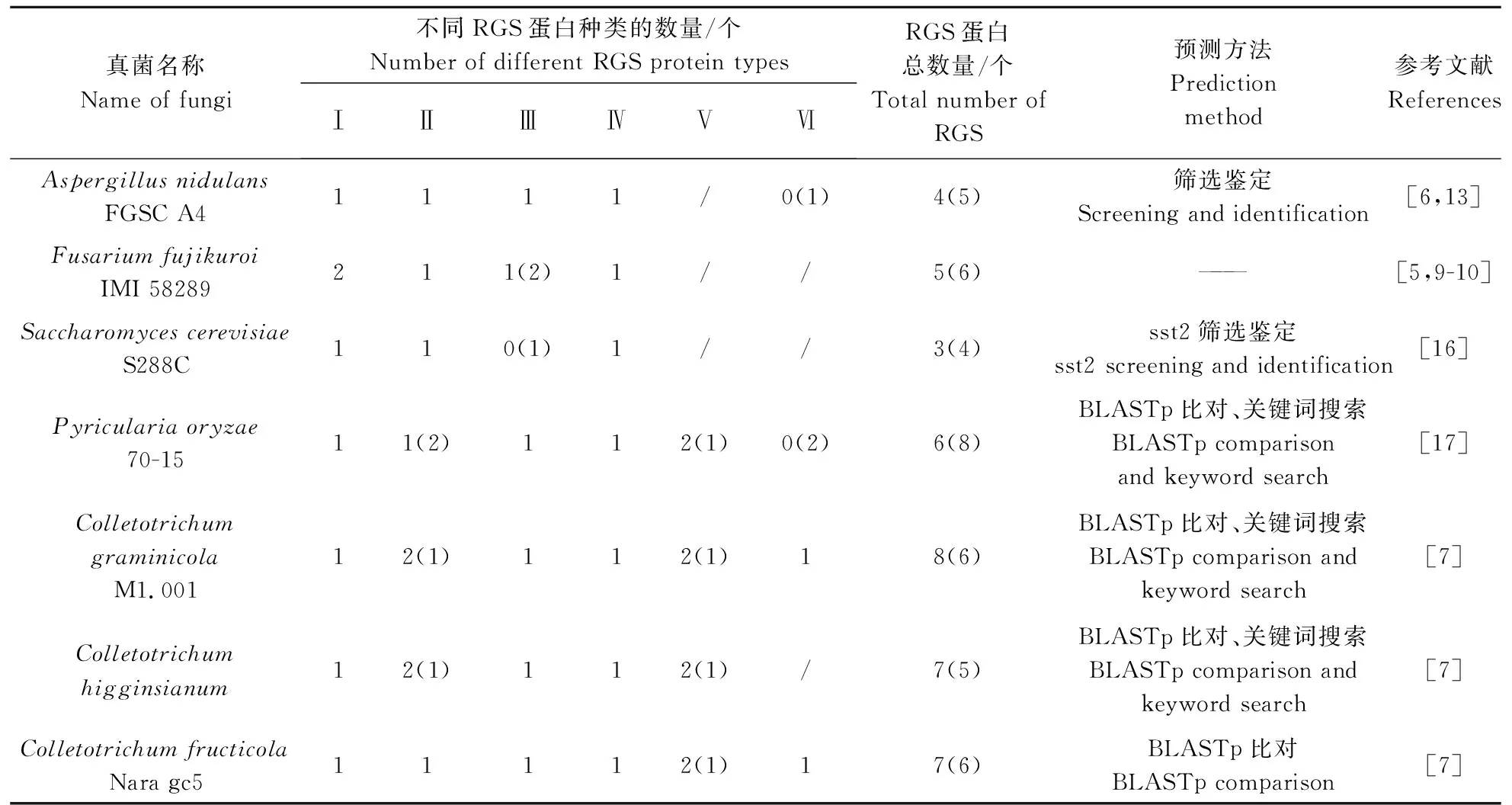
表1 真菌中RGS蛋白数量与前人研究存在差异的具体情况 Table 1 Compare with the number of RGS protein between this study and previous studies in different fungi
3 讨 论
以49个全基因组序列已经释放的真菌为研究对象,通过OrthoVenn2同源基因簇比对、BLASTp比对和关键词搜索3种方法对RGS蛋白同源基因进行比对,并结合SMART保守结构域分析,发现49个真菌所含有的典型RGS蛋白的数量为229个,其中部分真菌的RGS蛋白数量与前人报道的RGS蛋白数量存在一定的差异,其主要原因在于通过OrthoVenn2同源基因簇比对新发现其他真菌与S.cerevisiaeS288C的4个RGS蛋白氨基酸序列同源的RGS蛋白序列及其利用SMART保守结构域预测分析发现未含有RGS蛋白保守结构域的RGS-like序列。本研究保守结构域预测未发现RGS保守结构域的RGS蛋白序列有S.cerevisiae的Mdm1,A.nidulans的GprK,M.oryzae的MoRGS6、MoRGS7、MoRGS8[16],F.verticillioides的RGSC2[17]。保守结构域预测新发现RGS保守结构域的RGS蛋白序列有M.oryzae的MGG_00295,C.graminicola的GLRG_11166、GLRG_09794,C.higginsianum的CH063_13997、CH063_06702,C.gloeosporioides的CGGC5_1230。此外,F.oxysporum存在6个具有DEP-RGS保守结构域的RGS蛋白,与其他48个真菌相比,极为突出,是否与尖孢镰刀菌的生活习性及致病性相关,有待于今后进一步研究。
同时,为了进一步明确不同真菌分类单元与其所含有RGS蛋白数量和种类之间的关系,本研究组还根据49个真菌分类归属情况,开展了上述真菌分类单元与其所含有RGS蛋白数量和种类之间的关联分析,结果显示,上述真菌分属于16个目(散囊菌目、肉座菌目、小从壳目、酵母目、裂殖酵母目、锈菌目、格孢菌目、长喙壳目、黑粉菌目、核盘菌目、煤炱目、粪壳菌目、银耳目、盘菌目、白粉菌目、微球黑粉菌目),以小从壳目、长喙壳目、肉座菌目中的真菌所含有的RGS数量较多,平均分别为7、6、5.9个,在锈菌目、黑粉菌目、裂殖酵母目中的RGS数量较少,平均为3个。RGS作为真菌中一类重要的调控蛋白,对于真菌在生长发育、次生代谢产物及色素合成以及致病性和有性生殖调控等方面均发挥着重要的作用,推测具有不同数量RGS蛋白的真菌在上述功能发挥方面存在着较大的区别。传统的植物病理学根据植物病原真菌侵染植物的过程,分为活体、半活体和死体3种营养类型,其中,活体营养型病原菌主要通过吸收植物的营养成分、半活体和死体营养型病原菌则主要通过降解植物细胞壁来完成生长繁殖。然而,尚未见有关RGS蛋白与真菌营养类型之间关系的研究报道。前人研究发现,半活体和死体营养型病原菌的分泌蛋白占总基因的比例高于活体营养型病原菌,半活体和死体营养型病原菌的CAZymes的数量和占分泌蛋白组的比例显著高于活体营养型病原菌[8]。本研究对其RGS蛋白的种类和数量进行研究,明确死体营养型病原菌RGS蛋白数量高于半活体营养型病原菌,半活体营养型病原菌RGS蛋白数量高于活体营养型病原菌,且具有RGS-PAS-PAC、TM-RGS两种motif类型的RGS蛋白主要集中在半活体营养型病原菌和死体营养型病原菌。由此推断植物病原菌的CAZymes、RGS蛋白与真菌寄生性之间存在较为密切的关系。同时,前人研究发现半活体和死体营养型病原菌参与植物细胞壁降解的糖苷水解酶家族GH和多糖裂解酶家族PL均发生了显著扩增[8]。半活体和死体营养型病原菌的CAZymes数量和RGS蛋白数量均多于活体营养型病原菌。今后,对于植物病原菌中的CAZymes、RGS蛋白与真菌寄生性三者之间关系以及作用机制均有待进一步探索,同时,RGS蛋白中的PAS结构域具有参与许多信号蛋白的传递功能,其是否与真菌寄生性有着直接关系?RGS蛋白中的TM结构域在RGS结构域前面是否也与病原菌的寄生性有着直接关系,均有待于未来进一步明确。本研究为进一步解析上述真菌的RGS蛋白功能奠定了理论基础,对植物病原菌的防治具有理论指导意义。

