大鼠肠淋巴液外泌体提取及星状神经节阻滞对失血性休克后肠淋巴液外泌体数量的影响*
范泽华, 郜思齐, 杜会博, 张立民, 张红, 赵振奥, 赵自刚△, 牛春雨
·短篇论著·
大鼠肠淋巴液外泌体提取及星状神经节阻滞对失血性休克后肠淋巴液外泌体数量的影响*
范泽华1, 郜思齐1, 杜会博1, 张立民1, 张红1, 赵振奥1, 赵自刚1△, 牛春雨2△
(1河北北方学院微循环研究所/基础医学院,湖南 张家口 075000;2河北医科大学基础医学院,河北 石家庄 050017)
建立肠淋巴液外泌体分离技术,验证外泌体来源,观察星状神经节阻滞(SGB)对失血性休克后肠淋巴液(PHSML)中外泌体数量的影响。雄性大鼠随机均分为假手术(sham)组、sham+SGB组、休克(shock)组和shock+SGB组,常规方法实施SGB并建立失血性休克模型,引流PHSML,提取外泌体。应用纳米粒径分析、CD63蛋白表达检测鉴定提取物是否为外泌体;检测外泌体肠上皮细胞黏附分子(EpCAM)的蛋白表达,明确外泌体是否源于肠上皮细胞。应用流式细胞术分析外泌体数量。肠淋巴液提取的颗粒样物质直径大小在100 nm左右,同时表达外泌体的特异性蛋白CD63和肠道上皮细胞的特异性蛋白EpCAM; shock组肠淋巴液外泌体数量显著高于sham组(<0.05), shock+SGB组肠淋巴液外泌体数量显著低于shock组(<0.05)。我们建立了肠淋巴液外泌体的提取技术,证实肠淋巴液外泌体来自肠道上皮细胞, SGB可以降低大鼠失血性休克后肠淋巴液中外泌体的数量。
肠淋巴液;外泌体;失血性休克;星状神经节阻滞
失血性休克是临床常见的危重症之一,重症失血性休克是非正常死亡的原因之一[1]。失血性休克对人体的危害不仅在于有效循环血量急剧减少带来的循环衰竭,更与随后导致的多器官损伤有关。肠是休克后引发多器官损伤乃至多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的主要器官、启动器官[2],失血性休克后肠系膜淋巴液(post-hemorrhagic shock mesenteric lymph, PHSML)回流参与了失血性休克引起器官损伤的关键环节,肠淋巴途径是肠源性感染、细菌内毒素移位的基本路径[3- 4]。外泌体作为一类多种细胞分泌的多功能囊泡,可由细胞在自然状态下分泌,也可在受刺激后分泌,所以同一细胞分泌的外泌体在不同情况下包含不同的物质,且会携带原细胞的某些生化组分[5]。外泌体在PHSML介导器官损伤的发病过程中扮演什么角色,值得关注。星状神经节阻滞(stellate ganglion block, SGB)对失血性休克后的肠屏障功能具有良好的保护作用,可显著延长失血性休克动物的存活时间[6],但其是否会通过影响肠淋巴液的外泌体发挥作用,尚不清楚。为此,本研究首先建立肠淋巴液外泌体的提取技术,进而观察SGB对PHSML中外泌体数量的影响。
材料和方法
1 实验动物与分组
成年雄性Wistar大鼠24只,购买于斯贝福(北京)生物技术有限公司,实验动物许可证号为 SCXK(京)2016-0002,体重在280~320 g之间。饲养环境:温度(24±2)℃、湿度40%~60%、光照节律昼夜交替。大鼠禁食8 h(自由饮水)后,依据实验动物伦理学标准进行实验研究。大鼠随机分为假手术(sham)组、sham+SGB组、休克(shock)组和shock+SGB组。
2 方法
2.1实施SGB术按我室常规方法实施大鼠SGB术。诱导麻醉:动物称重记录后,置入小动物麻醉机(VMR型, MIDMARK)麻醉诱导盒,吸入3%异氟烷(河北一品制药有限公司)1~3 min,氧流量(1~1.5) L/min。实施SGB:俯卧位将大鼠固定在小动物手术台,继续吸入麻醉,采用后路径盲法穿刺(右侧),回抽无血后,注射0.5%盐酸罗哌卡因溶液(AstraZeneca)0.2 mL。观察效果:停止吸入麻醉,待大鼠自然苏醒后,若大鼠出现右眼睑下垂,视为SGB成功(图1);若观察不到明显的右眼睑下垂,则视为SGB术失败,大鼠被弃用。假手术组麻醉后于右侧星状神经节处注射等量生理盐水。本方法在我室技术成熟,复制SGB成功率>90%。
2.2肠淋巴液标本制备大鼠在实施SGB或假手术后,再次进行诱导麻醉,然后肌肉注射戊巴比妥钠(50 mg/kg)全身麻醉。随后,进行双侧股部手术,分离股动脉、股静脉并分别插管,连接相应管道,应用PowerLab四道生理信号采集分析系统(AD Instruments)实时监测平均动脉压(mean artery pressure, MAP)。稳定30 min待大鼠MAP平稳后,常规方法应用程控微量注射泵(NE-1000型)执行放血程序,维持低血压(40±2) mmHg 1 h后,进行液体复苏,输入放出的全血和等量林格液的混合液,30 min完成。复苏结束后,进行肠淋巴管插管,引流肠淋巴液3 h。Sham组及Sham+SGB组在与Shock组液体复苏后相对应的时间点,实施相同的手术,引流肠淋巴液0.5 h。将肠淋巴液以3 000 r/min速度离心,取上清液,用于提取外泌体和后续实验。
2.3外泌体的提取按照外泌体提取试剂盒(SBI)说明书,将获取的肠淋巴液加入外泌体提取试剂,颠倒混匀, 4℃过夜;次日使用离心机以1 500×低温离心30 min,弃上清液;再以1 500 ×离心5 min,弃上清液;取100 mL磷酸盐缓冲液(phosphate-buffered saline, PBS)重悬沉淀即可。重悬后,即刻放入-80℃低温冰箱冻存,以备后续实验使用。
2.4外泌体的鉴定
2.4.1纳米粒径分析法采用ZetaView PMX110 (Particle Metrix)进行实时高分辨率颗粒检测、计数和分级。测量前将样本用PBS稀释到3 mL,而后上机检测,重复测量3次。
2.4.2Western blot检测CD63的表达外泌体样品及SDS‐PAGE上样缓冲液(5×)按4∶1配比后,沸水浴中变性10 min,冰上冷却5 min,按测定好的蛋白浓度,算出上样量,以每孔15 μg蛋白样品进行电泳(100 V,120 min左右),湿转至PVDF膜上(300 mA,1.5 h),加5%脱脂牛奶于摇床上封闭1 h,TBST缓冲液洗膜后(10 min×3次),加入鼠源性Ⅰ抗(CD63抗体, 1∶1 000, Abcam), 4℃孵育过夜。第2天洗膜后(10 min×3次),加入山羊抗鼠Ⅱ抗稀释液(1∶4 000,武汉博士德生物工程有限公司),室温孵育1 h,洗膜后(10 min×3次),显色,扫描。
2.5外泌体的细胞来源
2.5.1流式细胞术检测外泌体来源分别取不同组的30 μL外泌体重悬液与10 μL乳胶珠(Thermo Fisher Scientific)室温孵育15 min,加入1 mL PBS稀释,摇床上轻摇2 h。离心去PBS,加入100 mmol/L甘氨酸溶液孵育30 min(阻断乳胶珠的游离结合位点);PBS洗涤,加入肠上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)抗体(Abcam) 10 μL,孵育1 h; PBS洗两遍,加异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的Ⅱ抗,室温孵育1 h,应用流式细胞仪(C6型, BD)进行检测。
2.5.2Western blot检测EpCAM的表达外泌体样品及Western blot检测实验方法同上,其中EpCAM Ⅰ抗稀释浓度为1∶500。
2.6外泌体的数量变化外泌体制样及流式检测方法同2.5.1,其中Ⅰ抗使用CD63,孵育1 h后,PBS洗2遍,加FITC标记的Ⅱ抗,室温孵育1 h,上机检测外泌体数量。由于不同样品与乳胶珠在同一环境下用同样方式处理,故认为样品中外泌体与乳胶珠结合的比例是相同的,因此,处理后样品乳胶珠表达荧光的比例越大,说明该样本中外泌体数量越多,即荧光强度与外泌体数量呈正相关。
3 统计学处理
所有数据以均数±标准差(mean±SD)表示。应用SPSS 17.0统计软件进行方差齐性检验,方差齐的多组数据比较用单因素方差分析。以<0.05为差异有统计学意义。
结果
1 肠淋巴液外泌体的鉴定
纳米粒径分析法显示所提取样本中的颗粒样物质的直径大小在100 nm左右,属外泌体大小范围,且该范围内粒子量占总粒子量的98%以上(图2A)。采用Western blot技术对肠淋巴液提取物进行检测,发现提取物表达外泌体的特异性抗体CD63(图2B)。这些结果证明本实验肠淋巴液提取的物质为外泌体,说明本实验提取肠淋巴液外泌体的技术是成功的,可用于后续的实验分析。
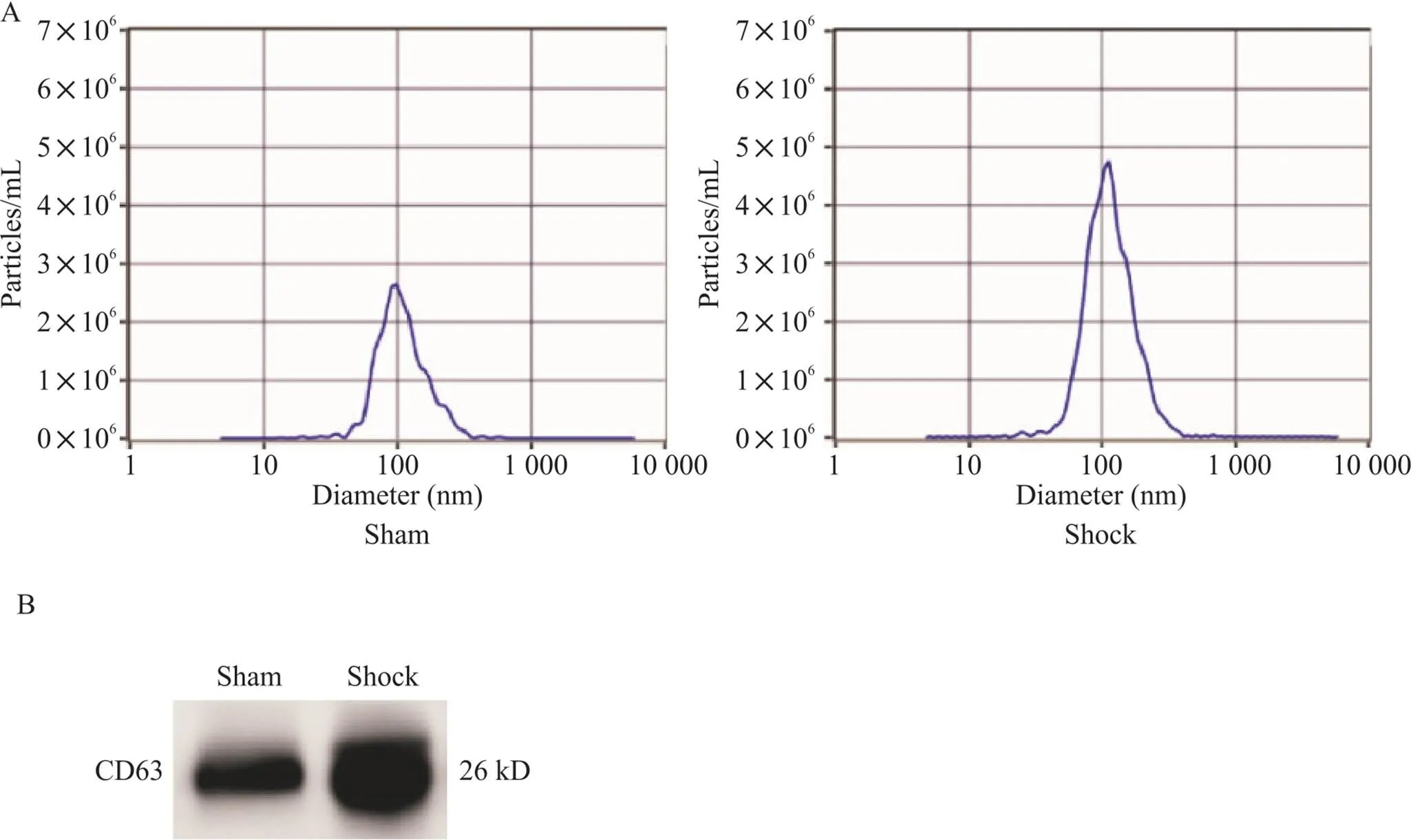
Figure 2. The extracted substances in mesenteric lymph were examined from different angles and proved to be exosomes. A: the ZetaView device was used to analyze the size distribution of isolated exosomes in mesenteric lymph; B: exosomal specific protein CD63 expression was detected by western blot in extracted substances in mesenteric lymph.
2 肠淋巴液外泌体细胞来源分析
流式细胞术检测到各组肠淋巴液提取的外泌体均高度表达EpCAM蛋白(图3A), Western blot结果亦显示各组样本均表达EpCAM蛋白(图3B)。这些结果表明肠淋巴液中外泌体来源为肠上皮细胞。

Figure 3. Identification of exosomes in mesenteric lymph with the expression of EpCAM. A: representative images of EpCAM expression in exosomes obtained from mesenteric lymph by flow cytometry; B: representative images of EpCAM expression in exosomes obtained from mesenteric lymph by Western blot.
3 SGB对PHSML外泌体数量的影响
流式细胞术结果显示, sham组和sham+SGB组大鼠肠淋巴液外泌体的数量没有明显差异, shock组大鼠肠淋巴液外泌体数量有明显升高(<0.05), shock+SGB组大鼠肠淋巴液外泌体较Shock组明显减少(<0.05),见图4。这一结果表明SGB减少了PHSML中外泌体的含量。
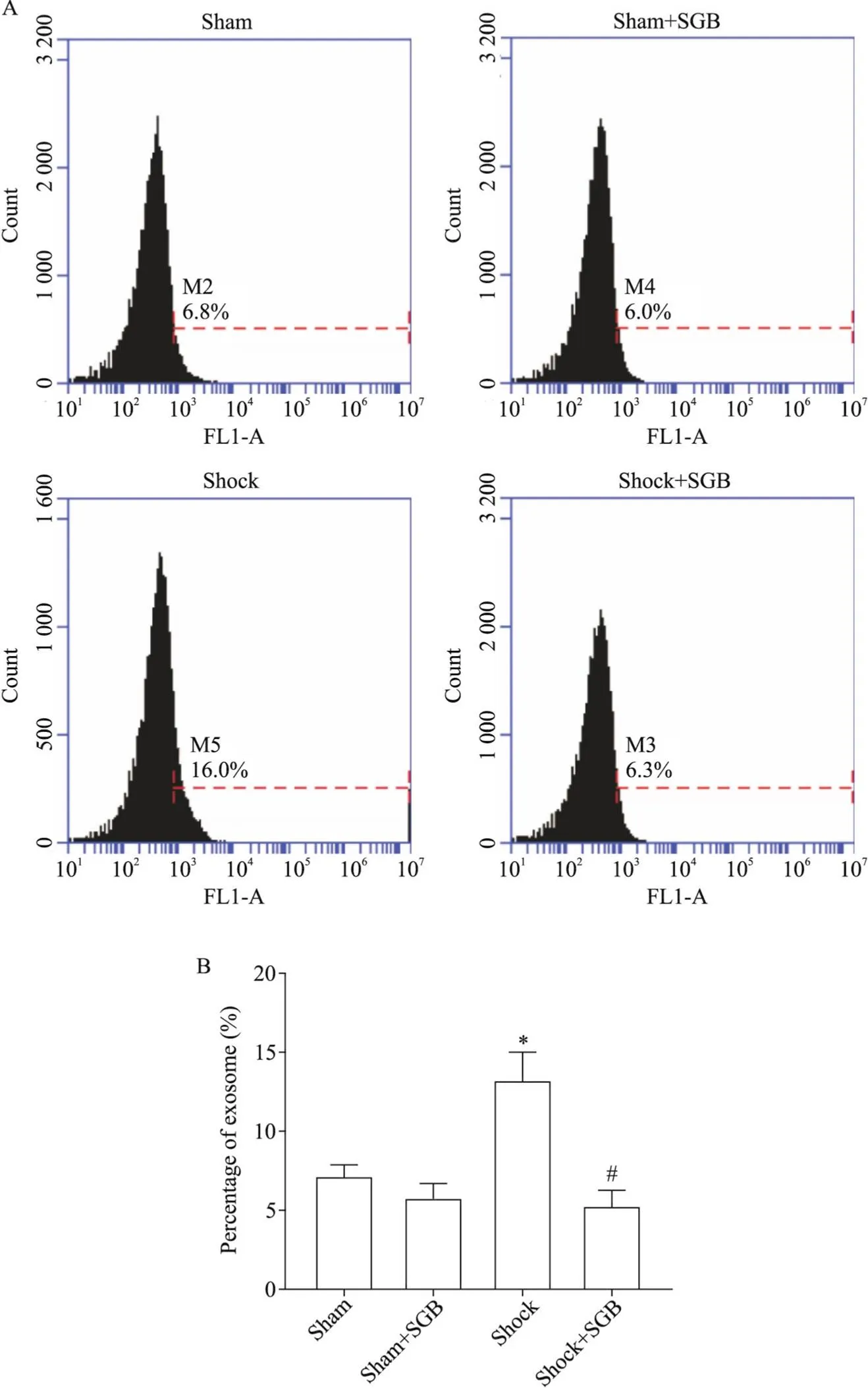
Figure 4. SGB decreased the number of exosomes in mesenteric lymph obtained from hemorrhagic shocked rats. A: representative images of number of exosomes obtained from mesenteric lymph by flow cytometry; B: the changes of exosomes number in mesenteric lymph. Mean ±SD. n=4. *P<0.05 vs sham group; #P<0.05 vs shock group.
讨论
目前,外泌体经常用的提取方法有超速离心法、密度梯度离心法、超滤离心法、磁珠免疫法和PEG-base沉淀法和试剂盒提取法等。其中,超速离心法杂质比较多,纯度不高,且重复离心操作可能对外泌体造成损伤[7-8];密度梯度离心法步骤繁琐耗时,易有人为干扰因素;磁珠免疫法效率较低,易影响外泌体活性,不利于后续实验;PEG-base沉淀法纯度和回收率较低,杂质较多,颗粒大小不均;超滤离心法可成功分离人体脐血干细胞分泌的外泌体[9],但同样存在杂质较多的缺点,导致外泌体纯度受影响[10]。相比之下,试剂盒提取法较超滤离心法而言更方便、快速、操作性强,针对性强,对外泌体内容物影响小[11],所以本实验选用试剂盒提取法。外泌体常用鉴定方法为电子显微镜法[12],流式细胞仪法[13],动态光散射法[14]和纳米颗粒跟踪分析技术[15]。但其中动态光散射法不适合粒径分布较宽的外泌体样本的测量,只适合尺寸均一的外泌体测量,并且无法测量样品中外泌体的浓度。所以本实验选择纳米颗粒跟踪分析技术联合流式细胞术对肠淋巴液提取的外泌体进行鉴定。纳米颗粒跟踪分析技术检测结果显示,从肠淋巴液中提取物的直径大小符合外泌体特征,Western blot检测到提取物中CD63蛋白的表达,证明本研究提取的颗粒物为外泌体,为下一步的实验研究奠定了方法学基础。
外泌体的诱导与生成过程非常复杂[16]。在缺血、缺氧、能量缺乏、细胞内钙浓度增高和氧化应激等许多不良刺激因素的作用下可诱导细胞产生有害的外泌体,细胞通过释放外泌体排出有害物质来维持稳态[17],而外泌体膜可对其携带的生物活性物质起到保护作用,实现远距离输送[18],所以推测外泌体造成机体损伤可能与外泌体携带了宿主细胞的有害成分相关。本文的研究显示,肠淋巴液中外泌体的来源为肠上皮细胞,说明失血性休克后肠损伤引起了外泌体释放。而这些外泌体经过肠淋巴液回流到体循环,从而发挥对远隔器官的损伤作用。但相关证据还需要进一步探寻。
针对肠淋巴途径在创伤、休克和败血症等危重病理过程中的病理生理意义,现在已达成共识,危重状态下肠道产生的毒性成份以及肠屏障损伤引起的经肠淋巴液回流的途径,成为多器官损伤的基本发生机制[19]。众多学者也应用蛋白质组学、代谢组学和蛋白层析等多种技术研究PHSML中的差异成份,以明确PHSML引起远隔器官损伤的病理生理基础。研究表明[20- 21],PHSML中发挥损伤作用的物质成分为外泌体,是失血性休克活化单核细胞和巨噬细胞引起炎症反应失控的主要成分,也是导致多器官功能衰竭的关键;分泌到PHSML中的外泌体作为创伤休克诱导急性肺损伤的关键介质,在巨噬细胞Toll样受体4的激活进而引起炎症反应的过程中发挥关键作用;肠淋巴液内外泌体的数量在失血性休克的不同阶段会发生明显的变化。最新研究[22]发现,PHSML中外泌体携带一些独特的促炎蛋白,刺激迷走神经可防止创伤失血性休克肠系膜淋巴液外泌体蛋白有效载荷变化,揭示神经-肠轴可以通过这种机制来限制创伤失血后的全身炎症反应。
SGB作为一种常用的微创麻醉镇痛技术,可缓解持续紧张的交感神经,从而维持神经系统平衡。由于急性失血通过引起交感神经兴奋进而引起局部器官缺血、血液重新分布,在一定程度上发挥代偿作用,但过强的失血刺激或持续过长的低血压引起的持续局部器官缺血,成为这些器官缺血性损伤的启动因素。前期研究显示[6],SGB能够延长失血性休克大鼠的存活时间,改善肠黏膜屏障功能,减轻重要器官的组织损伤,但相关机制还不十分明确。在此基础上,本研究应用流式技术观察了SGB对PHSML中外泌体数量的影响,结果发现PHSML外泌体的数量显著增加,SGB发挥了显著的抑制作用。但要注意,本研究PHSML外泌体数量的研究与文献不同,主要原因是本文将休克复苏后所有肠淋巴液中外泌体提取后,再稀释至与其它淋巴液相同的体积所引起的。
总之,本研究初步建立了肠淋巴液外泌体的提取技术,验证其来源与肠上皮细胞相关,并发现SGB可以降低PHSML中外泌体的数量,这可能与SGB干预休克的作用有关。另外,SGB是否影响了PHSML中外泌体的内容物尚不清楚,且SGB影响外泌体的机制也不清楚,还有待在今后的实验中进一步观察。
[1] Biranje SS, Madiwale PV, Patankar KC, et al. Cytotoxicity and hemostatic activity of chitosan/carrageenan composite wound healing dressing for traumatic hemorrhage[J]. Carbohydrate Polymers, 2020, 239:116106
[2] Klingensmith NJ, Coopersmith CM. The gut as the motor of multiple organ dysfunction in critical illness[J]. Crit Care Clin, 2016, 32(2):203-212.
[3] Deitch EA. Gut lymph and lymphatics: a source of factors leading to organ injury and dysfunction[J]. Ann N Y Acad Sci, 2010, 1207(Suppl 1):E103-E111.
[4] Deitch EA. Gut-origin sepsis: evolution of a concept[J]. Surgeon, 2012, 10(6):350-356.
[5]武庆娟,陈恒文,高健,等. 外泌体miRNA在心血管疾病中的研究进展[J]. 中国病理生理杂志, 2020, 36(2):371-377.
Wu QJ, Chen HW, Gao J, et al. Exosome-derived miRNAs in cardiovascular diseases[J]. Chin J Pathophysiol, 2020, 36(2):371-377.
[6] Zhang J, Lin XR, Zhang YP, et al. Blockade of stellate ganglion remediates hemorrhagic shock-induced intestinal barrier dysfunction[J]. J Surg Res,2019, 244:69-76.
[7] Linares R, Tan S, Gounou C, et al. High-speed centrifugation induces aggregation of extracellular vesicles[J]. J Extracell Vesicles, 2015, 4:29509.
[8] Lobb RJ, Becker M, Wen SW, et al. Optimized exosome isolation protocol for cell culture supernatant and human plasma[J]. J Extracell Vesicles, 2015, 4:27031.
[9] Zhang B, Shen L, Shi H, et al. Exosomes from human umbilical cord mesenchymal stem cells: identification, purification, and biological characteristics[J]. Stem Cells Int, 2016,2016:1929536.
[10] Batrakova EV, Kim MS. Using exosomes, naturally-equipped nanocarriers, for drug delivery[J]. J Control Release, 2015, 219:396-405.
[11] 杨季,蒋雯,李军. ExoQuick法提取人血清外泌体的临床价值[J]. 检验医学与临床, 2019, 16(15):2182-2184.
Yang J, Jiang W, Li J. Clinical value of ExoQuick for extracting human serum exosomes[J].Lab Med Clin, 2019, 16(15):2182-2184.
[12] 阮安民,陈谱,周俊,等. 聚乙二醇沉淀法提取关节液来源外泌体实验研究[J]. 中国中医骨伤科杂志, 2020, 28(3):1-4.
Ruan AM, Chen P, Zhou J, et al. Extraction and identification ofexosomes derived fromjoint effusion based on PEGprecipitation method[J].Chin J Tradit Med Traumatol Orthop, 2020, 28(3): 1-4.
[13] Kojima M, Costantini TW, Eliceiri BP, et al. Gut epithelial cell-derived exosomes trigger posttrauma immune dysfunction[J]. J Trauma Acute Care Surg, 2018, 84(2): 257-264.
[14] 高方园,焦丰龙,张养军,等. 外泌体分离技术及其临床应用研究进展[J].色谱, 2019, 37(10): 1071-1083.
Gao FY, Jiao FL, Zhang YJ, et al. Advances in separation techniques for exosomes and their clinical applications[J].Chin J Chrom, 2019, 37(10): 1071-1083.
[15] Logozzi M, Mizzoni D, Bocca B, et al. Human primary macrophages scavenge AuNPs and eliminate it through exosomes. A natural shuttling for nanomaterials[J]. Eur J Pharm Biopharm, 2019, 137: 23-26.
[16] Chiaruttini N, Redondo-Morata L, Colom A, et al. Relaxation of loaded ESCRT-III spiral springs drives membrane deformation[J]. Cell, 2015, 163(4): 866-879.
[17] Takahashi A, Okada R, Nagao K, et al. Exosomes maintain cellular homeostasis by excreting harmful DNA from cells[J]. Nat Commun, 2017, 8: 15287.
[18] Schneider A, Simons M. Exosomes: vesicular carriers for intercellular communication in neurodegenerative disorders[J]. Cell Tissue Res, 2013, 352(1): 33-47.
[19] Zhu R, Ma XC. Role of metabolic changes of mucosal layer in the intestinal barrier dysfunction following trauma/hemorrhagic shock[J]. Pathol Res Pract, 2018, 214(11): 1879-1884.
[20] Kojima M, Gimenes-Junior JA, Langness S, et al. Exosomes, not protein or lipids, in mesenteric lymph activate inflammation: Unlocking the mystery of post-shock multiple organ failure[J]. J Trauma Acute Care Surg, 2017, 82(1):42-50.
[21] Kojima M, Gimenes-Junior JA, Chan TW, et al. Exosomes in postshock mesenteric lymph are key mediators of acute lung injury triggering the macrophage activation via Toll-like receptor 4[J]. FASEB J, 2018, 32(1):97-110.
[22] Williams EC, Coimbra R, Chan TW, et al. Precious cargo: modulation of the mesenteric lymph exosome payload after hemorrhagic shock[J]. J Trauma Acute Care Surg, 2019, 86(1):52-61.
Isolation of exosomes and effect of stellate ganglion block on the number of exosomes in post-hemorrhagic shock mesenteric lymph of rats
FAN Ze-hua1, GAO Si-qi1, DU Hui-bo1, ZHANG Li-min1, ZHANG Hong1, ZHAO Zhen-ao1, ZHAO Zi-gang1, NIU Chun-yu2
(1,075000,;2,050017,)
To isolate the exosomes in mesenteric lymph, verify the source of exosomes, and observe the effect of stellate ganglion block (SGB) on the number of exosomes in post-hemorrhagic shock mesenteric lymph (PHSML) of rats.Twenty-four male rats were randomly divided into sham, sham+SGB, shock, and shock+SGB groups. SGB was performed before the establishment of hemorrhagic shock model using the routine methods in our lab. The PHSML was drained for exosomes isolation. The exosomes were identified through particle size analysis and CD63 protein expression. The expression of epithelial cell adhesion molecule (EpCAM) was detected to identify whether the exosomes were derived from epithelial cell. The number of exosomes in various mesenteric lymphs was measured using the flow cytometry.The diameter of granular material extracted from mesenteric lymph was about 100 nm. The positive expression of exosomes pecific protein CD63 indicated the successful isolation of exosomes, and the EpCAM expression verified the exosomes were derived from intestinal epithelial cells. The number of exosomes in mesenteric lymph isolated from the rats of Shock group was obviously increased compared to that from the Sham group (<0.05), while the exosomes from the Shock+SGB group was markedly decreased when compared to Shock group (<0.05).The current study establishes the isolation technique of exosomes in mesenteric lymph, and proved the exosomes were derived from the intestinal epithelial cells. SGB treatment reduces the number of exosomes in PHSML.
Mesenteric lymph; Exosomes; Hemorrhagic shock; Stellate ganglion block
R364.1; R331.4
A
10.3969/j.issn.1000-4718.2020.11.022
1000-4718(2020)11-2074-07
2020-06-28
2020-07-08
国家自然科学基金资助项目(No.81770492)
牛春雨 Tel: 0311-86266215; E-mail: ncylxf@126.com;赵自刚 Tel: 0313-4029223; E-mail: zzghyl@126.com
(责任编辑:林白霜,余小慧)

