沉默HIF-1α基因对口腔鳞癌细胞凋亡及周期的影响
许亮 刘姗姗 周小芬 马胜男 朱小峰
缺氧或低氧是实体肿瘤重要的微环境特征之一,在缺氧微环境下缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)高度表达,在维持细胞氧稳态中起重要作用[1]。HIF-1是一种转录因子,它是由HIF-1α和HIF-1β组成的异二聚体。HIF-1α蛋白在常氧条件下迅速降解,并在低氧条件下稳定,而HIF-1β蛋白组成型表达。HIF-1α已被认为与葡萄糖转运,糖酵解,癌细胞增殖/存活和肿瘤微血管等多种生物代谢途径存在密切关联[2]。为进一步探讨HIF-1α对口腔鳞癌细胞的相关作用机制,本实验通过基因沉默技术,研究HIF-1α基因对口腔鳞癌细胞凋亡及周期的影响。
1 材料与方法
1.1 实验材料
人口腔鳞癌TSCCA细胞(中国科学院上海细胞生物研究所);RPMI-1640培养基、青/链双抗、胰蛋白酶、磷酸盐缓冲液(HyClone公司,美国);胎牛血清(Gibco公司,美国);缺氧诱导剂(CoCl2)、CCK-8试剂盒、Annexin V/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒(上海碧云天生物技术研究所);Bcl-2、Bax、Caspase-3、PARP、CDK1/2、cyclin A、cyclin B、p21、β-actin单克隆抗体、羊抗鼠二抗、羊抗兔二抗(Santa Cruz公司,美国);ECL化学发光试剂(Thermo公司,美国);多功能酶标仪(BioTek公司,美国);AI600化学发光成像系统(GE公司,美国);流式细胞仪(Bekman Coulter公司,美国)。
1.2 细胞培养
人口腔鳞癌TSCCA细胞接种于含10%胎牛血清,1%青/链霉素的RPMI-1640培养基,培养环境为饱和湿度,37 ℃、5%CO2培养箱中。采用100 μmol/L CoCl2处理细胞模拟缺氧环境[3]。当细胞融合度达到70%~80%时,用0.25%的胰蛋白酶将细胞消化后进行传代培养,选用对数生长期的细胞开展后续实验。
1.3 构建HIF-1α基因沉默口腔癌细胞系
取处于对数生长期的人口腔鳞癌TSCCA细胞,用胰酶-EDTA混合液消化后制成单细胞悬液接种于6 孔板中,使每孔细胞数量保持在1×104个放入37 ℃恒温细胞培养箱中培养,待细胞满度达到40%时加入浓度为5 μg/ml的聚乙烯培养液2 ml,然后放入培养箱中继续培养30 min,然后从培养箱中拿出细胞,将慢病毒感染也置于冰上缓慢溶解,根据上海吉凯基因技术公司的慢病毒感染说明书(GV115载体),向六孔板中加入1×107TU/ml浓度的病毒液量进行细胞感染;放入培养箱12 h后,吸去含病毒的培养液,换上新鲜的完全培养液,继续培养48 h;之后可通过荧光显微镜观察细胞的绿色荧光强度,此时感染成功的细胞内有绿色荧光表达,待细胞融合度达到70%进行细胞传代。然后换上含适当浓度的嘌呤霉素的新鲜完全培养液进行筛选,最终获得稳定转染的细胞株。
将细胞分为正常对照组(未处理TSCCA细胞);阴性对照组(转染无关基因序列的TSCCA细胞);基因沉默组(转染HIF-1α反义基因序列的TSCCA细胞)。
1.4 细胞存活率检测
收集处于对数生长期的TSCCA细胞,调整细胞悬液的浓度,96孔板里每孔加入100 μl细胞悬液,使3 组细胞数约为1×104个/孔。缺氧处理细胞12, 24, 48 h后,加入10 μl CCK-8,在细胞培养箱孵育4 h,用酶标仪测量吸光度(A450)值,计算细胞存活率。细胞存活率=(实验组A450值-空白调零组A450值)/(对照组A450值-空白调零组A450值)。
1.5 细胞凋亡检测
把处于对数期的TSCCA细胞以200 μl/孔接种至6 孔板,孵育12~16 h。待细胞融合度65%~75%时,3 组细胞缺氧处理24 h。加入200 μl T/E消化后,收集细胞悬液至tube管中,使用Annexin V/PI细胞凋亡检测试剂盒,根据附带的说明书检测细胞凋亡情况,利用流式细胞仪进行检测。重复3 次实验。
1.6 细胞周期
收集3 组TSCCA细胞悬液,按细胞周期检测试剂盒说明书进行操作,并用流式细胞仪对细胞周期进行检测。实验重复3 次。
1.7 Western blot检测相关蛋白表达
收集不同处理组的TSCCA细胞悬液,提取蛋白,SDS-PAGE分离,转膜,封闭(5%脱脂乳),一抗孵育过夜,二抗室温孵育2 h,加入ECL化学发光试剂显色,通过化学发光成像系统检测,内参采用β-actin。数据用Image J图像分析软件进行蛋白定量分析。
1.8 统计学分析
2 结 果
2.1 HIF-1α基因沉默口腔癌细胞系的构建
GV115载体与软件设计的HIF-1α反义序列(表 1)及无义序列经过酶切连接后,获得重组的慢病毒载体,然后用其感染TSCCA细胞。如图 1,细胞呈规则圆形,大小均匀,排列致密整齐,生长状态良好;并且绿色荧光显示感染率超过70%。接下来通过添加嘌呤霉素进行筛选,获得稳定转染细胞株后,通过Western blot检测HIF-1α蛋白表达情况。如图 2,缺氧培养24 h后,基因沉默组HIF-1α蛋白含量显著低于其他两处理组,而正常对照组和阴性对照组之间无显著性差异(P<0.05),表明稳定转染的HIF-1α基因沉默口腔癌细胞系构建成功。

表 1 HIF-α基因沉默序列
2.2 HIF-1α基因沉默对TSCCA细胞增殖的影响
通过CCK-8对缺氧处理12、24、48 h后TSCCA细胞的增殖活性进行了检测。如图3所示,随着缺氧处理时间的增加,3 组细胞的增殖活性均受到一定程度的抑制;而缺氧处理12 h后,3 组细胞的增殖抑制率未见显著性差异;当缺氧处理24 h后,基因沉默组的增殖活性受到显著抑制(P<0.05);但是缺氧处理时间达到48 h,基因沉默组的增殖抑制率超过60%,因此,后续实验采用的缺氧处理时间为24 h。
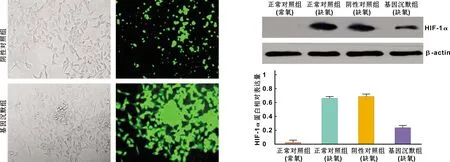
图 1 重组慢病毒转染TSCCA细胞 (×400) 图 2 沉默HIF-1α基因对TSCCA细胞HIF-1α蛋白的表达影响

图 3 沉默HIF-1α基因对缺氧TSCCA细胞增殖的影响
2.3 HIF-1α基因沉默对TSCCA细胞凋亡的影响
为探究HIF-1α基因与细胞凋亡的内在关联,通过流式细胞术对各处理组的细胞凋亡情况进行了检测。正常对照组的细胞凋亡率为17.14%±2.15%,阴性对照组为19.67%±1.88%,两者差异无统计学意义;而基因沉默组显著上升,高达53.12%±4.67%,与正常对照组和阴性对照组相比,差异有统计学意义(P<0.05)(图 4)。通过Western blot对凋亡相关蛋白的表达量进行检测。与正常对照组和阴性对照组相比,基因沉默组细胞内促凋亡蛋白Bax、Caspase-3及PARP表达量明显增加,而抗凋亡蛋白Bcl-2表达量显著下降(P<0.05)(图 5)。
2.4 HIF-1α基因沉默对TSCCA细胞周期的影响
为探讨HIF-1α基因沉默与细胞周期的相关性,通过流式细胞术对各处理组细胞周期进行检测。正常对照组和阴性对照组的细胞周期未见明显异常,而基因沉默组被阻滞在G2/M期;与两对照组相比,差异有显著性(P<0.05)(图 6)。此外,HIF-1α基因沉默组的G2/M期蛋白CDK1/2、Cyclin A、Cyclin B蛋白表达量减少,而CDK抑制因子p21增加,与正常对照组和阴性对照组相比,差异有显著性(P<0.05)(图 7)。
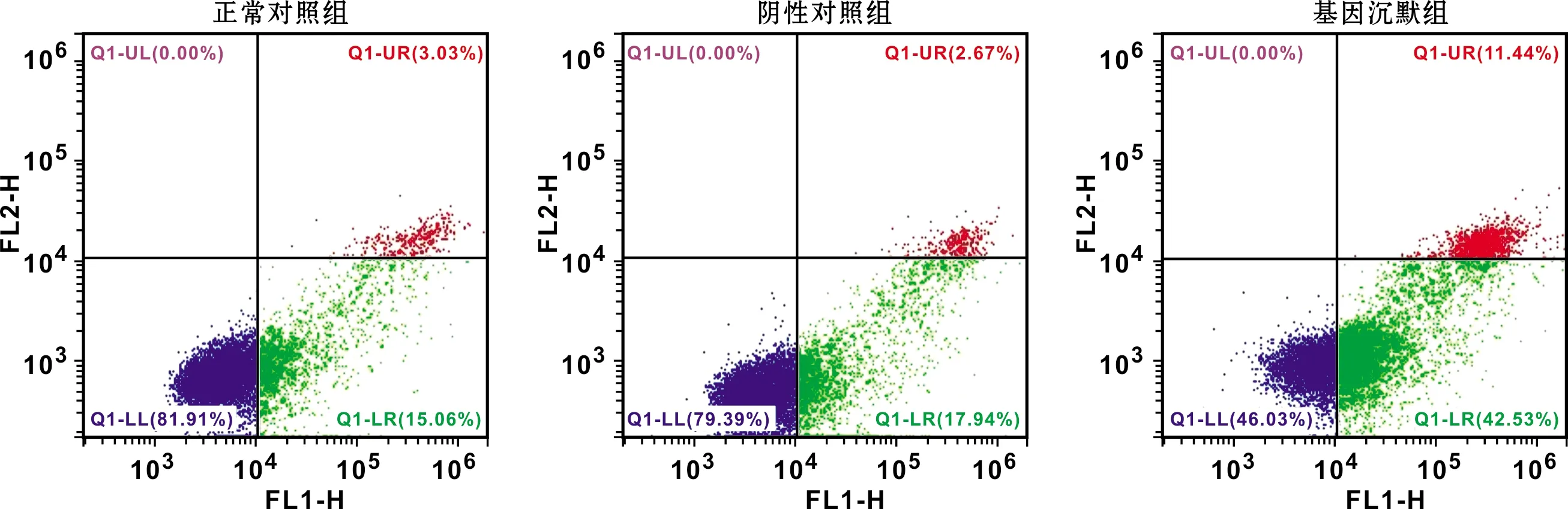
图 4 沉默HIF-1α基因对TSCCA细胞凋亡的影响

图 5 沉默HIF-1α基因对TSCCA细胞凋亡相关蛋白表达的影响
3 讨 论
口腔癌是发病于颊黏膜、上下龈、硬腭、舌和口底的恶性肿瘤,主要以鳞状细胞癌为主,全球每年新增患者超过20 万人,而我国口腔癌的发病率及死亡率也呈现逐年上升的趋势[4]。口腔鳞癌是血液供给充足的实体恶性肿瘤,由于癌细胞的过度增殖、无序性分化以及肿瘤微血管构建的延后性,导致肿瘤组织内部处于缺氧状态,因此,癌细胞通过激活缺氧诱导因子(HIF)、促红细胞生成素(EPO)、血管内皮生长因子(VEGF)等物质的生成,促使癌细胞抵抗缺氧的微环境,从而维持癌细胞正常的增殖分化,转移侵袭等生物学进程[5-7]。而HIF则是缺氧癌细胞中特异性活化的关键分子,目前已报道HIF-1α与肿瘤的生长增殖,微血管形成以及转移侵袭密切相关[8]。本研究发现,在缺氧条件下,口腔鳞癌细胞内的HIF-1α被激活,正常对照组及阴性对照组的细胞增殖没有明显差异,而HIF-1α基因被沉默后,细胞的增殖活性受到明显抑制,增殖抑制率显著高于其他两处理组;HIF-1α基因表达在缺氧应激条件下维持了癌细胞的增殖活性。

图 6 沉默HIF-1α基因对TSCCA细胞周期的影响
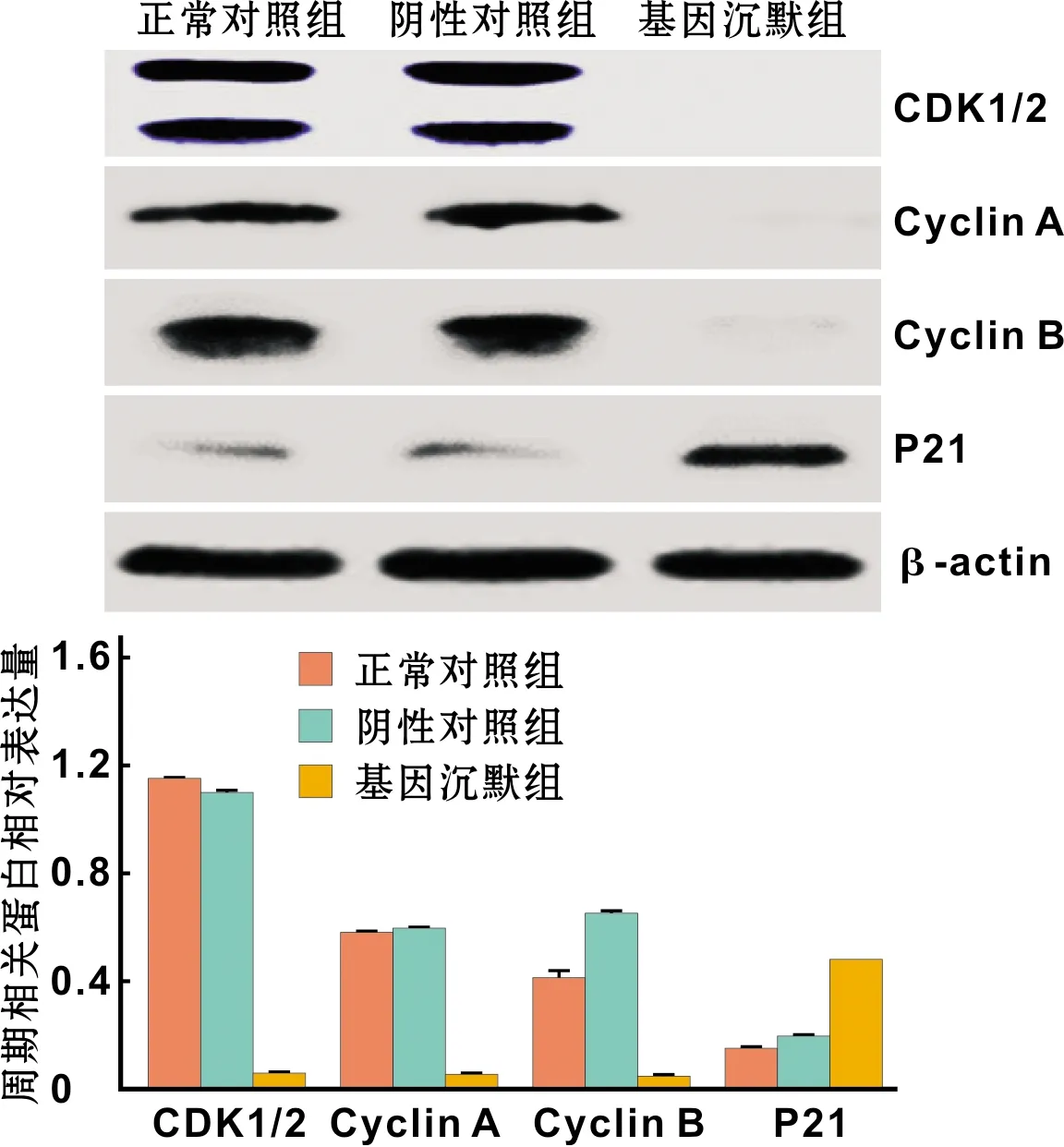
图 7 沉默HIF-1α基因对TSCCA细胞周期相关蛋白表达的影响
另一方面,机体为了清除产生的癌细胞则需要通过多种途径诱导癌细胞发生凋亡,进而控制肿瘤的进展,细胞凋亡在机体内受到一系列相关途径的调控,其中以受体和线粒体各自驱动的凋亡通路为核心[9]。线粒体途径的激活与否与外膜的通透性密切相关,当其受到某种程度的影响是,促凋亡基因将从膜间隙转运到胞质中,进而启动Caspase级联反应,导致细胞出现相应的凋亡现象,而线粒体外膜的通透程度是由Bcl-2家族内部诸多蛋白彼此调控决定的[10]。本研究发现:HIF-1α基因沉默后,导致线粒体膜上的抗凋亡蛋白Bcl-2表达量下降,促凋亡蛋白Bax表达量上升,从而使二者间的络合作用丧失,无法形成具有选择性的二聚体,线粒体膜内的Cytochrome C外渗进入细胞质,促进了Caspase-3的剪切,进一步破坏了PARP的蛋白活性,引发了Caspase级联反应,导致细胞内众多功能蛋白发生失活,进一步破坏了细胞的内稳态调节,加速了死亡的裂解死亡;因此,HIF-1α的表达与内源性线粒体依赖性凋亡存在密切联系,HIF-1α的激活,进一步抑制了口腔鳞癌细胞的凋亡,使得癌细胞对缺氧微环境产生抗性,从而维持自身的稳态。
癌症的不断增殖与癌细胞异常的周期进程密切相关,细胞周期的精密控制对生物体的分化、发育、遗传及生存活动均具有很大的影响力,可通过不同时相的相互转变使细胞进入增殖、分化或死亡等状态[11]。本实验结果表明,正常对照组及阴性对照组对人口腔鳞癌细胞不具有明显的周期阻滞作用,而HIF-1α基因沉默后,细胞周期被阻滞在G2/M期。并且,细胞周期素(Cyclin),细胞周期素依赖性激酶(Cyclin dependent kinases,CDKs)以及CDK抑制因子(CDK inhibitor,CKI)三者共同调控着细胞周期进程[12]。其中G2/M期相关的蛋白有Cyclin A/B和CDK1/2。CDK1与Cyclin B,CDK2与Cyclin A可以形成复合物,2 种复合物的产生可以使细胞越过G2期检验点,从而使细胞进入增殖分裂期。Western Blot实验结果表明,HIF-1α基因沉默后,Cyclin A/B和CDK1/2表达量下降,并且能够与CDK1/Cyclin B,CDK2/Cyclin A两种复合物结合的CDK抑制因子p21蛋白表达量升高。因此,HIF-1α基因沉默后,引起细胞周期阻滞的作用机制可能是,HIF-1α的基因沉默,导致p21蛋白的抑制作用被解除,使细胞在进入周期检验点时,p21与Cyclin B1/ CDK1复合体结合,导致细胞复合体无法发生磷酸化激活,使细胞周期阻滞在G2/M期,细胞无法进行有丝分裂,从而达到抑制口腔鳞癌细胞增殖的作用。
综上所述,缺氧条件下,沉默HIF-1α基因能够抑制口腔鳞癌细胞的增殖,促使癌细胞发生线粒体依赖性凋亡,并使癌细胞发生G2/M期周期阻滞。HIF-1α与口腔鳞癌细胞的增殖、凋亡及周期存在密切相关性,阻断HIF-1α的表达对于治疗口腔鳞癌可能具有重要的意义。

