木质素降解酶的酶活测试方法的评价与分析
崔堂武,袁波,2,凌晨,方彬任,毛向阳,费强,2
(1 西安交通大学化学工程与技术学院,陕西西安710049;2 陕西省能源化工过程强化重点实验室,陕西西安710049)
化石资源逐渐枯竭是现代工业生产与城镇化面临的重要问题,因此寻找一种能够代替化石能源的可再生清洁能源至关重要。木质素作为自然界含量最大的可再生芳香族物质[1],主要来源于农林废弃物和造纸工业废水[2]。但农林废弃物的随意堆积焚烧和造纸工业废水的肆意排放不仅污染环境,还导致木质素资源的严重浪费。松柏醇(G-lignin)、香豆醇(H-lignin)和芥子醇(S-lignin)是木质素的三种主要单体(图1),它们通过C—C、C—O 和β-O-4等共价键组合连接形成无定形的三维网状结构[3-4]。但是由于木质素分子量较大、没有规则的重复单元、分子上缺乏亲水和亲油的官能团等特点,使其具有不均匀性、无旋光性、高度分散和在水与有机溶剂中溶解度低等性质,从而导致木质素难以被有效利用[5]。木质素的高效利用可以为生物能源和大宗化学品的获取提供充足的原材料[6],因此开发对木质素合理利用的新途径和新工艺,不仅会减少对环境的影响,而且还会带来巨大的经济效益。目前在木质素的降解方法中,物理和化学法具有反应速率较快和反应高效等优点,但大多数反应依赖于高温高压或强酸强碱,反应条件极端,并且在一定程度上污染环境。生物法降解木质素具有绿色、安全、专一和可持续性等优点,但缺点是反应处理时间较长,反应强度较低。本文主要侧重于生物法的相关研究。
木质素的生物降解主要依靠微生物体内分泌的木质素降解酶完成,主要包括:漆酶(laccase,Lac)、 锰 过 氧 化 物 酶(manganese peroxidase,MnP)、木质素过氧化物酶(lignin peroxidase,LiP)、多功能过氧化物酶(versatile peroxidase,VP)和染料脱色过氧化物酶(dye-decolorizing peroxidase,DyP)。上述5种木质素降解酶可通过微生物发酵获得,主要包括发酵培养、离心分离、盐析和有机溶剂分离、凝胶、离子交换和疏水层析以及最后收集步骤。何国斌等[7]采用冻干浓缩、(NH4)2SO4盐析、Hi Trap phenyl(FF)疏水层析和Q Sepharose Fast Flow 离子交换层析对灵芝EIM-40 发酵液中的Lac进行分离纯化,纯化后的Lac 酶活为1511.5U/mg,纯化倍数为14.6 倍,回收率为5.3%。Cai 等[8]采用(NH4)2SO4盐析、DEAE-纤维素-32 柱和Sephadex G100层析柱对Rhizoctonia sp.SYBC-M3发酵液中的MnP 进行分离纯化,纯化后的MnP 酶活为328.1U/mg,纯化倍数12.6 倍,回收率为38.6%。Asgher 等[9]采用(NH4)2SO4盐析、Sephadex G100 层析柱和DEAE-纤维素柱对Trametes versicolor IBL-04发酵液中的LiP 进行分离纯化,纯化后的LiP 酶活为553U/mg,纯化倍数3.3倍,回收率为3.2%。
木质素降解酶被微生物释放到胞外后,在催化氧化过程中形成自由基进而攻击木质素。在形成许多具有高度活性的自由基中间体后,通过链式反应产生了许多其他类型的自由基,导致木质素分子中主要的化学键断裂形成小分子化合物[10]。在降解过程中,酶活是评判微生物降解木质素能力的重要指标之一,但目前文献报道的相关酶活测试方法较为多样[11],并且受到测试底物、测试条件、非酶促反应和其他物质干扰等影响,这为比较分析来源不同的木质素降解酶造成了一定的困难。为有助于生物法中酶活数据的横向比对,本文对以上5种主要的木质素降解酶的酶活测试方法进行了系统的总结分析,对比了不同测试方法的条件,讨论了每个方法的优缺点,为生物法降解木质素的相关研究提供借鉴。
1 漆酶
1.1 漆酶的来源、特性及催化机理
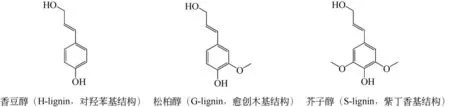
图1 木质素主要结构单体
漆酶(laccase,Lac)最早发现于漆树的分泌物中[12],是一种含铜的多酚氧化酶[13]。目前漆酶已在变色栓菌(Trametes versicolor)[14]和朱红密孔菌(Pycnoporus cinnabarinus)[15]等真菌中发现。Lac 活性中心包括4个铜离子,根据其光谱学特征可分为3 类:蓝型铜(Ⅰ型铜)、常型铜(Ⅱ型铜)和偶联双核型铜(Ⅲ型铜)[16]。铜离子所具有的氧化还原能力使Lac 能够氧化多种类型的底物,包括酚类、芳香胺类、羧酸类以及相应的衍生物。另外,还可氧化甾体激素、金属有机化合物、抗坏血酸等非酚类化合物。其中,酚类底物约占底物总量的一半[17]。Lac 可以与几类介体物质结合共同作用于紫尿酸(violuric acid)等非酚类底物[18],形成漆酶介体体系(laccase mediator systems,LMS),增强了Lac的氧化还原能力,扩大底物范围。
在Lac催化氧化反应过程中,底物被氧化生成自由基或醌类物质,氧分子被还原生成水[19]。如图2所示,Lac催化过程可分为底物作用、电子转移和中间体被还原等几个步骤[20]。首先底物被Lac氧化,然后将氧化得到的电子传递给氧形成两个水分子,而氧化后的自由基产物可能参与其他反应形成副产物或者与聚合物发生降解反应[20]。Lac具有较低的氧化还原电势(0.5~0.8V),因此只能单独作用于部分酚类底物,并发生Cα氧化和Cα—Cβ键断裂反应,而作用于非酚类底物时需要介体[21]。应用LMS后,除氧化Cα和Cα—Cβ键外,还可进行环裂解反应。但是,当2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]和1-羟基-苯并三氮唑(hydroxybenzotriazole,HBT)作为介体时有重聚合反应发生,说明木质素的生物降解过程是降解反应和重聚合反应的平衡[22]。
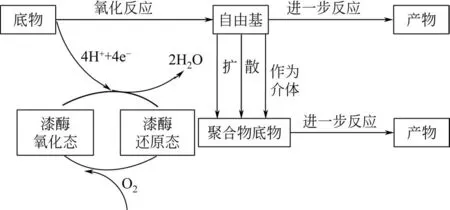
图2 Lac的催化机制[20]
1.2 漆酶酶活测试方法分析
酶活测试的底物类型是决定酶活测试所应用反应类型的关键性因素,因此本文主要根据各种木质素降解酶催化的底物类型进行分类。表1汇总了不同Lac 酶活测试方法,其中ABTS 法应用最广泛。从表1 中可知,ABTS 法常用的测试波长为420nm[消光系数ε420=36000L/(mol·cm)]左右。丁香醛连氮(syringaldazine,SGZ)作为底物时,可被氧化脱去羟基形成自由基,然后转化为粉红色的醌类化合物[30], 该 方 法 的 测 试 波 长 为 525nm[ε525=65000L/(mol·cm)]。虽然SGZ是测定Lac酶活最常用的底物,但是由于最终产物醌不溶于水,所以此方法的应用受到限制[31]。2,6-二甲氧基苯酚(2,6-dimethoxyphenol,2,6-DMP)可以作为反应底物,其在Lac的作用下被氧化生成3,5,3′,5′-四甲氧基二苯基醌(3,5,3′,5′-tetramethoxydiphenoquinone,DPQ)[32]。虽然邻联甲苯胺(3,3′-二甲基-4,4′-二氨基联苯,3,3′-dimethylbiphenyl-4,4′-diamine)也可作为底物测定Lac酶活,但此方法的相关报道较少,此法在室温下进行反应时测试波长为600nm[ε600=6340L/(mol·cm)]。此外,愈创木酚(guaiacol)和儿茶酚(邻苯二酚,catechol)作为底物时,在Lac的作用下,可分别被氧化成醛和半醌自由基[33],检测波长为可见光波长。
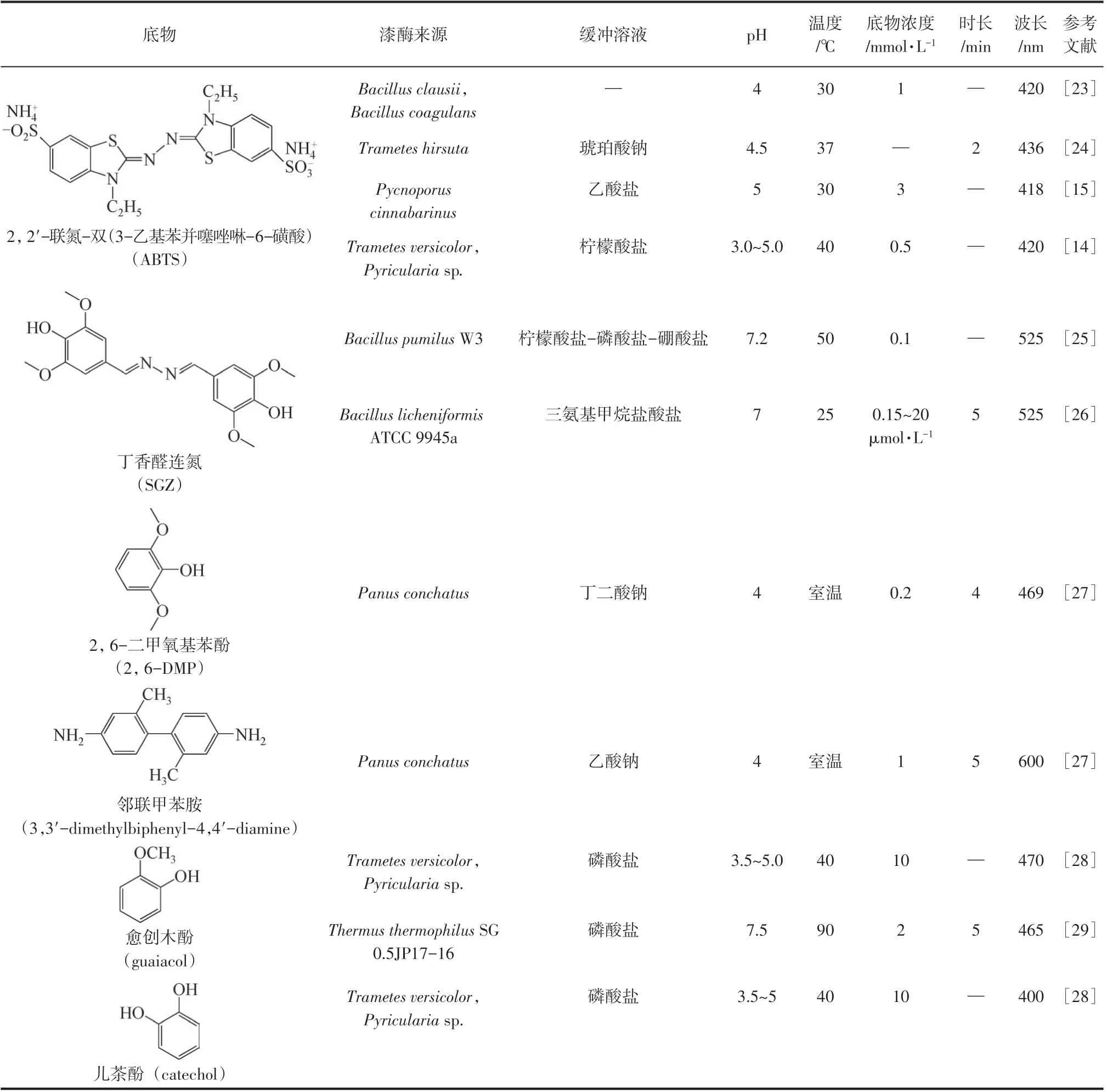
表1 Lac酶活测试方法汇总
1.3 不同漆酶酶活测试方法比较
通过分析Lac 酶活测试方法可知,2,6-DMP、愈创木酚、SGZ、邻联甲苯胺和儿茶酚等方法测定醌类产物的吸光度随时间变化曲线时,副反应的存在会导致酶活数值偏低。而利用ABTS法的催化反应只有一步,即从ABTS 生成ABTS+自由基产物,能够更加准确地反映实际酶活。此外,应用ABTS作为底物还有其他优点:①ABTS 易溶于水、性质稳定;②灵敏度较高;③ABTS 没有毒性或致癌等副作用。但是,ABTS法也常受到其他因素的影响,如ABTS+可以氧化其他分子产生副反应,以及ABTS+的吸光度在一定程度上受ABTS 浓度的影响等,上述因素都会导致酶活数值偏低。而ABTS价格昂贵、经济适用性不高,这也是该方法的不足之处。相比于ABTS 法,邻联甲苯胺属于有毒致癌物,且水溶性较差,作为底物测得的酶活力较低;愈创木酚在Lac作用下生成的产物相对稳定,但反应时间长;SGZ 的消光系数较大,有较高的灵敏度,但底物本身有刺激性,反应浓度过高时反应稳定性差。综上,ABTS 法可作为测定Lac 酶活的合适方法。
2 锰过氧化物酶
2.1 锰过氧化物酶的来源、特性及催化机理
锰过氧化物酶(manganese peroxidase,MnP)属于一种糖基化胞外过氧化物酶,首次发现于白腐真菌黄孢原毛平革菌(Phanerochaete chrysosporium)中[34],主要以含乙烯基和酚基类化合物为底物,尤其是含丁香酚基的底物[35-36]。在H2O2和有机酸存在的条件下,MnP 与有机酸进一步结合作用于底物,如愈创木酚、2,6-DMP和酚红等。
MnP的催化循环如图3所示,由于H2O2分子中氧原子具有强电负性,MnP分子中亚铁血红素上的双电子首先迁移到氧氧键上,MnP被氧化成活性氧络合四价铁卟啉联合体(MnP化合物1)[38]。然后,Mn2+失去一个电子,MnP化合物1被还原为MnP化合物2。最后,MnP 化合物2 通过单电子转移途径被还原成初始状态。但当H2O2过量时,MnP 化合物2容易被氧化失去活性[38]。

图3 MnP的催化机理示意图[37]
当Mn2+被氧化成Mn3+后,由于Mn3+也可能会与MnP结合,从而失去氧化能力,所以需要加入螯合剂生成高氧化还原电势的螯合物,进一步氧化木质素类底物。螯合剂的优点:①促进Mn3+与酶的分离;②使Mn3+更稳定;③促进游离的Mn2+与酶的结合[39]。有机酸如乳酸、酒石酸、丙二酸和草酸等是常见的螯合剂。如图4所示,Mn3+和有机酸的螯合物能与多种底物发生单电子氧化反应,例如酚类底物和芳香胺类底物被氧化脱氢后所生成的自由基产物[38]。此外,如蒽、菲和芘等芳香族有机物亦可被氧化,其中苯环可被氧化成芳香环正离子自由基[40]。脂肪酸和硫醇能被氧化脱氢生成对应的自由基产物。这些自由基产物能和氧分子反应生成过氧化物[38],从而切断木质素中键能较高的化学键。在氧化过程中,由于木质素分子较大,只能氧化边缘结构,很难渗透到分子中。但是,当利用螯合物为介体时,分子内部酚类结构也可参与反应,包括Cα—Cβ键断裂、Cα氧化和芳基-烷基C—C键断裂等反应。此外在酚类介体(如藜芦醇)和不饱和脂肪酸(如油酸或亚麻油酸)的存在下,MnP的底物范围得到扩展,包括氧化木质素分子中的非酚类结构β—O—4 键、C—C 键和β-芳基醚键等,从而生成香草醛和原儿茶酸等小分子物质[21,38]。
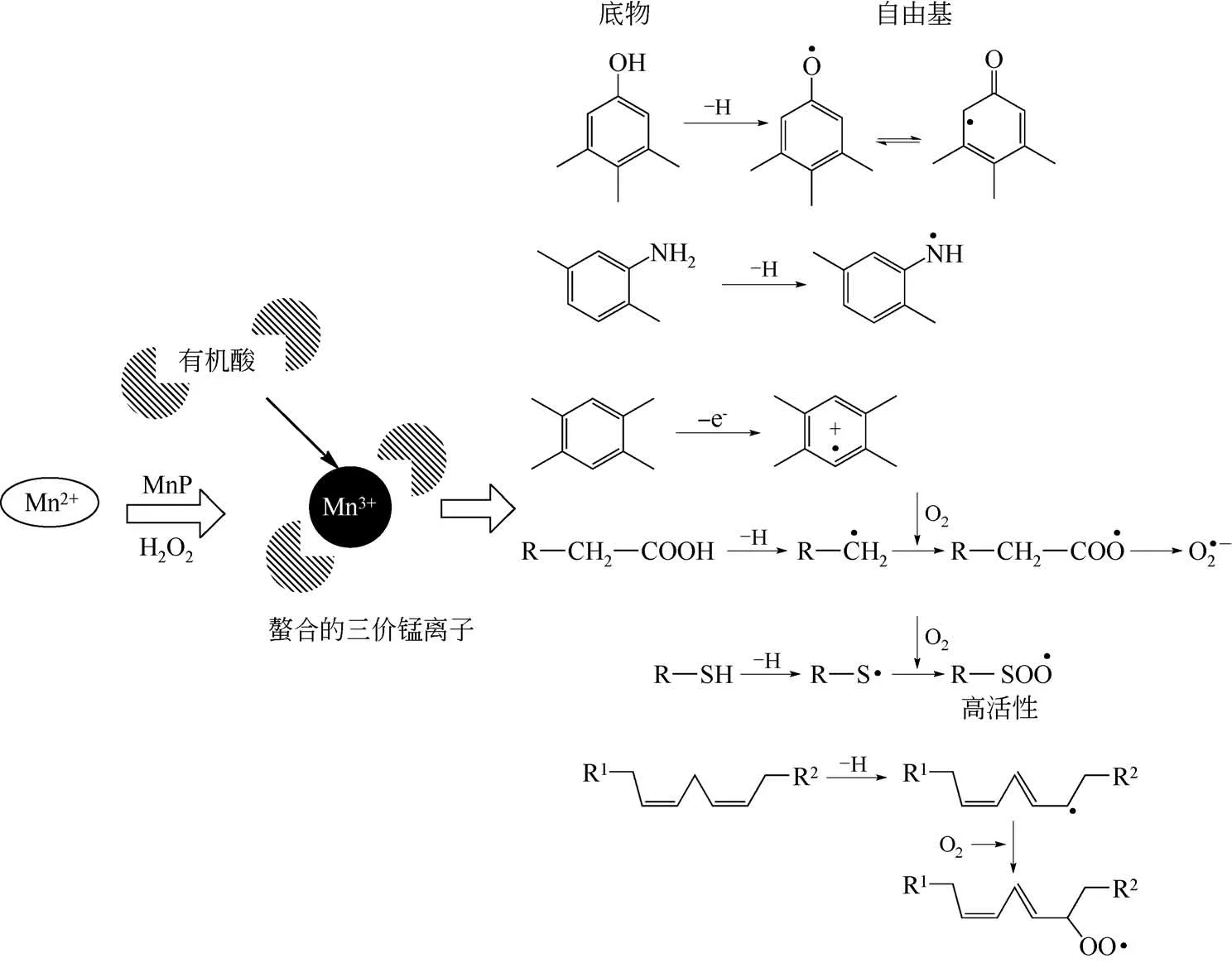
图4 MnP与不同底物的作用示意图[38]
2.2 锰过氧化物酶酶活测试方法分析
在测定MnP酶活的方法中,锰离子(Mn2+)法最为常见并被普遍使用。根据测定锰过氧化物酶酶活底物的不同进行分类,表2 汇总了不同MnP酶活测试方法。由表2 可知,当Mn2+法反应体系采用乳酸钠缓冲溶液时所用波长为240nm,而采用丙二酸钠缓冲溶液时为270nm。这主要是因为丙二酸与Mn3+形成的螯合物在270nm 处消光系数达到最大值[ε270=11590L/(mol·cm)],而乳酸钠螯合物最大值在240nm 处[ε240=6500L/(mol·cm)]。Mn3+和丙二酸形成螯合物的消光系数更大,因此其他条件不变的情况下,利用丙二酸作为缓冲液时对底物浓度变化更灵敏。所以,选择丙二酸缓冲溶液更适合Mn2+法。
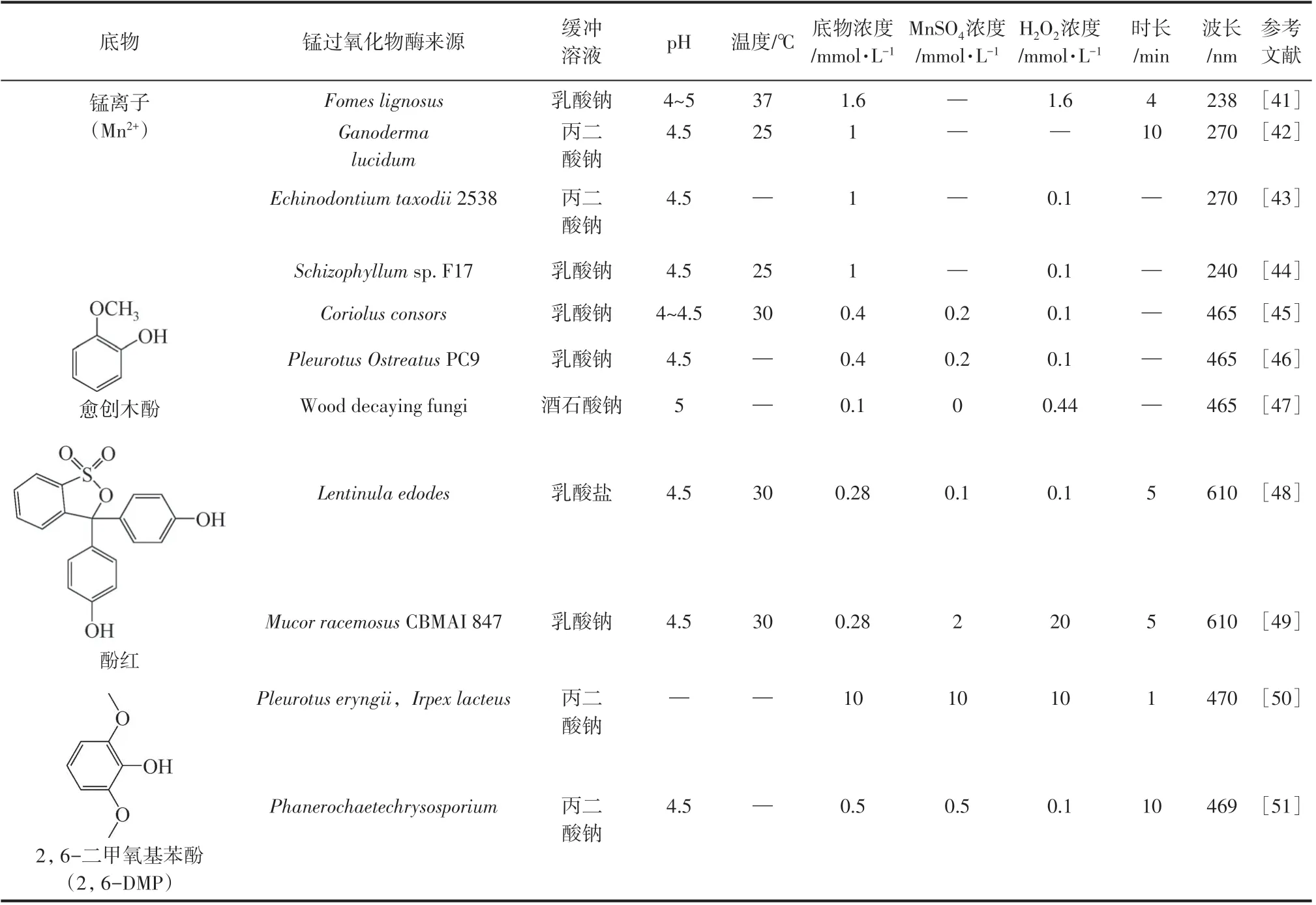
表2 MnP酶活测试方法汇总
如图5 所示,愈创木酚(C7H8O2)可以在MnP和Mn2+的共同作用下被氧化生成四邻甲氧基连酚[45]。 愈 创 木 酚 在470nm 处 的 消 光 系 数ε470=6650L/(mol·cm)[53],四邻甲氧基连酚在465nm处的消光系数ε465=12100L/(mol·cm)[46],所以在保持测定MnP活性的pH(pH=4)为最适的条件下,通过在465nm处测定产物四邻甲氧基连酚的吸光度变化计算得到的酶活数值更加精确。
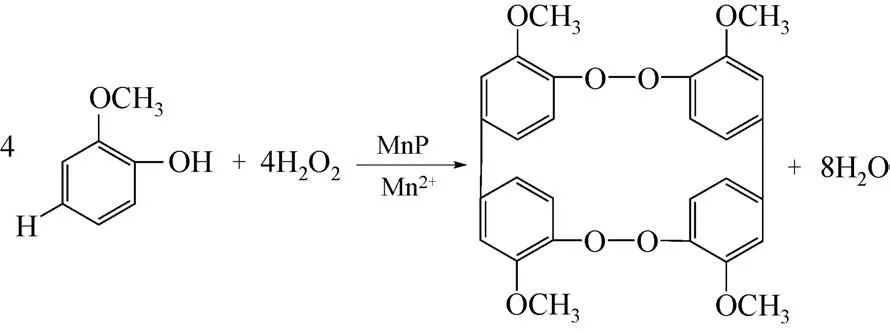
图5 MnP催化愈创木酚氧化反应[52]
MnP可以氧化多种有机染料,包括酚红、次甲基蓝和甲基橙等[54-55]。其中酚红[分子式C19H14O5S,消光系数ε610=22000L/(mol·cm)]与2,6-DMP 均可用于测定酶活[56]。如图6 所示,MnP 催化氧化2,6-DMP 时,MnP 先与H2O2作用将Mn2+氧化为Mn3+而非直接作用于2,6-DMP。随后Mn3+氧化2,6-DMP 生成醌类自由基,Mn3+被还原成Mn2+,完成一个循环。醌类中间体反应生成二聚体,其后被Mn3+氧化生成最终产物醌二聚物。此二聚物最大吸收波长位于469nm 处, 消光系数ε469=49600L/(mol·cm)。由上述机理可知,每生成1mol醌二聚物需要消耗4mol Mn3+。据报道,Mn3+可以和H2O2发生反应生成H2O、O2和Mn2+,但Mn3+更倾向与酚类底物反应,所以在此反应过程中Mn3+和2,6-DMP 的反应为主反应,而与H2O2的反应为副反应[51]。

图6 MnP催化氧化2,6-DMP机理[51]
2.3 不同锰过氧化物酶酶活测试方法比较
在上述方法中,除了Mn2+法是MnP 直接作用于底物外,其余方法都是MnP 间接作用于底物。采用Mn2+氧化法时,不同螯合物需在不同的波长下测定吸光度的变化。相比于Mn3+螯合物,酚类底物更加稳定。愈创木酚是一种木质素单体模型化合物,所以在测定MnP 活性时,采取愈创木酚作为底物更加合适。当用酚红法测试MnP活性时,反应体系中须加入明胶和NaOH,步骤较为繁琐。此外,由于2,6-DMP 法消光系数较大,反应较为灵敏,同时2,6-DMP 也是一种类木质素单体化合物,对木质素降解机理的研究有一定帮助。综上,2,6-DMP法较适用于测定MnP酶活。
3 木质素过氧化物酶
3.1 木质素过氧化物酶的来源、特性及催化机理
木质素过氧化物酶(lignin peroxidase,LiP)是一种含有亚铁血红素的过氧化物酶,可以催化包括各类多环芳香族化合物在内的多种底物[57]。目前已报道黄孢原毛平革 菌 (Phanerochaete chrysosporium)[58]、 采 绒 革 盖 菌 (Coriolus versicolor)[59]、绿色糖单孢菌(Saccharomonospora viridis)[60]和桦革褶菌(Lenzites betulina)[61]等真菌均可以分泌LiP。
如图7 所示,在催化循环过程中,LiP 为H2O2提供自由电子,自身失去两个电子被氧化为LiP Ⅰ。LiP Ⅰ再从底物得到1 个电子形成LiP Ⅱ,后者进一步被还原为LiP。在还原LiP 的同时,底物也被氧化为其他物质[62]。LiP 具有很高的氧化还原电势,通过形成木质素阳离子基团使木质素的活性提高,达到降解酚类和非酚类木质素化合物的目的。对于酚类底物可以发生Cα—Cβ键断裂和去甲基化反应;对于非酚类底物则可以发生苄基亚甲基的羟基化、苄基醇氧化反应和断裂β—O—4键[21,63]。
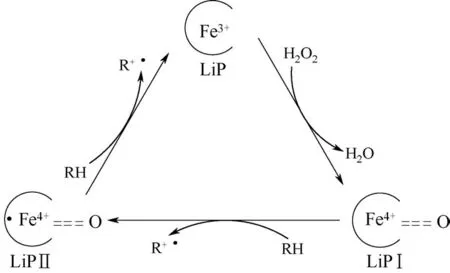
图7 LiP的催化机理[62]
3.2 不同木质素过氧化物酶酶活测试方法的分析及比较
根据测定木质素过氧化物酶酶活底物的不同进行分类,表3 汇总了测定LiP 酶活最常见的2 种方法:藜芦醇法和天青染料B 法。藜芦醇(veratryl alcohol,VA)分子式为C9H12O3,是常见的木质素单体模型化合物。在LiP 的催化作用下,VA 被氧化为藜芦醛,溶液由无色变为天蓝色,其消光系数在310nm 处最大[ε310=9300L/(mol·cm)][67-68]。天青染料B(azure B)在LiP 的催化作用下被氧化为天青B自由基,溶液由深蓝色变为无色,在651nm处达到最大吸光度[66,69]。由表3可知,藜芦醇法测LiP酶活最少可在3min 内测定,而天青B 法最少需要20min。从反应动力学分析,LiP 对藜芦醇有较小的Km和较高的Vmax,所以所需时间较短,降低了由于酶活性降低而影响准确率的可能性。然而,与310nm相比,木质素造纸废水、多酚和含醌样品中的干扰物质在651nm处的消光系数很小,因此对天青B法干扰较小。综上所述,当被测溶液中干扰物质较少或对检测效率要求较高时,藜芦醇法较适合,相反当干扰物质多且检测时间宽裕时可选用天青B法。

表3 LiP酶活测试方法汇总
4 多功能过氧化物酶
4.1 多功能过氧化物酶的来源、特性及催化机理
多功能过氧化物酶(versatile peroxidase, VP)在白腐真菌刺芹侧耳(Pleurotus eryngii)[70]、亚黑管 菌 (Bjerkandera fumosa)[71]和 亚 卧 孔 菌(Physisporinus vitreus)[72]中均有发现。VP 具有多个血红素辅基的氧化结合位点及Mn2+结合位点,其作用底物广泛,包括:①LiP 作用的底物,如藜芦醇(VA);②MnP作用的底物,如2,6-DMP和Mn2+等;③一些简单的类木质素单体酚类化合物;④不能被LiP 和MnP 直接氧化的非酚类底物,如多环芳香烃等。
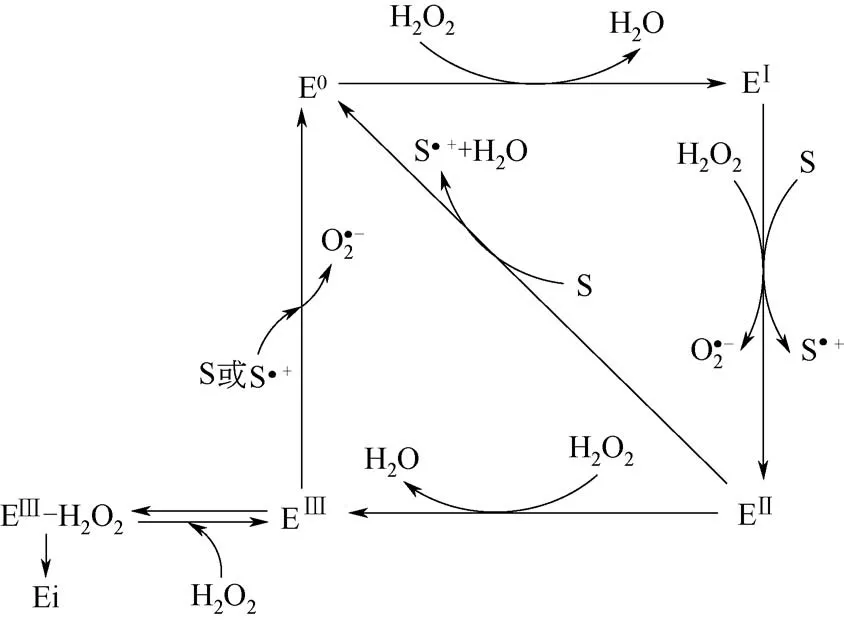
图8 VP的催化机理[73]
4.2 不同多功能过氧化物酶酶活测试方法的分析及比较
VP 结合了LiP 和MnP 的特性,能催化多种底物包括ABTS、2,6-DMP、锰离子和酚红等。根据测定多功能过氧化物酶酶活底物的不同进行分类,表4汇总了不同VP酶活测试方法。由表4可知,当采用Mn2+法测定VP 活性时,检测波长为238nm,消光系数ε238=6500L/(mol·cm)[79]。通常ABTS法底物浓度为0.1~5mmol/L,在加入H2O2后,ABTS被催化转化生成ABTS 自由基,在420nm 或者436nm 处测定ABTS自由基的吸光度随时间的变化,消光系数ε420=36000L/(mol·cm)[74]和ε436=29300L/(mol·cm)[76]。酚红法的底物浓度为0.1g/L(0.28mmol/L),检测波长610nm,消光系数ε610=22000L/(mol·cm)[78],此法相关报道较少。在上述三种方法中,ABTS 法的消光系数最大,灵敏度较高,酚红法次之,Mn2+法最小。此外,ABTS 法生成的产物更加稳定,在一定程度上可减少测试误差。综上,ABTS 法可作为测定VP酶活的合适方法。

表4 VP酶活测试方法汇总
5 染料脱色过氧化物酶
5.1 染料脱色过氧化物酶的来源、特性及催化机理
染料脱色过氧化物酶(dye-decolorizing peroxidase, DyP)能氧化多种染料如蒽醌类染料、活性蓝5 和活性蓝19 等。过氧化物酶数据库(peroxidase database)将血红素过氧化物酶分为5大家族,其中DyP 属于染料脱色过氧化物酶超家族[80]。目前,DyP 已经于链霉菌(Streptomyces avermitilis)[81]、 嗜 热 单 孢 菌 (Thermobifida fusca)[82]和 荧 光 假 单 胞 菌 (Pseudomonas fluorescens)[83]等多种微生物中发现。如图9 所示,在DyP 的催化氧化反应开始前,酶(E)和H2O2存在一个平衡状态,形成一个前体复合物E-H2O2;第二步转化为化合物Ⅰ,并且H2O2中O—O键断裂生成水,此过程不可逆。在一定的pH 范围内,化合物Ⅰ生成速率随着pH 的增加而增加。随后化合物Ⅰ与底物反应生成化合物Ⅱ和自由基产物,其反应速率与H2O2的浓度无关。最后,在化合物Ⅱ与底物反应生成E的过程中存在一个预平衡状态,即化合物Ⅱ-AH。整个反应过程的限速步骤是化合物Ⅱ-AH转化为E的过程[84]。据报道,来源于真菌的DyP比细菌DyP活性高,并能在酸性条件下催化多种底物。氧化还原介体如Mn2+和藜芦醇等会促进DyP的降解反应。DyP降解木质素过程中可发生脱羧、Cα—Cβ键和β—O—4键断裂等反应[85]。

图9 DyP催化机理图[84]
5.2 不同染料脱色过氧化物酶酶活测试方法的分析及比较
根据测定染料脱色过氧化物酶酶活底物的不同进行分类,表5总结了不同DyP酶活测试方法。其中,ABTS 法检测波长为420nm,消光系数ε420=36000L/(mol·cm)[86]。藜芦醇法检测波长为340nm或310nm,消光系数ε310=9300L/(mol·cm)[86,88]。活性蓝5(reactive blue 5,RB5)是一种用于丝绸和锦纶纤维等材料染色的常见染料,分子式是C29H17ClN7Na3O11S3。在酶作用下,RB5 转化为2,2′-二磺酰基偶氮苯、邻苯二甲酸酯和3-[(4-氨基-6-氯-1,3,5-三嗪-2-基)氨基]苯[91],检测波长为600nm,消光系数ε600=800L/(mol·cm)[92]。 活 性 蓝19 (reactive blue 19,RB19)具有较高的染色效率,所以被广泛使用于棉和麻等纤维材料的染色,其分子式为C22H16N2Na2O11S3,RB19 法 在595nm 处 的 消 光 系 数 为ε595=10000L/(mol·cm)[86]。除上述三种方法可用于测定DyP 酶活外,据报道另有愈创木酚法、2,6-DMP法、活性蓝4 法和活性红120 法等多种方法。在上述三种方法中,ABTS 法的消光系数最大,灵敏度较高,并且生成的产物比较稳定,无副反应,测量误差较小,测得的酶活数据更加准确,而RB5和RB19 法存在催化效率较低和性质不稳定等问题。综上,在对酶活测试精度及速度要求较高且经济宽裕的条件下,ABTS 法较适合于DyP 酶活的测定。

表5 DyP酶活测试方法汇总
6 结语
近年来,随着环境、能源问题的日益突出,可持续发展已成为未来社会的发展趋势[93]。其中,以生物质为代表的可再生资源,是解决能源问题的重要途径。木质素作为生物质的一大种类,是自然界中储量丰富的可再生芳香族聚合物。近年来关于木质素生物降解的研究成为热点,包括木质素的分离、有效表征和合理定向转化等研究方向。生物法可以通过多种代谢途径降解木质素,产生的高附加值产物较为多样,具有很高的实用价值和社会意义。目前木质素生物降解的应用并不多见,但在某些方面已经体现出良好前景,如用于造纸工业的生物漂白、生物脱色和废水处理,转化生成乙醇等生物燃料和环境保护及土壤修复等方面。
在木质素的生物降解过程中,木质素降解酶发挥着重要的作用。酶活可以为微生物对木质素的降解能力提供重要的参考和对比,也是木质素降解机理研究的重要工具。但是由于酶活测试方法的多样性,导致文献间数据对比困难,难以对研究结果进行横向评价与衡量。目前木质素降解酶的酶活测试存在的主要挑战有以下两方面。
(1)酶活测试底物多样化
测定同一种木质素降解酶的酶活可利用其对多种底物的生物催化反应。例如,Lac可通过催化转化ABTS、SGZ、邻联甲苯胺、愈创木酚和儿茶酚等多个底物的反应测定酶活,但是由于Lac对不同底物的亲和力和反应速率不同,因此造成测得的酶活数值难以横向比较。
(2)酶活测试条件差异较大
当选定一种底物测定酶活时,由于在测试过程中采用的条件不同也会导致酶活数值具有差异性。例如:缓冲溶液的pH、反应体系的温度和测试波长等条件会对最终酶活数值有较大影响。当采用ABTS 法测定VP 活性时,对于产物ABTS 自由基,测试波长可采用420nm或436nm,其消光系数分别为ε420=36000L/(mol·cm)和ε436=29300L/(mol·cm),导致测得的酶活数值存在差异。
本文通过比较分析为每种酶的酶活测试推荐了较适方法,若能在一定条件下使用推荐方法,则可以解决酶活测试底物多样化和条件差异大的问题。ABTS 法因反应灵敏、测试效率高、副反应少且性质稳定等优点,可作为测定Lac、VP以及DyP酶活的合适方法。若能通过优化ABTS测试所需浓度并将ABTS溶液在低温密封环境中保存,以及对木质素降解酶进行提纯,则能在一定程度上避免ABTS法存在的问题。2,6-DMP法由于测试灵敏度高且属于类木质素单体,因此适合用于MnP 酶活测定。LiP 推荐结合使用藜芦醇法和天青B 法,具体情况由被测溶液中干扰物质的量以及对检测效率的要求决定。其他方法如SGZ法、邻联甲苯胺法、愈创木酚法、儿茶酚法、Mn2+法、酚红法和活性蓝法等各具特色,可以作为木质素降解酶的酶活测试辅助方法。综上所述,本文通过系统性的分析、比较和评价主要木质素降解酶的酶活测试反应机理和测试方法,为木质素降解酶研究中存在的问题提供了解决方案,为未来生物法降解木质素的研究奠定了坚实的基础。

