蒙古族人群FTO 基因多态性与肥胖及代谢综合征的关系
张 强,李育敏
(1.内蒙古医科大学附属医院 体检中心,内蒙古 呼和浩特010050;2.内蒙古医科大学附属医院 心脏大血管外科)
随着经济水平的提高和人民生活方式的改善,肥胖症的发病率逐年上升,已成为严重危害人类健康、加重人民生活负担和阻碍社会发展的社会问题。世界上有超过10 亿成年人体重超重,近3 亿成年人被诊断为肥胖症[1]。肥胖症不仅可以引起高血压、糖尿病等代谢性疾病,还会对人的心理带来严重的影响,导致自卑、孤僻和其它一些行为障碍[2]。肥胖症是由许多因素引起的,例如环境因素和遗传因素。一些研究发现FTO 基因是参与肥胖症发病机制的关键基因之一[3~7]。
人类FTO 基因位于16 号染色体上(16q12.2),它的mRNA 主要表达于控制能量平衡的下丘脑中。因此,FTO 基因可能通过神经调节、食物相关基因和摄食行为[8~10]影响肥胖症的发生。目前,许多研究观察到FTO 基因单核苷酸多态性(SNP)与肥胖症的发生之间存在着高度的相关性[11~13]。然而,不同国家、不同民族和不同年龄人群[10]的多态性位点是不同的。在许多与肥胖症、身体质量指数和糖尿病[5,12,14,15]相关的大规模试验中,已经发现了FTO 基因rs9939609 和rs1421085 的基因型。因此,本论文选择了两个多态性位点进行研究。内蒙古呼和浩特市,作为少数民族聚居区,大量的蒙古族人和汉族人聚集生活在一起,他们的生活方式和饮食方式各不相同。蒙古族人群肥胖症的患病率较高,所以探索肥胖症的发病机制对他们则更有意义。目前,很少报道蒙古人群中FTO 等位基因的分布及其与肥胖症和代谢综合征的相关性。本研究旨在探讨蒙古族人FTO 基因与肥胖症及相关代谢综合征的关系,用以更有效地治疗蒙古族人的肥胖症。
1 研究对象
根据2003 年版“中国成人超重和肥胖症预防控制指南”的诊断标准,从2017-06~2018-06,选择了在内蒙古医科大学附属医院体检中心接受检查的1576 名蒙古族超重和肥胖症病人。经知情同意和问卷调查后,随机抽取300 名蒙古族受试者,全部受试者年龄均为 18 周岁的常住居民,且三代以内未和其他民族通婚,本地居住时间>15a。其中包括150 名男性病人和150 名女性病人,平均年龄为35.82±6.54 岁。另外200 名非超重或非肥胖蒙古族受试者作为对照组,其中包括100 名男性和100 名女性,平均年龄为36.07±6.23岁。
2 研究方法
2.1 基本资料收集
收集所有受试者的性别、年龄、病史、家族史、吸烟、饮酒、饮食和运动方面的信息。测量血压、身高、体重、腰围和臀围用以计算身体质量指数=体重(千克)/身高(平方米);腰臀比=腰围/臀围。总共收集4mL 乙二胺四乙酸(EDTA)抗凝静脉血。用葡萄糖氧化酶法测量空腹血糖。用自动生化分析仪(日本AU 600 Olympus)检测甘油三酯、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇。
2.2 DNA提取
根据血液DNA 提取试剂盒(北京天根生化科技有限公司),用300μL 抗凝血提取DNA。向血液中加入750μL 细胞裂解液,12000 转/分离心1min,然后加 入198.5μL 人 纤维蛋 白原α 链(FGA)和1.5μL 蛋白酶K,接着加入200μL 异丙醇,12000转/分离心5min,然后加入300μL70% 乙醇,12000转/分离心2min。最后,将DNA 沉淀液溶解于50μL缓冲液中。 在Nanodrop 2000 紫外分光光度计(Thermo,美国)上测量DNA 浓度和纯度,并在-20°C 下保存。
2.3 PCR扩增
用两种引物进行PCR 反应,以区分不同的基因型。PCR 反应体系包含12.5μL 2×缓冲液,4μL 脱氧核糖核苷三磷酸(dNTPs),0.5μL DNA 样本,和5.5μL 二次蒸馏水。PCR 扩增在94℃预变性条件下进行2 min,然后进行16 个循环,94℃循环30s,每个循环60-52℃循环30s(-0.5℃),72℃循环30s;24个循环,94°C 循环30s,55°C 循环30s,72°C 循环30s,72°C 循环10min。引物序列如下609F:5’CTGTATCTTTTGGCAGATCAG; 609aR: AGACTATCCAAGTGCATCACT3’;609t R:5’AGACTATCCAAGTGCATCACA3’;085F: 5’ACTGTCTCTAAGCCCAACAAAC3’;085tR: 5’ATTCTCATCAGACACTTAATCAATA3’;085cR: 5’ATTCTCATCAGACACTTAATCAATG3’。
2.4 琼脂糖凝胶电泳
总共5μL PCR 产品是混合1μL 6×加载缓冲液,然后添加到1.5% 的琼脂糖凝胶电泳和孵化此种缓冲在100 V 40min。结果读取记录凝胶电泳成像和放射学。根据特异性引物对的不同,根据电泳结果分析不同的基因型。
2.5 统计学方法
所有数据分析均采用SPSS17.0 软件进行。测量数据用均数±标准差表示,用t检验进行比较。枚举数据描绘成病例数或由χ2检验和分析。风险评估采用单因素Logistic 回归分析。以P<0.05 为差异有统计学意义。
3 结果
3.1 基本资料和生化指标比较
两组间在年龄和身高分布方面无明显差异。肥胖组的体重、身体质量指数、腰围、臀围、腰臀比、收缩压、舒张压、空腹血糖、甘油三酯、总胆固醇和低密度脂蛋白胆固醇显著高于对照组。
3.2 FTO基因分布频率平衡试验
证实两个位点的FTO 基因多态性频率达到哈迪-韦因贝格平衡定律(P>0.05),表明所选样品具有代表性。
3.3 等位基因和基因型频率比较
两组间rs9939609 基因型频率分布和等位基因频率分布有显著差异(P<0.05)。肥胖组的TT 基因型频率和T 等位基因频率显著高于对照组。两组间rs1421085 基因型频率分布和等位基因频率分布无统计学差异(P>0.05)(见表1,2)。

表1 rs9939609等位基因和基因型频率比较Tab.1 Comparison of allele and genotype frequencies of rs9939609

表2 rs1421085等位基因和基因型频率比较Tab.2 Comparison of allele and genotype frequencies of rs1421085
3.4 蒙古族人肥胖症病人FTO 基因rs9939609 多态性的风险分析
在选择TT 基因型作为对照后,用单向Logistic回归分析对蒙古族人FTO 基因rs9939609 进行分析。携带rs9939609 AT 基因型和TT 基因型的蒙古族人个体的肥胖风险分别比TT 基因型的蒙古族人个体的肥胖风险高出1.312倍和1.896倍(见表3)。
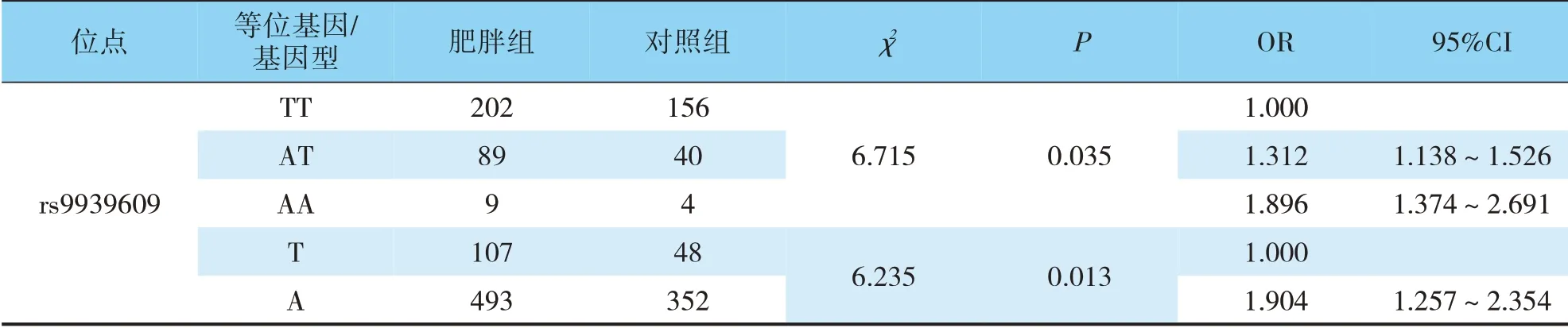
表3 蒙古族肥胖人群FTO基因rs9939609多态性的风险分析Tab.3 Risk analysis of rs9939609 polymorphism of FTO gene in obese Mongolian
3.5 基因rs9939609 多态性与肥胖症及相关代谢指标的关系
rs9939609 AA 和AT 基因型携带者的体重、身体质量指数、腰围、臀围和腰臀比明显高于TT 基因型携带者。rs9939609 AA 和AT 基因型携带者与TT 基因型携带者间在收缩压、舒张压、空腹血糖、甘油三酯、总胆固醇、高密度脂蛋白胆固醇和低密度脂蛋白胆固醇方面无显著差异(P>0.05)。
肥胖症是影响人身心健康的重要因素。随着其发病率的增加,肥胖症已成为全球公共健康问题。肥胖症可以导致多种疾病,例如糖尿病、高血压、高脂血症和心脑血管疾病[16]。在本研究中,与对照组相比,肥胖组的体重、身体质量指数、腰围、臀围、腰臀比、收缩压、舒张压、空腹血糖、甘油三酯、总胆固醇和低密度脂蛋白胆固醇较高,而肥胖组的高密度脂蛋白胆固醇则较低,从而证实肥胖症对人类健康的危害。肥胖症的发生是与不健康的生活方式、饮食习惯和遗传因素密切相关的。除了对生活方式进行积极干预之外,对个体进行遗传分析可以更有效地发现易感人群,从而制定个性化干预计划。
FTO 是由全基因组关联分析(GWAS)项目发现的第一个与肥胖症相关的候选致病基因,其为肥胖症易感人群的科学管理和早期干预提供了依据。目前,数个研究发现FTO 基因的多个单核苷酸多态性位点与代谢综合征有关,例如肥胖症、身体质量指数和糖尿病。然而,不同种族和不同年龄人群的功能性单核苷酸多态性位点是不一致的。Mustafa Solak 等人的研究则证明基因 rs1421085 和rs9939609 对土耳其肥胖症病人[14]没有统计学影响。除了多项大规模研究证明基因rs1421085 和rs9939609 与肥胖症有关外,还证实基因rs1421085和rs9939609 可以通过各种因素影响身体质量指数,如饮食习惯、体育活动、食物摄取和心理健康[8]。因此本研究选择基因rs1421085 和rs9939609 用于统计学分析。
在这项研究中,通过对500 名蒙古族人的调查,我们发现肥胖组基因rs9939609 中的3 个基因型频率和等位基因频率分布与对照组有显著差异。肥胖组TT 基因型和T 等位基因的频率均高于对照组。然而,两组间基因Rs1421085 中的3 个基因型频率和等位基因频率相似,表明基因rs9939609 可能与蒙古族人群肥胖症的发生有关。此外,我们评估了rs9939609 的3 个基因型频率和等位基因频率对肥胖症的风险。携带rs9939609 AT 基因型和TT 基因型的蒙古族人个体的肥胖风险分别比携带TT 基因型蒙古族个体的肥胖风险高出1.312 倍和1.896 倍。A 等位基因的肥胖风险比T 等位基因的肥胖风险高出1.904 倍。在阿联酋人群中,我们观察到基因rs9939609 与身体质量指数显著相关(P= 0.028),A等位基因对身体质量指数[15]具有显著的累加效应。通过有效的体育锻炼,可以降低AA 基因型对身体质量指数的影响(P= 0.027)。rs9939609 AA 和AT基因型携带者的体重、身体质量指数、腰围、臀围和腰臀比显著高于TT 基因型携带者,这与之前的报道是一致的[5]。Kim 等人发现基因rs9939609 多态性可影响膳食中脂肪酸的摄入量,其中AA 基因型携带者饱和脂肪酸占总膳食能量的比例比TT 基因型携带者[9]饱和脂肪酸占总膳食能量的比例高出12.6%。这可能是AA 基因型携带者肥胖风险增加的主要原因之一。 此外,许多研究还证实基因rs9939609 多态性与体育活动和饮食摄取有关,并很可能通过这些行为[9]影响肥胖症的发病率。
本研究发现FTO 基因rs1421085 多态性与蒙古族人肥胖症之间没有相关性。基因rs9939609 的AT/AA 基因型和等位基因A 与肥胖症风险的增加是有相关性的,rs9939609 基因多态性与蒙古人肥胖症的发生显著相关,其可能参与了能量代谢的调节过程。此外本研究仅选择了呼和浩特市的一小部分人群,而没有选择其它地区的蒙古族人。在样本选择的过程中还存在一定的偏差,因此需要根据更大的样本量对本研究的结果进行进一步的调查。

