山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体及其构建方法
孟繁星,樊懿萱,钟部帅,王锋
(南京农业大学动物科技学院,动物科学类国家级实验教学示范中心, 江苏 南京 210095)
我国山羊普遍存在着生长速度慢、出栏体重轻、屠宰率低、肉品质差等问题,是规模化舍饲养羊提质增效面临的重要瓶颈。因此,提高产肉性能及肉品质是当前山羊生产中要解决的重大问题之一。传统的选育方法遗传进展缓慢,通过杂交导入外来品种的优良等位基因,或者通过基因编辑技术模拟其他物种主效基因的突变能加速肉用新品种的培育。Fat-1基因编码的不饱和脂肪酸脱氧酶能够识别一系列16~20碳的n-6PUFAs底物,进而能够催化不同的n-6 PUFAs转化为相应的n-3PUFAs[1-2]。而n-3PUFAs是一类对人类有益的多不饱和脂肪酸,可降低血脂,预防多种疾病甚至癌症等[3-6]。因此,生产转Fat-1家畜,可为提高家畜的肉品质及产肉能力提供思路[7-8]。基因编辑技术使生产过表达Fat-1基因的肉羊新品种成为可能。
在基因工程中,要获得大量纯化的目的蛋白质,需要构建一种能够高水平表达外源蛋白质的表达载体。启动子对外源基因的表达影响很大,是表达载体的一个重要元件。启动子严格调控着基因表达的时间和空间位置。启动子与受体细胞之间良好的兼容性对外源基因的表达有重要作用。同时,出于高水平表达的要求,这种启动子最好有较强的启动活性,并具有良好的调控系统。因此,构建包含合适启动子的载体,可以提高外源基因表达效率。基因治疗对目的基因在病人体内的表达,要求严格的时间和空间位置,组织器官特异性启动子的研究使基因治疗方法有了很大进步。根据需要来构建合适的组织特异性启动子载体,不仅便于研究新基因的功能,还可阐明生物的生长、发育、分化及繁殖的过程与机理,在特定的部位或发育阶段生产有用蛋白质或其他代谢产物,以实现对外源基因表达定时、定点、定量的精确调控。
利用肌肉特异性启动子,通过构建相应的表达载体,能够开启基因固定于肌肉中表达。通过外源基因的蛋白或RNAs在山羊的骨骼肌中的表达,可很好地研究肌肉的分化或功能,改善肌肉的风味、质量。例如可利用肌肉特异性的启动子携带目的micRNA,特异性的静默其靶基因在肌肉中的表达而不影响其他组织中此基因的正常表达,有效获得目的基因对于肌肉组织的作用;同时,利用肌肉组织特异性启动子,研究那些通过QTL图谱定位及表达分析获得的可用于提高肌肉量的候选基因。
1 材料与方法
1.1 质粒、菌株与细胞
pEGFP-C1质粒为本实验室保存,pMD19-T质粒购自TaKaRa公司,TOP10菌株购自北京天根公司,293FT细胞系为本实验室保存。
1.2 主要仪器
5417R型台式冷冻高速离心机(Eppendorf)、PCR扩增仪(TaKaRa)、电泳仪 DYⅢ 3A 型(北京六一仪器厂)、全自动凝胶成像分析系统(上海培清公司)、CO2培养箱(Thermo)、荧光倒置显微镜(Nikon)、7300 型荧光定量PCR 仪(ABI)。
1.3 主要试剂
质粒提取试剂盒(D6943-01和D6950-01)购自Omega公司,所有的工具酶均购自TaKaRa公司,DNA片段的凝胶回收试剂盒购自广州东盛生物公司,PCR引物的合成及载体测序均由Life Technologies公司完成;细胞培养液DMEM、胎牛血清(FBS)、0.25%胰酶消化液、DPBS缓冲液、转染试剂Lipofectamine 2000均购自Life Technologies公司;细胞总RNA提取试剂盒(RP1202)购自北京百泰克生物公司,反转录试剂盒(RR036A)购自TaKaRa公司,荧光定量PCR试剂盒购自Roche公司。
1.4 主要溶液配制
1.4.1 细菌培养基
LB液体培养基:每升含有酵母提取物5.0 g,胰蛋白胨10.0 g,NaCl 10.0 g,pH 7.0,121 ℃高压灭菌30 min,室温冷却后放于4 ℃冰箱备用。
LB固体培养基:在LB液体培养基中加入15 g/L琼脂粉,高压蒸汽灭菌20 min,无菌条件下铺平板。若加抗生素,铺板之前,加入抗生素,卡那霉素(kanamycin)终浓度为50 μg/mL,氨苄青霉素(ampicillin)终浓度为100 μg/mL。
1.4.2 核酸电泳用试剂
6×Loading Buffer:4.4 g EDTA,250 mg 溴酚蓝,250 mg Xylene Cyanol FF,180 mL 甘油,调节pH 至7.0,加去离子水定容至500 mL。
50×Tris-乙酸(TAE):242 g Tris液,37.2 g Na2EDTA·2H2O,57.1 mL 冰乙酸,加去离子水定容至1 L。
1.5 试验方法
首先将Fat-1基因克隆入pEGFP-N1载体,然后将PCR扩增得到的CMV增强子插入无启动子和增强子的pEGFPN1-Fat-1载体,最后将骨骼肌特异性基因α肌动蛋白(α-actin)启动子插入到上述载体中,构建成α-actin promoter-pEGFPN1-Fat-1载体。骨骼肌特异性基因α-actin启动子驱动的Fat-1基因表达载体构建示意图(见图1)。
1.5.1 利用平末端连接构建pEGFPN1-Fat-1载体
经过EcoRⅠ酶切,从PCAGGS-Fat-1质粒获得Fat-1片段。将10×buffer 2 μL,质粒DNA 10 μL,EcoRⅠ 1 μL,ddH2O添加至20 μL进行酶切。电泳后,切胶回收Fat-1片段。
线性化pEGFP-N1载体。加10×buffer 2 μL,质粒DNA 10 10 μL,BamHⅠ 1 μL,用ddH2O添加至20 μL,线性化处理pEGFP-N1载体。
将切胶回收后的Fat-1和线性化pEGFP-N1的cDNA末端,按照如下体系72 ℃ 45 min 补平。
反应体系:Premix STAR 25 μL,Fat-1的cDNA/pEGFP-N1的cDNA(已酶切) 20 μL,ddH2O添加至50 μL。
平末端连接:Solution I 5 μL,Fat-1补平产物1 μL,pEGFP-N1补平产物 4 μL,16 ℃过夜。

图1 骨骼肌特异性基因α-actin启动子驱动的Fat-1基因表达载体的构建示意图
1.5.2 pEGFPN1-Fat-1-Ehancer载体的构建
根据PCAGGS载体的CMV-Enhancer序列,设计一对含有特异性酶切位点的引物,通过PCR方法扩增CMV-Enhancer基因。PCR反应条件:94 ℃预变性5 min;98 ℃变性10 s,56 ℃退火15 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。然后将上述产物与pMD®19-T Vector连接。对CMV-Enhancer基因进行测序后,与PCAGGS载体CMV-Enhancer序列做Blast比对。扩增山羊CMV-Enhancer基因的引物序列如下:
Enhancer-F:GCATTAATGGGGTCATTAGTTCATAGCCC(引入AseⅠ位点);
Enhancer-R:GCGTCGACTGGTAATAGCGATGACTAATACG(引入SalⅠ位点)。
CMV-Enhance基因片段经PCR 扩增后进行1.0%琼脂糖凝胶电泳。分别利用SalⅠ和AseⅠ双酶切pMD®19-T-CMV-enhancer和Fat1-pEGFP-N1载体并分别回收酶切产物CMV-Enhancer基因片段和线性化的Fat-1-pEGFP-N1载体。将酶切产物定向克隆到无启动子和增强子的pEGFPN1-Fat-1载体质粒中,构建成pEGFPN1-Fat-1-Ehancer载体。
1.5.3 α-actin promoter-pEGFPN1-Fat-1载体的构建
SalⅠ单酶切骨骼肌特异性基因α-actin启动子的DNA,插入到线性化的pEGFPN1-Fat-1-Ehancer载体上,构建成α-actin promoter-pEGFPN1-Fat-1载体。采用分段PCR扩增的方法,分别从羊肌肉组织DNA中扩增1 824 bp和1 347 bp两片段Part1和Part2,首尾相连插入pEGFPN1-Fat-1-Ehancer质粒同一位置。各片段引物设计如下:
part1F: TCATCGCTATTACCAGTCGACAGCCCCC-CTCACTATTCTTTT;
part1R: CTGGGCAGCAGTTTTCCT;
part2F: GAAAACTGCTGCCCAGCCTACAGTGCA-ACGTCCTTGTCTT;
part2R: CGGGCCCGCGGTACCGTCGACAGGCT-TCTCTCGGCGCTGTCCGCT。
按照98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸1 min,共25个循环;72 ℃延伸10 min进行PCR扩增制备两段插入片段,胶回收备用。Part1不加任何添加剂,直接扩增。Part2通过添加DMSO进行扩增优化,在20 μL体系中,添加0.6 μL DMSO大量扩增制备该片段。
SalⅠ单酶切pEGFPN1-Fat-1-Ehancer载体,胶回收备用。线性化pEGFPN1-Fat-1-Ehancer载体和α-actin的两部分片段在ExnaseTM 催化下,37 ℃,30 min重组。置于冰水浴中5 min后,进行转化。挑取转换平板10个克隆,摇菌提取质粒并鉴定。然后挑取3个质粒进行测序。
1.5.4 山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体的功能验证
以海肾荧光素酶报告基因PRL-TK做内参质粒(用以校正转染效率),以LipofectamineTM2000做转染试剂,将构建的山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体分别瞬时转染山羊骨骼肌细胞,诱导分化的山羊骨骼肌细胞。用山羊心肌细胞和骨骼肌间充质干细胞空转做阴性对照,利用双荧光素酶报告基因检测试剂盒,对山羊骨骼肌特异性表达基因α-actin启动子驱动Fat-1表达载体的活性及组织特异性进行分析,启动子活性大小用相对活性(萤火虫荧光素酶的活性同内参海肾荧光素酶的活性的比值)表示。
1.5.5 细胞周期与细胞凋亡
按照Lipofectamine 2000 转染试剂说明书,将α-actin promoter-pEGFPN1-Fat-1质粒转染羊耳皮肤成纤维细胞。转染48 h后,收集细胞,调整细胞密度为5.0×106个/mL,1 500 r/min离心5 min,弃上清,用PBS洗1次,离心得到细胞团,加入1 mL DNA染色液,漩涡混合5~10 s,室温避光孵育30 min,流式细胞仪检测细胞周期。采用Annexin V/PI染色法流式细胞仪检测细胞凋亡。
1.5.6 数据统计与分析
所有试验重复至少3次。结果用平均值±标准误表示,差异显著性分析使用SPSS 18.0统计软件进行单因素方差分析,不同字母代表差异显著,P<0.05。
2 结果与分析
2.1 骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体的构建
2.1.1 利用平末端连接构建pEGFPN1-Fat-1载体
PCAGGS-Fat-1质粒经EcoRⅠ酶切后电泳可见1.3 kb的目的条带及PCAGGS载体条带(图2)。pEGFP-N1质粒经BamHⅠ酶切后电泳可见线性化的载体条带(图3)。
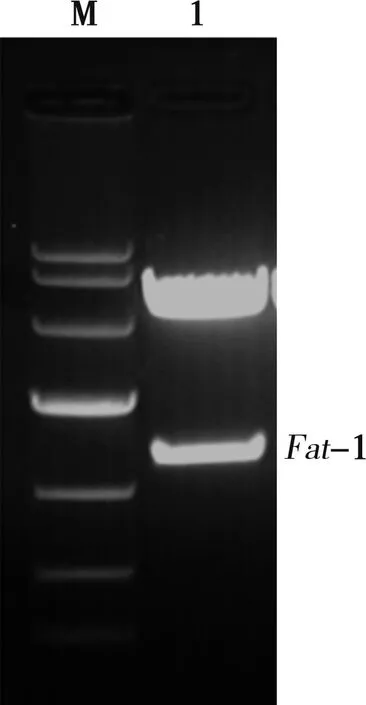
M. Marker;1. Fat-1

M. Marker;1. 线性化pEGFP-N1
将切胶回收后的Fat-1和线性化pEGFP-N1的cDNA末端补平,进行平末端连接。pEGFPN1-Fat-1中Fat-1基因序列与EGFP连接处正确(图4)。

图4 pEGFPN1-Fat-1中Fat-1序列与EGFP连接处测序结果
2.1.2 pEGFPN1-Fat-1-Ehancer载体的构建
对CMV-Enhancer基因进行测序后,与PCAGGS载体CMV-Enhancer序列做Blast比对,结果同源性为99.8%。CMV-Enhance基因片段经PCR 扩增后,进行1.0%琼脂糖凝胶电泳,可见338 bp处明亮特异的目的条带(图5)。CMV-Enhancer基因测序结果与PCAGGS载体CMV-Enhancer序列一致(图6)。利用pMD®19-T-CMV-enhancer载体上自带的SalⅠ和AseⅠ限制性内切酶酶切位点,将酶切产物定向克隆到无启动子pEGFPN1-Fat-1载体质粒中,构建成pEGFPN1-Fat-1-Ehancer载体(图7和 图8)。

M. Marker;1. 目的条带

图6 CMV-Enhancer基因测序结果

M.Marker;1~3. 目的条带图7 AseⅠ、SalⅠ双酶切 M.Marker;1~3. 目的条带图8 AseⅠ、SalⅠ双酶切
2.1.3 α-actin promoter-pEGFPN1-Fat-1载体的构建
SalⅠ单酶切骨骼肌特异性基因α-actin启动子的NDA,插入线性化的pEGFPN1-Fat-1-Ehancer载体,构建成α-actin promoter-pEGFPN1-Fat-1载体。从羊肌肉组织DNA中,扩增1 824 bp和1 347 bp两片段Part1和Part2,首尾相连插入pEGFPN1-Fat-1-Ehancer质粒。PCR扩增制备两段插入片段(图9)。

A. PCR扩增Part1;B. 添加DMSO扩增优化Part2
PCR鉴定α-actin promoter-pEGFPN1-Fat-1载体(图10)。而且,测序结果与GenBank 报道序列一致。说明α-actin promoter-pEGFPN1-Fat-1载体构建成功。
2.2 山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体的生物学功能
2.2.1 山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体的功能验证
如图11所示,试验构建的载体仅在诱导分化的山羊肌肉细胞中表达,在未诱导分化的山羊骨骼肌细胞、心肌细胞和间充质干细胞中未检测到荧光蛋白表达,无启动活性(图11)。综上所述,α-actin表达载体为骨骼肌特异性表达载体,能够满足下游基因在骨骼肌中特异性表达的要求,为转基因载体提供了一种重要的元件。

M. Maker,0. 空载对照质粒;1~10. 克隆

图11 4种细胞中a-actin驱动下的LUC的相对活性检测
2.2.2 山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体对耳成纤维细胞周期的影响
通过流式细胞仪测定了波尔羊耳成纤维细胞(BG)、转Fat-1羊成纤维细胞(BG-Fat-1)、杜泊羊耳成纤维细胞(DS)及转Fat-1基因杜泊羊耳成纤维细胞(DS-Fat-1)的细胞周期,结果发现,转Fat-1基因细胞比相对应非转基因细胞的增殖能力强,初步推测,Fat-1基因促进羊耳成纤维细胞增殖,为后续进一步的研究奠定了基础(图12)。
2.2.3 山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体对耳成纤维细胞凋亡的影响
通过流式细胞仪测定了细胞的凋亡情况,结果见图13A。BG-Fat-1组细胞凋亡率显著低于BG组,DS和DS-Fat-1组差异不显著,但凋亡率有下降趋势(图13B)。
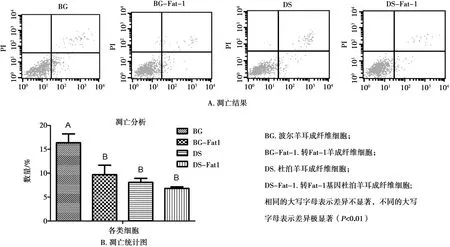
图13 流式细胞仪检测细胞凋亡
转Fat-1基因细胞的凋亡率低于相对应的非转基因细胞,初步推测Fat-1基因参与调节羊耳成纤维细胞凋亡。
3 讨论
启动子严格调控着基因表达的时间和空间位置。启动子与受体细胞之间良好的兼容性对外源基因的表达有重要作用[9]。因此,选择合适的特异性启动子可以显著影响所构建的表达载体对外源基因的表达效率。另外,根据需要来构建合适的组织特异性启动子载体,不仅便于研究新基因的功能,还可阐明生物的生长、发育、分化及繁殖过程与机理,在特定的部位或发育阶段生产有用蛋白质或其他代谢产物,以实现对外源基因表达的定时、定点、定量精确调控。
近年来, 随着基因组测序等生物技术的飞速发展, 除了α肌动蛋白(α-actin)[10]、人们还分离了许多骨骼肌特异性启动子, 如脂肪酸转运蛋白1(FATP1)、骨骼肌肌球蛋白轻链2(Mylpf)、肌肉肌酸激酶(CKM)、肌原调节蛋白1(Myoz1)和快肌肌钙蛋白C(Tnnc2)等骨骼肌特异性基因启动子,但是哪个启动子的转录活性及其对山羊骨骼肌细胞增殖、分化作用最显著,目前还不得而知。
本文利用骨骼肌特异性基因α-actin启动子,构建了一种山羊骨骼肌特异性基因α-actin启动子驱动的Fat-1表达载体,不仅开启了将基因局限于骨骼肌中表达的通路,而且满足了下游基因在骨骼肌中特异性表达的要求,为转基因载体提供了一种重要的元件。研究结果表明,选择山羊骨骼肌特异性基因α-actin启动子构建的载体仅在诱导分化的山羊肌肉细胞中表达,在未诱导分化山羊骨骼肌,心肌细胞和间充质干细胞中并未检测到荧光蛋白,无启动活性。此外,研究发现,Fat-1基因促进羊耳成纤维细胞增殖,抑制凋亡。初步预测得到的Fat-1转基因成纤维细胞可作为后期体细胞核移植的优良细胞核供体,为下一步生产转基因动物奠定了基础。

