基于常规引物靶向结核分枝杆菌Ⅱ型分枝杆菌散在重复单位的恒温扩增
吴 康 屈 蓉 王 刚 薛清华 吕建新 Douglas B.Lowrie 范小勇,△
(1上海市(复旦大学附属)公共卫生临床中心 上海 201508;2温州医科大学检验医学院和生命科学学院 温州 325035)
结核病(tuberculosis,TB)是主要由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染所致的传染性疾病。全世界约有1/4 人口是Mtb携带者,TB在单一感染病原菌所致疾病中致死人数最多。2018 年,全世界TB 新发病例约有1 000 万,死亡病例约145 万。其中中国的TB 病例数占全世界TB病例数的9%,排名第二(病例数第一的国家是印度,占全世界TB 病例数的27%)[1]。2018 年,全世界约有50 万利福平抗性TB(其中约78%为多药抗性TB),其中来自中国的病例数占14%,排名第二(来自印度的病例数最多,占27%)[1]。WHO 的“End TB”目标是在2035 年减少95%(相比于2015年)的TB 致死病例[2]。
TB 的有效治疗依赖于现场的及时快速诊断。目前,TB 的诊断方法主要有基于疑似患者样本的显微镜观察、培养和核酸扩增的方法[3];基于疑似患者血液细胞的抗原特异干扰素γ 释放试验(interferon-γ release assay,IGRA)[4];基于疑似患者血清/尿液TB 抗原的直接检测[5]。其中,基于疑似患者样本的核酸扩增和血清/尿液TB 抗原的直接检测方法具有现场快速且低成本诊断的潜力。
基于疑似患者样本的核酸扩增方法以PCR 或者恒温扩增为基础。以PCR 为基础的方法(比如Xpert Mtb/RIF 及其Ultra/OMNI 版本)所需设备较复杂且成本较高,因此适合实验室检测而不适合现场检测[3,6]。以恒温扩增为基础的方法因为只需要一个恒温装置便可实现核酸样本的快速扩增和检测,因此便于现场检测。目前有多个针对TB 的处于不同开发阶段的恒温扩增方法,比如TB-环介导等温扩增(TB-loop-mediated amplification test,TBLAMP)[7]、多交叉置换扩增(multiple cross displacement amplification,MCDA)[8]、交叉引物扩增(cross-priming amplification,CPA)[9-10]、聚合酶螺旋反应(polymerase spiral reaction,PSR)[11-12]。这些方法用两条或者多条引物进行恒温扩增,且所用引物必须包括特殊设计的可以折叠成特定二级结构的引物[13]。在本研究中,我们发现重复DNA 序列无需用特殊设计的可以折叠成特定二级结构的引物,仅用其特异常规引物对便可进行恒温扩增。我们进一步设计针对MtbⅡ型分枝杆菌散在重复单位(mycobacterial interspersed repetitive units,MIRUs)的常规引物,并测试其检测Mtb的可能性。
材料和方法
细菌培养Mtb菌株(包括MtbH37Rv 和Mtb临床分离株)、卡介苗M.bovisBCG 巴斯德株(BCG pasteur)和耻垢分枝杆菌(M.smegmatis)mc2155 培养于添加了10%油酸-白蛋白-右旋糖-过氧化氢酶添加剂(oleic acid-albumin-dextrose-catalase enrichment,OADC)、0.5%甘油、0.05%吐温-80 的Middlebrook 7H9 液体培养液中(美国BD Difco 公司)。单核细胞增生性李斯特菌(Listeria monocytogenes)EGD-e培养于脑心浸液肉汤液体培养基(青岛海博生物技术有限公司)。大肠埃希菌(Escherichia coli,E.coli)Top10 培养于LB 液体或固体培养基。细菌培养温度为37 ℃。对于氨苄青霉素抗性E.coli克隆的筛选或培养,氨苄青霉素的终浓度为100 mg/L。
MtbH37Rv 和M.bovisBCG 购自美国菌种保藏中心(American Type Culture Collection,ATCC)。M.smegmatismc2155 由复旦大学分子病毒室高谦教授惠赠。Mtb临床分离株来自于上海市(复旦大学附属)公共卫生临床中心检验科。Listeria monocytogenesEGD-e 由上海交通大学农学院王恒安教授惠赠。E.coliTop10 感受态细胞购自北京全式金生物技术有限公司。
基因组DNA 的提取MtbH37Rv 菌液和Listeria monocytogenesEGD-e 菌液在80 ℃水浴灭活30 min 后用于基因组DNA 的提取。M.bovisBCG 和M.smegmatismc2155 不用灭活处理。后续基因组DNA 的提取参考文献[14]。简单来讲,细菌先用溶菌酶(上海生工生物工程有限公司)和RNase A(美国Thermo Fisher Scientific 公司)在37 ℃消化过夜;之后继续加入SDS 和蛋白酶K(上海生工生物工程有限公司)并于56 ℃消化1 h;之后再加入十六烷基三乙基溴化铵(cetyltrimethylammonium bromide,CTAB)并于65 ℃继续消化10 min。加入等体积氯仿∶异戊醇(24∶1)颠倒混匀,12 400×g离心5 min,取上清(本步骤重复2 次)。基因组DNA 通过异丙醇沉淀,并用70%的乙醇洗涤,最后溶解于TE 缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH 8.0)中。
Mtb临床分离株培养物重悬于PBS 并沸水浴15 min(每隔5 min 颠倒混匀),之后12 000×g离心10 min,收集上清用于恒温扩增的模板。本研究所用其他非结核分枝杆菌(NTM)基因组DNA 由北京胸科医院黄海荣主任惠赠。
恒温扩增和PCR恒温扩增所用聚合酶为Bst2.0 WarmStart DNA 聚合酶(简称Bst2.0)(美国NEB 公司),并按照其说明书进行恒温扩增。对于实时恒温扩增,需在反应体系中另加入0.8×的SYBR Gold 核酸荧光染料(原液为10 000×;美国Thermo Fisher Scientific 公司)。
PCR 所用聚合酶为PrimeSTAR GXL DNA 聚合酶(简称PrimeSTAR)(日本TaKaRa 公司),并按照其说明书进行PCR。基于引物rDs7-F 和/或rDs7-R 的PCR 所用退火温度为59 ℃,延伸时间为10 s,循环数为35;对应模板rDs7 通过全基因合成并连接入载体pUC57,所得载体被命名为pUC57-rDs7。基于引物Ⅱ_MIRU-F 和/或Ⅱ_MIRU-R 的PCR 所用退火温度为65 ℃,延伸时间为10 s,循环数为35。引物序列见表1。
DNA 的TA 克隆和测序用AxyPrep PCR Clean-up 试剂盒(美国Axygen 公司)回收恒温扩增的DNA 产物,然后用Taq DNA 聚合酶(日本TaKaRa 公司)并按照其说明书于72 ℃处理10 min,以便在DNA 3'末端添加碱基A。将添加碱基A 的DNA 产物连接入载体pMD19-T(日本TaKaRa 公司)、转化E.coliTop10 感受态细胞、蓝白斑筛选、挑取白色克隆测序。测序所用引物为载体通用测序引物,即RV-M 和M13-47。
痰液样本的收集和处理本研究测试了4 例成年肺结核患者(pulmonary TB,PTB 组)和4 例成年对照志愿者(Control,Con 组)的痰液样本(>3 mL)。PTB 组为痰培养和/或痰涂片阳性、IGRA阳性、HIV 阴性、Xpert Mtb/RIF 阳性。Con 组为痰培养和痰涂片阴性、IGRA 阴性、HIV 阴性、Xpert Mtb/RIF 阴性。收集痰液时,PTB 组和Con 组均未进行抗TB 药物治疗。
痰液分为两份:一份用于Xpert Mtb/RIF 分析;另一份抽提DNA 用于恒温扩增。DNA 抽提步骤为:痰液标本中加入2~3 倍体积的4% NaOH(即4 g/100 mL),37 ℃处理30 min,使之充分液化;取液化的标本900 μL,加入1.5 mL 的无菌离心管中,14 500×g离心10 min;弃上清,沉淀中加入1 mL 无菌生理盐水,振荡混匀(将沉淀悬浮),14 500×g离心10 min;弃上清,再次以1 mL 生理盐水洗涤沉淀,14 500×g离心10 min;弃上清,沉淀中加入DNA 提取液(来自结核分枝杆菌复合群核酸检测试剂盒,德国Qiagen 公司)30 μL,振荡混匀;37 ℃震荡仪(杭州奥盛仪器有限公司,TMS-200)1 500 r/min 温浴10 min 后,100 ℃金属浴10 min。14 500×g离心10 min,保留上清用于恒温扩增的模板。
结果
以重复DNA 序列为模板的基于特异常规上下游引物的恒温扩增以重复DNA 序列rDs7 为模板,用其特异常规上下游引物(即rDs7-F 和rDs7-R)(图1A 和1B)进行PCR 扩增(所用DNA 聚合酶为不具有链置换能力的PrimeSTAR)时,所得产物高度弥散(图1C)。因为PrimeSTAR 不具有链置换能力,以其进行的恒温(59 ℃或65 ℃)扩增无法得到扩增产物(图1C)。以具有链置换能力的DNA 聚合酶Bst2.0 进行恒温扩增则可以得到高度弥散的扩增产物(图1C)。以rDs7 为模板,用Bst2.0 进行的恒温扩增需要上下游常规引物rDs7-F 和rDs7-R 的同时参与,且扩增具有指数增长特性(图1D)。重复DNA 区段可用其特异常规上下游引物进行恒温扩增。

图1 以重复DNA 序列为模板的恒温扩增Fig 1 Isothermal amplification using repetitive DNA as template
以重复DNA 序列为模板的基于特异常规上下游引物的恒温扩增原理对于常规引物便可实现恒温扩增重复DNA 序列,其具体机制可以解释为(以rDS7 的恒温扩增为例):(1)因为引物rDs7-F 和rDs7-R 在rDs 各有7 个结合位点(图1A 和1B),因此引物rDs7-F/rDs7-R 首先可以扩增出49 个不同的DNA 片段,长度可能是108、216、324、432、540、648或756 bp;(2)所扩增的49 个不同的DNA 片段彼此高度同源,其可以扮演彼此的模板和/或引物,再加之rDs7-F/rDs7-R 的持续参与,之后会恒温扩增出更加复杂多样、彼此高度同源、不同长度的DNA 产物;(3)扩增反应不断重复类似第(1)和第(2)步的反应(图2)。
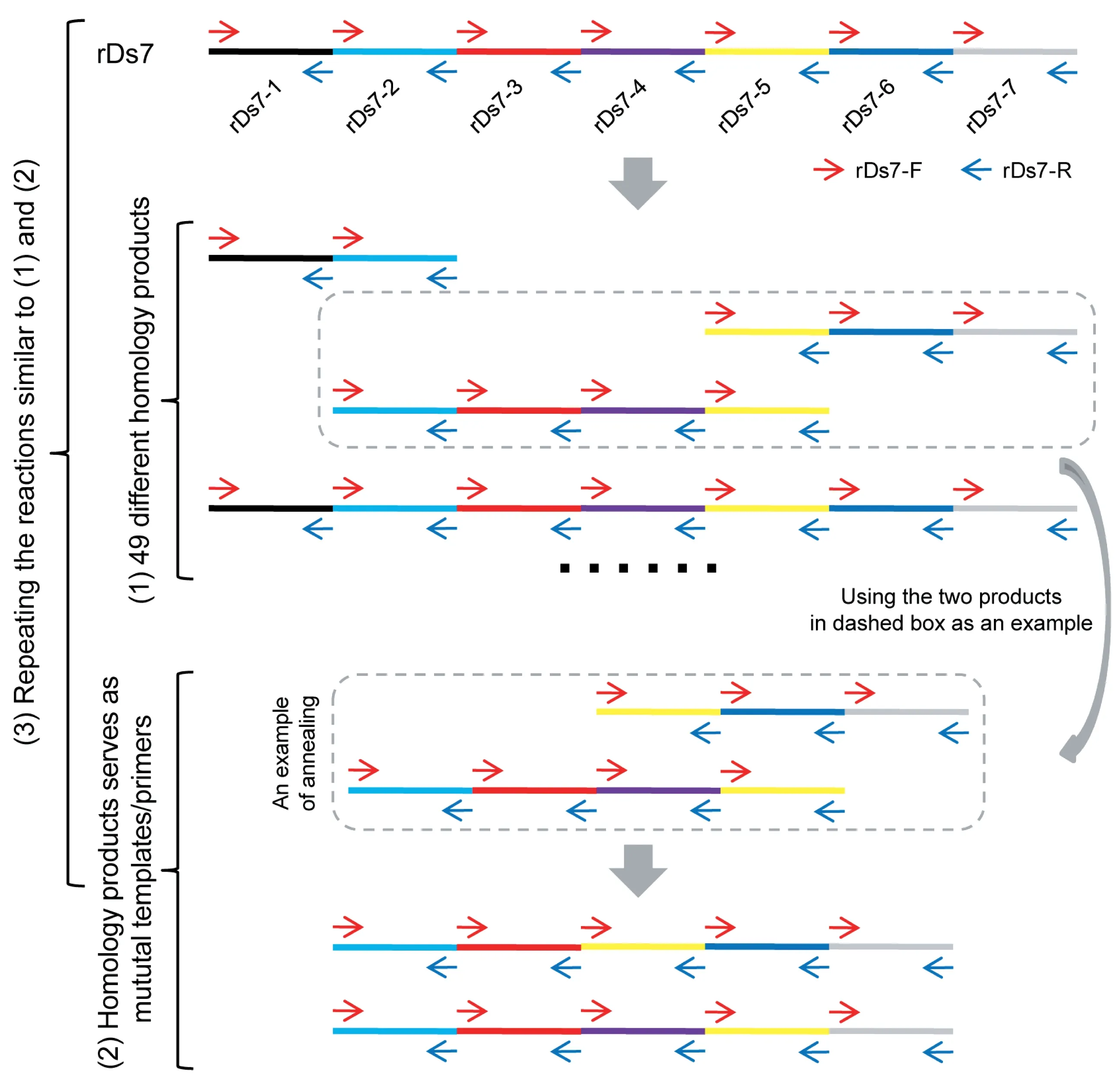
图2 重复DNA 序列rDs7 可能的恒温扩增机制Fig 2 Proposed mechanism of isothermal amplification on repetitive rDs7
Mtb H37Rv Ⅱ型MIRUs 为模板的恒温扩增MIRUs 是散布于Mtb复合物基因组的串联重复DNA 序列,其单个重复DNA 序列长度一般为40~100 bp。根据序列特征,MIRUs 可分为Ⅰ型、Ⅱ型、和Ⅲ型。MtbH37Rv 基因组共有41 个MIRUs 位点,其中含有Ⅱ型MIRUs 的位点数最多(22 个),而含有Ⅰ型MIRUs 的位点数为8 个,含有Ⅲ型MIRUs的位点数为16 个。同一位点可能同时出现两种不同类型的MIRUs[15-16]。鉴于重复DNA 序列可用其特异常规引物进行恒温扩增(图1),同时因为Mtb基因组中含有MIRUs,且含有Ⅱ型MIRUs 的位点数最多(22 个),因此我们设计了针对Ⅱ型MIRUs保守序列[15]的上下游特异常规引物,即Ⅱ_MIRU-F和Ⅱ_MIRU-R(引物序列见表1),并以H37Rv 基因组DNA 为模板进行恒温扩增和PCR。
如图3A 所示,和rDs7 的结果相似(图1C),以H37Rv 基因组DNA 为模板,用Ⅱ_MIRU-F/Ⅱ_MIRU-R 进行恒温扩增可以得到扩增产物;用Ⅱ_MIRU-F/Ⅱ_MIRU-R 进行PCR 亦可得到PCR 产物。我们进一步发现,和rDs7 的结果不同(图1D),以H37Rv 基因组DNA 为模板,单用Ⅱ_MIRU-F 进行恒温扩增亦可得到扩增产物,且其扩增产物产量高于Ⅱ_MIRU-F/Ⅱ_MIRU-R 恒温扩增产物的产量;单用Ⅱ_MIRU-R 进行恒温扩增无法得到扩增产物(图3B)。将Ⅱ_MIRU-F/Ⅱ_MIRU-R 或Ⅱ_MIRU-F的恒温扩增产物分别克隆/测序。对于Ⅱ_MIRU-F/Ⅱ_MIRU-R 的恒温扩增产物,29 个单克隆中有22 个单克隆可成功测序,其中一个代表性克隆的测序结果展示于图3C。对于Ⅱ_MIRU-F 的恒温扩增产物,33 个单克隆中仅有1 个单克隆可成功测序,其测序结果展示于图3D。对于克隆无法成功测序,其原因可能为所扩增DNA 产物的高级结构较复杂且稳定所致。从图3D 可知,Ⅱ_MIRU-F 在该序列的5’和3’各有一个结合位点,且方向相反,即Ⅱ_MIRU-F 同时扮演了上游引物和下游引物。综上所述,MtbH37Rv Ⅱ型MIRUs 可用其特异常规引物Ⅱ_MIRUF/Ⅱ_MIRU-R 或者Ⅱ_MIRU-F 进行恒温扩增。

图3 针对Mtb H37Rv Ⅱ型MIRUs 的恒温扩增Fig 3 Isothermal amplification targeting type ⅡMIRUs of Mtb H37Rv
Ⅱ型MIRUs 特异常规引物的恒温扩增特异性分析鉴于用常规引物Ⅱ_MIRU-F/Ⅱ_MIRU-R 或者Ⅱ_MIRU-F 可以恒温扩增MtbH37Rv(图3B),我们进一步测试其对其他菌株的恒温扩增结果。如图4A 所示,引物Ⅱ_MIRU-F/Ⅱ_MIRU-R 不能恒温扩增非分枝杆菌菌株Listeria monocytogenesEGD-e,而能恒温扩增非结核分枝杆菌M.smegmatismc2155和Mtb复合物菌株M.bovisBCG;Ⅱ_MIRU-F 则不能恒温扩增这3 种菌株,而只能特异地扩增MtbH37Rv。进一步分析发现,Ⅱ_MIRU-F 亦不能恒温扩增其他多个非分枝杆菌菌株(图4B)。对20 个非结核分枝杆菌的恒温扩增结果表明,除MtbH37Rv外,Ⅱ_MIRU-F 只能恒温扩增M.intracellulare和M.gordonae,而不能恒温扩增其他18 个非结核分枝杆菌(图4C)。Ⅱ_MIRU-F 亦不能恒温扩增所测试的其他3 个Mtb复合物菌株(即M.microti、M.africanum、和M.bovis)。综上所述,相比于引物Ⅱ_MIRU-F/Ⅱ_MIRU-R,引物Ⅱ_MIRU-F 具有很强的特异恒温扩增MtbH37Rv 的能力。
Ⅱ型MIRUs 特异常规引物Ⅱ_MIRU-F 能够扩增其他Mtb 临床分离株鉴于Ⅱ_MIRU-F 具有很强的特异扩增MtbH37Rv 的能力(图4),我们进一步测试Ⅱ_MIRU-F 是否能够扩增Mtb临床分离株。如图5 所示,Ⅱ_MIRU-F 可以恒温扩增所测试的20 个Mtb临床分离株。表明Ⅱ_MIRU-F 可以通用于恒温扩增Mtb菌株。

图4 Ⅱ_MIRU-F 和/或Ⅱ_MIRU-R 针对其他菌株的恒温扩增Fig 4 Isothermal amplification targeting other bacteria strains using Ⅱ_MIRU-F and/or Ⅱ_MIRU-R
Ⅱ型MIRUs 特异常规引物Ⅱ_MIRU-F 恒温扩增的检测下限分析由图6 可知,当恒温扩增时间为1 h 时,Ⅱ_MIRU-F 不能成功扩增所测浓度的MtbH37Rv 基因组DNA;当恒温扩增时间为2 h 时,Ⅱ_MIRU-F 可成功扩增终浓度为0.4 ng/μL 的MtbH37Rv 基因组DNA;当恒温扩增时间延长至3 h 时,Ⅱ_MIRU-F 可进一步成功扩增终浓度为40 pg/μL 的MtbH37Rv 基因组DNA。
Ⅱ型MIRUs 特异常规引物Ⅱ_MIRU-F 对于痰液样本的恒温扩增最后我们测试Ⅱ_MIRU-F 是否可以从痰液中特异检出Mtb。如表2 所示,和Xpert Mtb/RIF 的结果一致,Ⅱ_MIRU-F 在恒温扩增1、2、3 h 后都可成功扩增PTB 患者的痰液样本。进一步用另外30 个PTB 患者(同时为Xpert Mtb/RIF 阳性)样本的扩增(3 h)发现,其中24 个样本亦可成功扩增(数据未展示)。但是当用Ⅱ_MIRU-F恒温扩增非TB 志愿者痰液样本时,和Xpert Mtb/RIF 的结果不同,Ⅱ_MIRU-F 在恒温扩增1、2、3 h后亦能成功扩增非TB 志愿者的痰液样本(表2)。对另外26 个非TB 志愿者痰液(同时为Xpert Mtb/RIF 阴性)样本进行扩增(3 h)发现,其中有15 个样本亦被成功扩增(数据未展示)。这些结果表明,Ⅱ_MIRU-F 不能特异地从PTB 患者的痰液中特异地扩增Mtb。
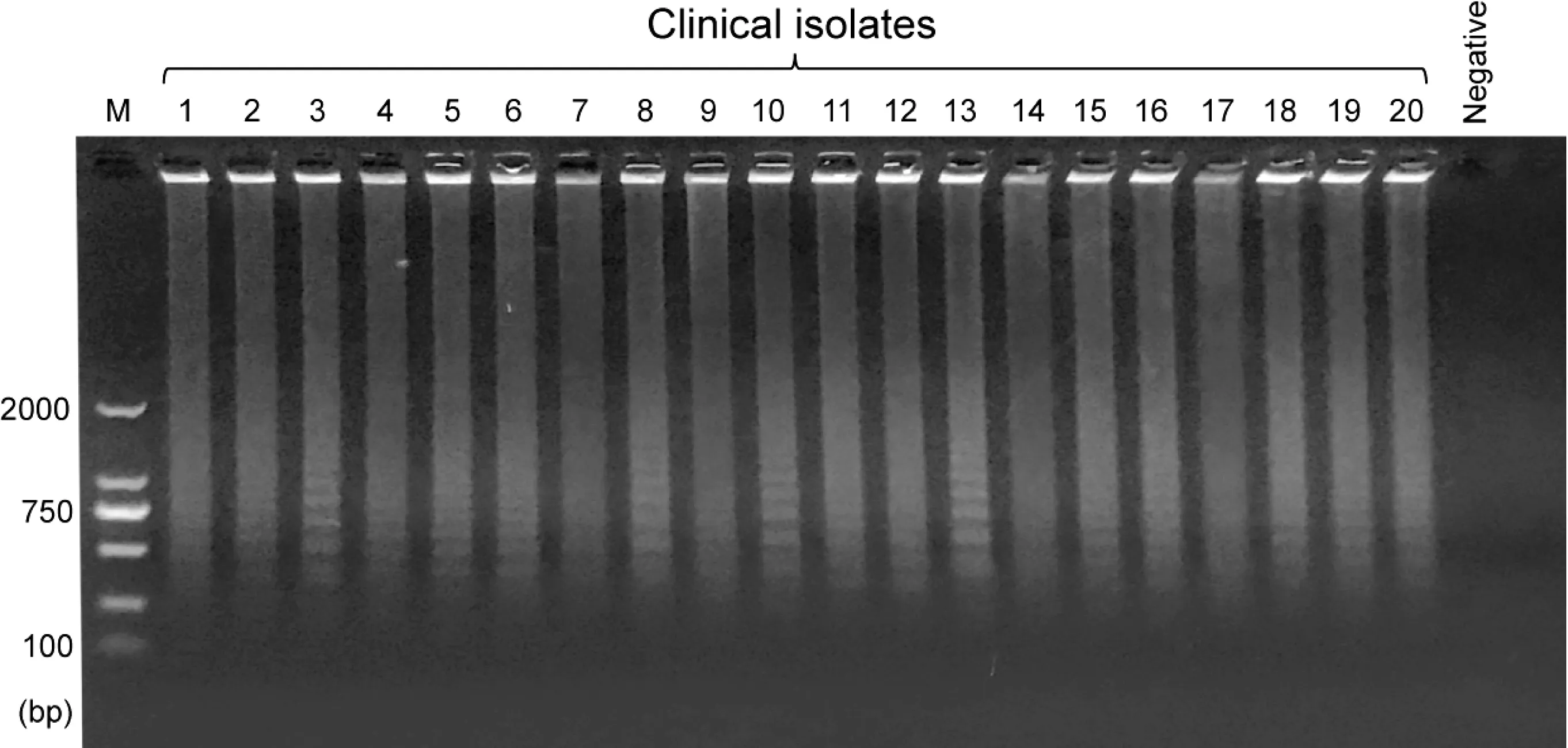
图5 Ⅱ_MIRU-F 针对Mtb 临床分离株的恒温扩增Fig 5 Isothermal amplification targeting Mtb clinical isolates using Ⅱ_MIRU-F

图6 Ⅱ型MIRUs 特异常规引物Ⅱ_MIRU-F 对于梯度稀释Mtb H37Rv 基因组DNA 的恒温扩增Fig 6 Isothermal amplification targeting serial diluted Mtb H37Rv genomic DNA using type ⅡMIRU-specific ordinary primer Ⅱ_MIRU-F

表2 Ⅱ型MIRUs 特异常规引物Ⅱ_MIRU-F 对于痰液样本的恒温扩增Tab 2 Isothermal amplification targeting sputum samples using type ⅡMIRU-specific ordinary primer Ⅱ_MIRU-F
讨论
恒温扩增方法多种多样[13,17],其中主要的方法有依赖核酸序列的扩增反应(nucleic acid sequencebased amplification,NASBA)[18]、依赖解链酶的扩增反应(helicase dependent amplification,HDA)[19]、环介导等温扩增反应(loop-mediated isothermal amplification,LAMP)[7,20]、链置换扩增反应(strand displacement amplification,SDA)[21]和重组酶聚合酶扩 增 (recombinase polymerase amplification,RPA)[22]。这些方法的主要特征是反应体系中含有链置换活性的核酸聚合酶和特殊设计的引物(结合到模板DNA 后便于折叠成特定的二级结构,便于后续的恒温扩增)[13]。这些方法理论上可以恒温扩增任何DNA 靶标。在本研究中,我们发现结合具有链置换活性的DNA 聚合酶(即Bst2.0)和常规引物(即引物无需结合到模板DNA 后折叠成特定的二级结构)即可实现指数级恒温扩增重复DNA 序列(图1 和图3)。本研究丰富了恒温扩增的范畴,即对于重复DNA 序列的扩增,使用其特异的常规引物(同时结合具有链置换活性的DNA 聚合酶)便可实现恒温扩增。本研究所述方法只能靶向恒温扩增重复DNA 序列,而不能靶向恒温扩增非重复DNA 序列。
Ⅰ型MIRUs 的长度约为77 bp,Ⅱ型MIRUs 由Ⅰ型MIRUs 在其3’端缺失24 bp 而成;Ⅲ型MIRUs由Ⅰ型MIRUs 在其5’端缺失15 bp 而成[15-16],因此Ⅱ_MIRU-F 亦可以与Ⅰ型MIRUs 互补配对,Ⅱ_MIRU-R 亦可以与Ⅰ型和Ⅲ型MIRUs 互补配对。也就是说,引物对Ⅱ_MIRU-F/Ⅱ-MIRU-R 理论上可以同时扩增Ⅰ型和Ⅱ型MIRUs,而不能扩增Ⅲ型MIRUs。
基于rDs7 的恒温扩增发现,当上下游引物同时使用时才可成功扩增,而单独使用上游或者下游引物时则不能成功扩增(图1D)。基于Ⅱ型MIRUs 的恒温扩增发现,除了同时使用上下游引物,单独使用上游引物Ⅱ_MIRU-F 亦可成功扩增,而单独使用下游引物Ⅱ_MIRU-R 则不能成功扩增(图3B)。对单独使用Ⅱ_MIRU-F 的扩增产物的测序发现,Ⅱ_MIRU-F 既扮演了上游引物,又扮演了下游引物(图3D)。另外,在MtbH37Rv 基因组有22 个包含Ⅱ型MIRUs 的位点,其中有7 个位点在基因组反向排列,因此正向和反向Ⅱ型MIRUs 一起可以满足Ⅱ_MIRU-F 既扮演上游引物又扮演下游引物[15]。基于rDs7 和Ⅱ型MIRUs 的恒温扩增结果是一致的,即需要上下游引物的同时参与。
MtbH37Rv 基因组中含有41 个MIRUs 位点[15]。这41 个MIRUs 位点亦存在于来自世界不同地域(比如摩洛哥、埃及、俄罗斯、阿曼、巴西、塔希提、巴黎)的25 个Mtb临床分离株,其中12 个位点具有MIRU 拷贝数多态性,而其他29 个位点不具有MIRU 拷贝数多态性[15],因此,MIRUs 广泛存在于Mtb。本研究中,Ⅱ_MIRU-F 能够成功恒温扩增所测试的20 个Mtb临床分离株的DNA(图5)。
恒温扩增方法针对靶标核酸的检测下限至关重要。以一个针对MtbIS6110 的恒温扩增方法(即PSR)为例,反应50 min 的检测下限可低至0.92 pg/μL[12]。相比于引物Ⅱ_MIRU-F/Ⅱ_MIRUR,引物Ⅱ_MIRU-F 能够更加特异地检测Mtb,而不能检测其他菌株(图4、图5)。恒温扩增2 h,Ⅱ_MIRU-F 可检出低至0.4 ng/μL 的MtbH37Rv 基因组DNA;恒温扩增3 h,Ⅱ_MIRU-F 可检出低至40 pg/μL 的MtbH37Rv 基因组DNA(图6)。因此Ⅱ_MIRU-F 对靶标核酸的检测下限明显偏高,且扩增时间较长。进一步发现,当用Ⅱ_MIRU-F 检测痰液样本时,和Xper Mtb/RIF 结果相比,虽然Ⅱ_MIRU-F 可以检测出PTB 患者,但是其亦在对照志愿者的痰液扩增出核酸产物(表2)。基于Ⅱ_MIRU-F 较高的检测下限(图6)、较长的扩增时间及其低特异性(表2),判断其不适合用于临床检测痰液样本。
综上所述,相比于其他恒温扩增方法需要特殊设计的引物,我们发现常规引物可以恒温扩增重复DNA 区段;设计的针对MtbⅡ型MIRUs 的常规引物不适合用于临床检测痰液样本。

