三聚氰胺与牛血清白蛋白相互作用的光谱学研究
杨美玲,崔东亚,牛润华
(运城学院应用化学系,山西 运城 044000)
三聚氰胺[Melamine,C3N3(NH2)3]又名蛋白精,其化学结构见图1。在溶液中呈弱碱性,与三大强酸均能形成三聚氰胺盐,是一种常用的化工产品[1-3]。三聚氰胺具有低毒性,长期服用会导致肾结石和膀胱结石,尤其对免疫力较低的婴幼儿,伤害更大[4,5]。在美国,三聚氰胺作为饲料非法添加剂已被明令禁止使用,主要原因是在2007年曾诱发了当地大量的宠物死亡。目前,对三聚氰胺与血清白蛋白相互作用探讨的文献很少,本试验主要研究了在接近生理条件的基础上,以三聚氰胺和体内血液中蛋白含量较高的血清白蛋白作为作用原型,利用荧光光谱和紫外-可见吸收光谱作为研究工具,研究三聚氰胺与BSA相互作用的荧光猝灭效果和热力学特征,求算其相互作用的相关作用常数和热力学参数,分析两者相互作用的机制,为三聚氰胺中毒的临床病症以及药代动力学的深入研究提供有价值的信息。
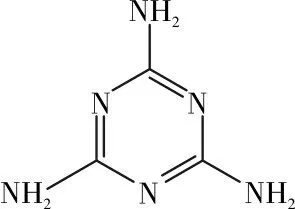
图1 三聚氰胺的分子结构
1 材料与方法
1.1 仪器与试剂
紫外分光光度计(美国Agilent公司,Agilent-8453型);荧光分光光度计(美国PE公司,LS-55型);圆二色谱仪(日本Jasco公司,J-810型);恒温水浴锅(郑州长城科工贸有限公司)。
三聚氰胺三(羟甲基)胺基甲烷(Tris)、浓盐酸等均为分析纯;牛血清白蛋白(BSA)购于国药集团化学试剂有限公司;BSA和三聚氰胺溶液均以pH 7.40、浓度0.01 mol/L的Tris-HCl缓冲液(内含维持离子强度50 mmol/L NaCl溶液)为溶剂配制而成,储备液放入冰箱中待用。试验用水为二次去离子蒸馏水。
1.2 方法
1.2.1 紫外光谱法 在室温下,以Tris-HCl(pH=7.40)缓冲溶液为参比,在300~450 nm内扫描2.00×10-3mol/L三聚氰胺的紫外吸收光谱。
1.2.2 荧光光谱法 在不同温度下,以280 nm为激发波长,扫描三聚氰胺溶液(2.00×10-3mol/L)滴定10.0 mL 3.0×10-6mol/L牛血清白蛋白溶液得荧光发射光谱。
1.2.3 圆二色谱法 以Tris-HCl(pH 7.40)缓冲溶液为参比,在室温下,用浓度为2.00×10-3mol/L的三聚氰胺溶液滴定10 mL 3.00×10-6mol/L的BSA溶液,扫描其190~250 nm的圆二色谱。
2 结果与分析
2.1 紫外-可见光谱分析
图2为三聚氰胺与BSA相互作用的紫外-可见吸收光谱。由图2可知,BSA最大吸收峰在280 nm处,随着三聚氰胺浓度不断增大,BSA吸收强度不断增强,而三聚氰胺在这一范围内没有紫外吸收,说明BSA紫外吸收强度的变化是由于三聚氰胺的加入而引起的,故此可初步判定三聚氰胺和BSA发生了相互作用,形成了一种新的复合物。

图2 三聚氰胺与BSA紫外吸收光谱
2.2 荧光光谱
图3 是不同温度下三聚氰胺与BSA相互作用的荧光光谱,图3中曲线1~9(按照最高荧光强度的峰值由高到低排列)分别代表nBSA∶nMelamine=1∶0,1∶1,1∶2,1∶3,1∶6,1∶9,1∶12,1∶15,1∶18体系。由图3可知,BSA的荧光强度随着三聚氰胺浓度的增大而逐渐减小,而三聚氰胺在300~500 nm基本没有荧光,进一步说明三聚氰胺与BSA之间可发生相互作用形成了新的复合物致使BSA的荧光发生猝灭。
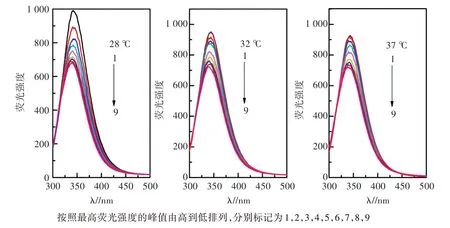
图3 三聚氰胺与BSA的荧光光谱
2.3 荧光猝灭机理
2.3.1 猝灭常数 荧光分子和小分子药物之间相互作用致使荧光物质的荧光强度有所减弱的物理或化学过程称为荧光猝灭或荧光熄灭。荧光猝灭一般可分为静态猝灭和动态猝灭两种。荧光分子和小分子药物之间由于发生碰撞引起荧光强度减弱的是动态猝灭,在这一过程中体系温度升高,扩散系数增大,因此在动态猝灭过程中猝灭常数也会伴随着温度的升高而逐渐增大,但却不会影响到荧光物质的分子结构。而静态猝灭则是荧光分子在基态时就与小分子药物相互作用,从而形成不发荧光的或是荧光很弱的一种新型复合物,从而使得荧光物质的荧光强度逐渐减弱,产生猝灭。但是由于复合物的稳定性会随着温度的升高而减弱,因此在静态猝灭过程中,猝灭常数会随着温度的升高而减小。
通常动态猝灭过程遵循Stern-Volmer方程[6,7]:
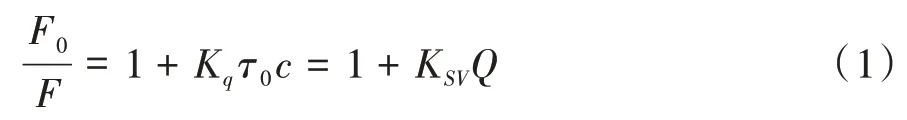
式中,Q为三聚氰胺浓度(mol/L);Kq为三聚氰胺对BSA猝灭过程中的双分子猝灭速率常数(L/mol·s);τ0为猝灭剂不存在时荧光 体生物大分子的寿命,为10-8s[8];F0为没有加入三聚氰胺时BSA的荧光强度;F为加入三聚氰胺后BSA的荧光强度。以Q作为横坐标,F0/F作纵坐标绘制Stern-Volmer曲线,所得曲线斜率即为KSV,如图4所示,若将体系视为动态猝灭,则可通过K SV求得双分子猝灭速率常数K q,具体计算数据见表1。

表1 不同温度下三聚氰胺与BSA相互作用的猝灭常数
一般动态猝灭常数会随着温度的升高而不断增大,但从图4和表1可以看出,在不同温度下,三聚氰胺对BSA的荧光动态猝灭常数K S V随着温度的升高变化不大,而双分子猝灭速率常数Kq却比小分子药物猝灭剂对蛋白质的最大扩散猝灭常数2.0×1010L/mol·s大的多。由此可推断出三聚氰胺对BSA的荧光猝灭不是由于分子碰撞所引起的动态猝灭,而应是由三聚氰胺和BSA二者之间相互作用形成了新的复合物所引起的静态猝灭。
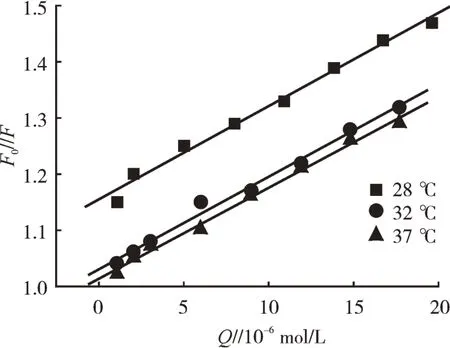
图4 三聚氰胺与BSA相互作用的Stern-Volme曲线
2.3.2 结合常数和结合位点数 在静态猝灭过程中,三聚氰胺分子会在蛋白质分子上n1个相同且独立位置上与其结合,且其结合常数、结合位点数及其对荧光猝灭剂的用量均符合Lineweaver-Burk方程[9]。
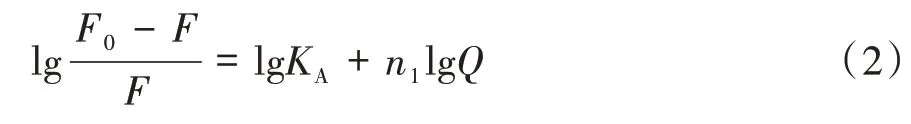
式中,KA和n1分别表示两者的结合常数和结合位点数。以lg(F0/F-1)对lgQ作图,可得图5,依据斜率和截距可以求算出三聚氰胺与BSA相互作用的结合常数KA和结合位点数n1,具体计算数据见表2。由表2可知,三聚氰胺与BSA的结合位点数n1约为1,即1个三聚氰胺药物分子会与1个BSA上的某个位点处结合;而结合常数KA均大于103,说明三聚氰胺与BSA之间的作用力较强。

表2 不同温度下三聚氰胺与BSA的结合常数及结合位点数
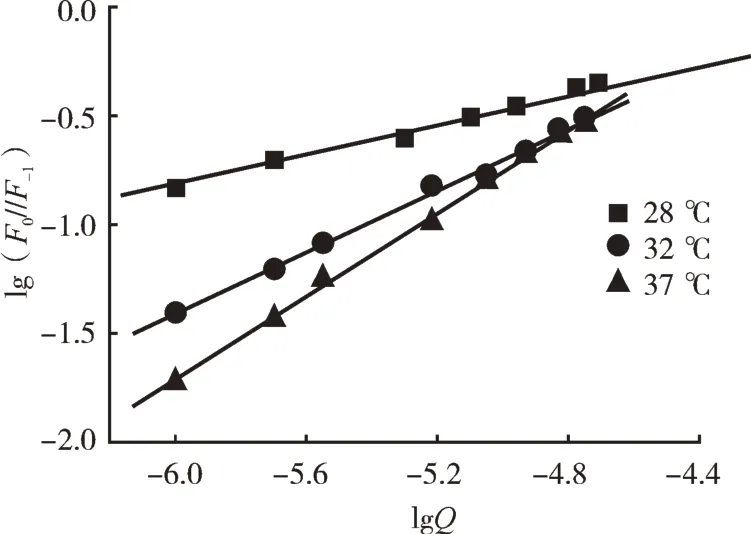
图5 三聚氰胺与BSA相互作用的Lineweaver-Burk曲线
2.3.3 作用力类型的确定 Ross等[10]总结了蛋白质与小分子性质结合存在的热力学规律如下:若ΔH>0、ΔS>0,为疏水作用力;ΔH<0、ΔS>0,为静电作用力;ΔH<0、ΔS<0,可以是氢键结合或通过范德华力结合。当温度上升幅度较小时,反应的标准焓ΔH可以看作常数,根据Gibbs—Helmholtz热力学方程[11,12]式(3)至式(5)分别求得ΔH、ΔS、ΔG,其计算结果见表3。三聚氰胺与BSA结合的焓变ΔH>0、熵变ΔS>0,所以两者之间主要依靠疏水作用力相结合。
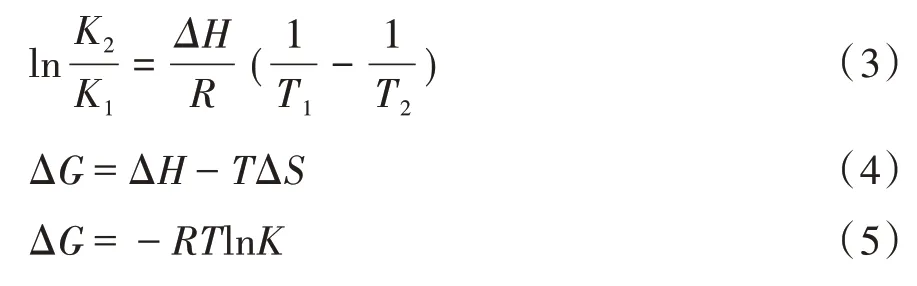
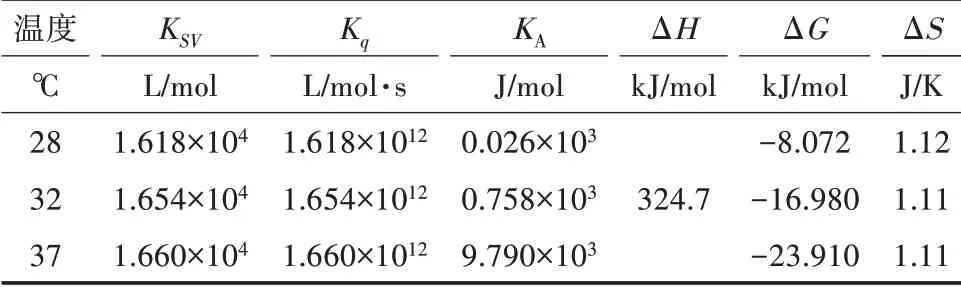
表3 三聚氰胺与BSA在不同温度下相互作用的热力学参数
2.3.4 结合距离的计算 按照Förster能量转移原理,若荧光体的荧光发射光谱和猝灭剂的紫外吸收光谱有重叠部分,且两者之间的结合距离不超过7 nm,则荧光体发生荧光猝灭的主要原因之一是非辐射能量的转移。
图6是三聚氰胺与BSA的荧光光谱和紫外吸收光谱的重叠情况。猝灭剂三聚氰胺和BSA的结合距离r0和它们之间的能量转移效率E及临界能量转移距离R0之间的关系遵循式(6)[12,13]。
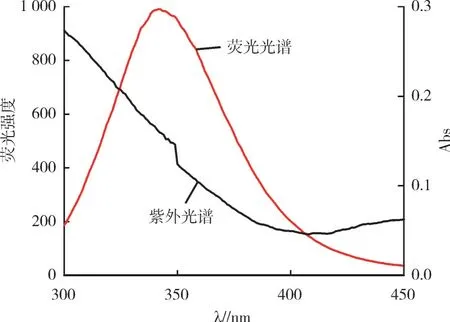
图6 BSA的荧光光谱和三聚氰胺的紫外光谱的重叠

式中,F为BSA和三聚氰胺浓度为1∶1时溶液的荧光强度。
R0与三聚氰胺的荧光量子产率φ、偶极空间取向因子k2以及介质折射指数存在式(7)关系。
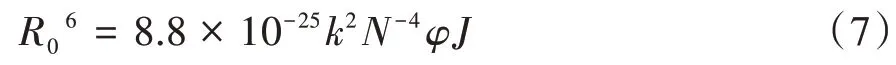
式中,k2=2/3,φ=0.118,N=1.336,J为BSA荧光光谱与三聚氰胺吸收光谱的重叠积分。

2.4 圆二色谱法
圆二色谱法是一种简单、快速、灵敏的研究稀溶液中蛋白质构象的光谱技术。图7给出了不同浓度的三聚氰胺对牛血清白蛋白影响的CD光谱。图7中1曲线为BSA空白,分别在208 nm和222 nm处出现了2个负峰,而随着三聚氰胺浓度的不断增大,BSA的CD光谱的振幅相应明显减弱,说明三聚氰胺与BSA结合后使得BSA的内源荧光减弱,BSA的肽链伸展,α-螺旋减少,二级结构发生了显著的变化[14]。
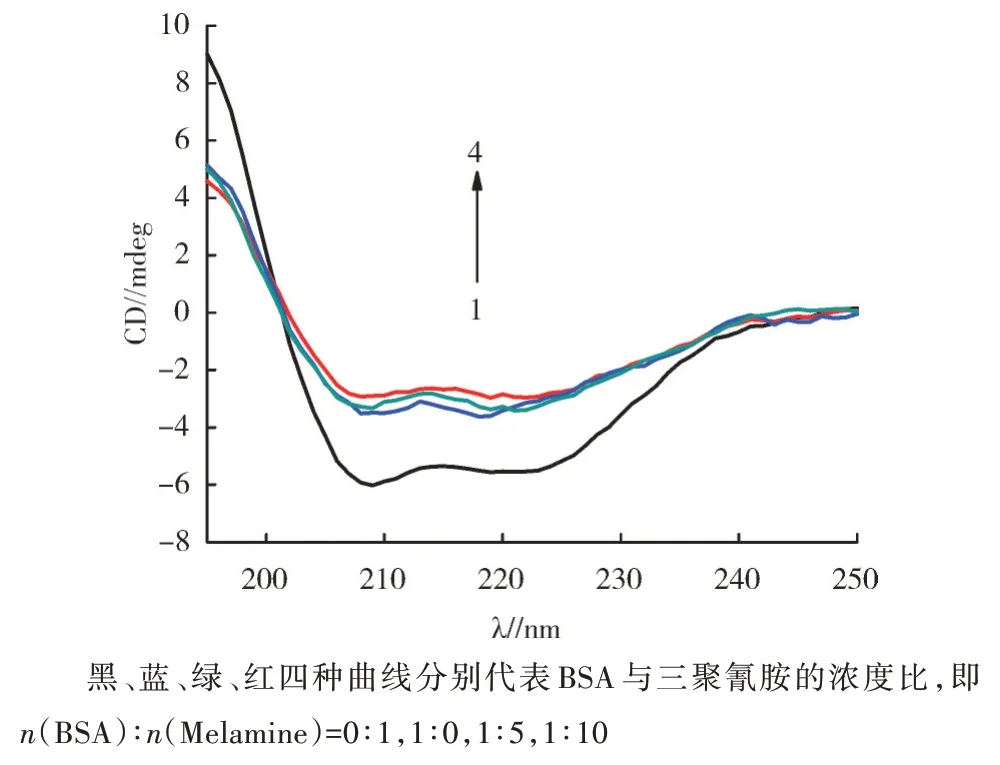
图7 三聚氰胺与BSA相互作用的CD光谱
3 结论
三聚氰胺对牛血清白蛋白的荧光猝灭机理为静态猝灭,二者之间的相互作用力主要为疏水作用力,结合距离为3.7 nm,小于7.0 nm,因此三聚氰胺能使牛血清白蛋白的荧光发生猝灭的主要原因为非辐射能量转移。圆二色谱测试结果表明,三聚氰胺能较大程度地改变牛血清白蛋白的二级结构,因此对牛血清白蛋白具有较强的毒副作用。

