一个黑曲霉细胞色素P450基因启动子的结构与表征
高丽影,马 梅,王艳梅,寇 航,申玉玉,路福平,黎 明
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,工业酶国家工程实验室,天津科技大学生物工程学院,天津 300457)
黑曲霉是一种重要的细胞工厂.自 20世纪初发现黑曲霉在含糖培养基中生长时会产生高浓度柠檬酸以来,黑曲霉被广泛利用生产柠檬酸等有机酸、抗生素等多种次生代谢产物和工业用酶制剂[1].随着生物技术的不断发展,人们开始有目的地对黑曲霉细胞工厂进行合理设计,以满足生产各种目的产物的需要.由于启动子在基因的转录过程中发挥着重要作用,它不仅控制着转录调节的起始,也涉及整个代谢网络的控制,因此启动子的类型及其表达调节是进行细胞工厂设计的基础[2].与其他真菌来源的启动子一样,黑曲霉启动子包括诱导型启动子和组成型启动子.诱导型启动子有化学诱导型[3]和pH诱导型[4]等,组成型启动子有糖化酶启动子[5]、环氧酶启动子[2]等.即使如此,目前关于黑曲霉启动子的数量仍然比较少,因此需要不断挖掘新的黑曲霉基因启动子,这对黑曲霉细胞工厂设计、代谢调控和合成生物学都具有重要意义.
在利用黑曲霉进行甾体羟基化的研究[6]过程中发现:当加入沃氏氧化物(16,17-α-环氧黄体酮)时,甾体羟基化效率加强.转录组分析表明,一种与细胞色素 P450相似的基因转录水平大幅度提高,这说明该基因可能受到一个诱导型启动子控制.BLAST比对表明,该基因与黑曲霉 CBS513.88的 An11c0060重叠群上 An11g01980基因高度相似,基因注释为假定的细胞色素 P450单加氧酶,本实验室研究表明它具有细胞色素 P450基因的功能.该基因与其他来源的细胞色素 P450基因(GenBank号为:XM_025603499、XM_025655375.1)的主要区别在于其 N端多 67个氨基酸.因此,把这个基因称之为细胞色素P450基因.
细胞色素P450(CYP)是一类多功能氧化酶[6],在真核细胞内与内质网、线粒体和高尔基体等细胞器结合形成膜蛋白,是一类含有亚铁血红素的血红蛋白的总称[7].真菌拥有最多样化的CYP家族,因其生物催化作用被广泛应用于生物技术和医学领域[8].在真菌中,CYPs在促进真菌代谢的多功能性方面起着关键作用[9],因此 CYP基因启动子的研究对研究真菌的代谢调节具有重要的意义.目前,已有对细胞色素P450家族 CYP51[10]、CYP6B4和 CYP6B1[11]基因的启动子的研究,发现它们均为化学诱导型的启动子.本研究按照黑曲霉基因组序列,克隆出细胞色素P450基因(An11g01980)的上游序列作为其启动子P450区域进行结构和功能分析.结果表明,P450基因启动子是一个组成型启动子,沃氏氧化物能增强其表达,说明该启动子可能含有与沃氏氧化物相关的反应元件或增强子元件,证明细胞色素 P450不仅仅是诱导型表达,也可以进行组成型表达.本研究旨在提供一种新的细胞色素 P450表达调节方式,为细胞色素P450的表达调节研究以及该启动子的应用提供理论基础.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)JM109、根瘤农杆菌(Agrobacterium tumefaciens)AGL-1、黑曲 霉(Aspergillus niger)41671、质粒 pPZP-Pepo1、pGEM-T均为本实验室保存.
1.1.2 主要试剂与工具酶
DNA 聚合酶、限制性内切酶 HindⅢ、AvrⅡ、连接酶,Takara公司;质粒快速提取试剂盒、DNA纯化回收试剂盒、切胶回收试剂盒,Omega公司;通用型柱式基因组提取试剂盒,北京康为世纪生物科技有限公司;蛋白胨和酵母浸粉,Oxoid公司;底物荧光素(D-Luciferin),Abcam 公司;其他试剂均为国产分析纯.
1.1.3 培养基
LB 培养基(g/L):胰蛋白胨 10,酵母提取物 5,NaCl 10,121℃高压蒸汽灭菌20min.
PDA培养基:土豆去皮,切块,按1﹕4加水煮沸30min至土豆块变软,用 8层纱布过滤,滤液定容至原体积,在滤液中加入2%葡萄糖,115℃高压蒸汽灭菌 20min.
麦芽汁培养基:将 130.1g麦芽汁培养基固体粉末溶于水中并定容至1L,121℃灭菌20min.
诱导培养基(IM)[12]:K buffer 0.8mL,MN buffer 20mL,1% CaCl2·2H2O 1mL,0.01% FeSO410mL,微量元素 5mL,20% NH4NO32.5mL,50%甘油10mL,1mol/L MES 40mL,20%葡萄糖 10mL,pH为5.5,加900.7mL无菌水定容至1L.
K buffer:用 1.25mol/L KH2PO4调节 1.25mol/L K2HPO4至pH为4.8,121℃灭菌20min.
MN buffer:溶解 3g MgSO4·7H2O 和 1.5g NaCl于去离子水并定容至100mL,121℃灭菌20min.
IM培养基微量元素:将100mg Na2MoO4·2H2O、100mg ZnSO4·7H2O 、100mg H3BO3、 100mg CuSO4·5H2O、100mg MnSO4·H2O 溶解于去离子水,定容至1L,121℃灭菌20min.
完全培养基(CM):称取 20g琼脂,加水至897mL;高压灭菌后加入 ASP+N 20mL、50%葡萄糖 20mL、1mol/L MgSO42mL、微量元素 1mL,酪蛋白氨基酸 10mL和酵母提取物 50mL,制成 1L CM培养基.
ASP+N:溶解 2.61g KCl(350mmol/L)、7.48g KH2PO4(550mmol/L)、29.75g NaNO3(3.5mol/L)于去离子水中,用5mol/L KOH调节pH为5.5,用去离子水定容至100mL,121℃灭菌20min.
CM 培养基微量元素:将 2.1g ZnSO4·7H2O、0.15g Na2MoO4·2H2O 、0.5g FeSO4·7H2O 、1.1g H3BO3、0.17g CoCl2·6H2O 、5.1g EDTA 、0.16g CuSO4·5H2O、0.5g MnCl2·4H2O 溶解于去离子水,定容至100mL,121℃灭菌20min.
1.2 方法
1.2.1 启动子的克隆与结构分析
根据黑曲霉 CBS513.88的 An11g01980基因的上游区域设计引物 EP1079F:5′-GTCTAAGCTT CAG TTGGGTCTTGGAAGGGCA-3′(下划线部分为加入的 HindⅢ酶切位点)和 EP-1R:5′-GAGAGACCTAG GTGCTGGAGTGGGTAGCAAAAGGC-3′(下划线部分为加入的 AvrⅡ酶切位点).提取黑曲霉基因组为模板进行 PCR扩增,扩增条件:95℃预变性 5min;95℃变性 30s,55℃退火 30s,72℃延伸 1min,30个循环;72℃延伸5min.扩增出细胞色素P450基因的启动子片段命名为 PP450,将 PP450片段连接到pGEM-T载体上构建出 pT-PP450并进行测序;再将其在启动子分析网站 GPMiner(http://gpminer.mbc.nctu.edu.tw/index.php)和 EMBOSS(https://www.ebi.ac.uk/Tools/emboss/)上进行结构和功能分析[13].
1.2.2 载体的构建与鉴定
将 pT-PP450载体用 HindⅢ和 AvrⅡ酶切,回收启动子片段并将其连接至经相同酶切的表达载体pPZP-Pepo1,转化至E. coli JM109感受态细胞,转化子经卡那霉素抗性筛选,挑选阳性转化子进行菌落PCR并提质粒酶切验证.将验证正确的含 PP450质粒命名为pPZP-PP450.
1.2.3 根瘤农杆菌介导黑曲霉的转化和验证
取 0.5µL pPZP-PP450质粒加入根瘤农杆菌AGL-1感受态混匀,冰浴 20min后转入电转杯,1800V电击后立即加复苏液,混匀吸出并在28℃摇床复苏 3h后,涂布在含 100µg/mL的卡那霉素和20µg/mL的利福平抗性平板;28℃培养3d至转化子长出后,用荧光素酶基因验证引物(Luc-F:5′-GGAC GCCAAGAACATCAAGAAGGG-3′,Luc-R :5′-CGA AGAAGGAGAAGAGGGTGGGGA-3′)进行菌落 PCR验证,得到正确的根瘤农杆菌转化子.
黑曲霉菌株在 PDA斜面上于 35℃孵育 3d,孢子萌发后用生理盐水洗脱并过滤至含少量玻璃珠的锥形瓶中打散,用血球计数板测定孢子液浓度,并在IM 液体培养基中稀释至每毫升 1×107个分生孢子.同时,将根瘤农杆菌转化子在含有 20µg/mL利福平和100µg/mL卡那霉素的10mL LB液体培养基中 28℃、200r/min摇床孵育 24h,在室温下 2400g离心培养物(1.5mL)10min,再将细胞重悬于 5mL含5µL的0.2mol/L乙酰丁香酮(AS)的液体IM中,28℃、100r/min孵育 5~8h至 A600为 0.6~0.8.将100µL诱导的农杆菌细胞和100µL的真菌分生孢子液(1×107mL-1)混合,将混合物涂布至含 AS的 IM培养基平板的硝酸纤维膜上,于 24℃在黑暗中培养3d.之后,将硝酸纤维膜转移至选择培养基(含有潮霉素抗性和 200µmol/L头孢噻污的 CM)中,35℃黑暗培养5d,直到出现单菌落.转接单菌落3次,用微波法提取黑曲霉转化子基因组[14],用荧光素酶基因验证引物进行 PCR验证筛选[15],得到验证正确的黑曲霉转化子.
1.2.4 启动子的强度检测
按照利用荧光素酶为报告基因检测黑曲霉启动子特性的方案进行启动子强度检测[16-17],但根据本研究的具体需要略有修改.将验证正确的黑曲霉转化子和出发菌株同时在PDA斜面上活化,培养约3d长出黑色孢子后洗下孢子并计数至 1×107mL-1.接种100µL孢子液于48孔深孔培养板中,35℃振荡培养.转化子菌株培养分为 3组,即不添加沃氏氧化物组、添加 10µg/mL的沃氏氧化物组、添加 30µg/mL的沃氏氧化物组,每组3个平行.培养12h后在每组培养孔中分别添加 10µL沃氏氧化物溶液或者其溶剂,使 3组中的沃氏氧化物的终质量浓度分别为 0、10、30µg/mL,以诱导 P450启动子控制的荧光素酶基因的表达.继续培养 12h后在各培养孔中添加100µL底物荧光素溶液(终浓度为 1.4mmol/L).以没有转化的黑曲霉出发菌株为对照,按照同样培养方式进行,只是添加的沃氏氧化物的终质量浓度为10µg/mL.添加沃氏氧化物底物后,将培养板放进SpectraMax i3X型酶标仪,用537nm波长每隔5min或 10min测定荧光强度.荧光强度越高,表明 P450启动子控制的荧光素酶基因表达量越高,说明启动子活性越强.由于各种影响因素控制一致,因此直接用荧光强度表示启动子的相对强度.
2 结果与分析
2.1 启动子的克隆与结构分析
以黑曲霉基因组为模版,以引物EP1079F和EP-1R扩增目的片段PP450,结果如图1所示.结果与理论大小(1080bp)一致,证明目的片段 PP450克隆成功.

图1 PP450片段的扩增Fig. 1 Amplification of PP450 fragment
将 PP450片段连接到 pGEM-T载体上构建出pT-PP450并进行测序.测序结果表明,克隆的 PP450序列长 1080bp,与报道的 An11g01980基因上游序列完全一致.用启动子分析网站 GPMiner和EMBOSS对 PP450片段进行结构分析,结果如图 2所示,其中阴影部分为预测的启动子元件,TSS为转录起始位点.

图2 PP450片段的分析Fig. 2 Analysis of PP450 fragment
在翻译起始位点上游 43bp处为可能的转录起始位点(TSS),在 TSS上游有两个可能的 TATA盒,它们与 TATA盒的保守序列 TATAAAA并不完全一致但高度相似;PP450上还有6个可能的CAAT盒,其中 2个 CAAT盒与其保守序列基本一致,其余 4个 CAAT盒与其保守序列也高度相似;另外,还有 2个 GC盒在 PP450的负链上;PP450片段的-864~-106bp处有一段长为 759bp的 CpG区域.特别有趣的是,在PP450上还发现转录因子AmyR的 1个可能的结合位点序列 CCGTATATGGTCCG,这个序列是否真的能结合转录因子 AmyR并参与转录调节,还需要实验证实.PP450启动子元件的具体信息见表1.
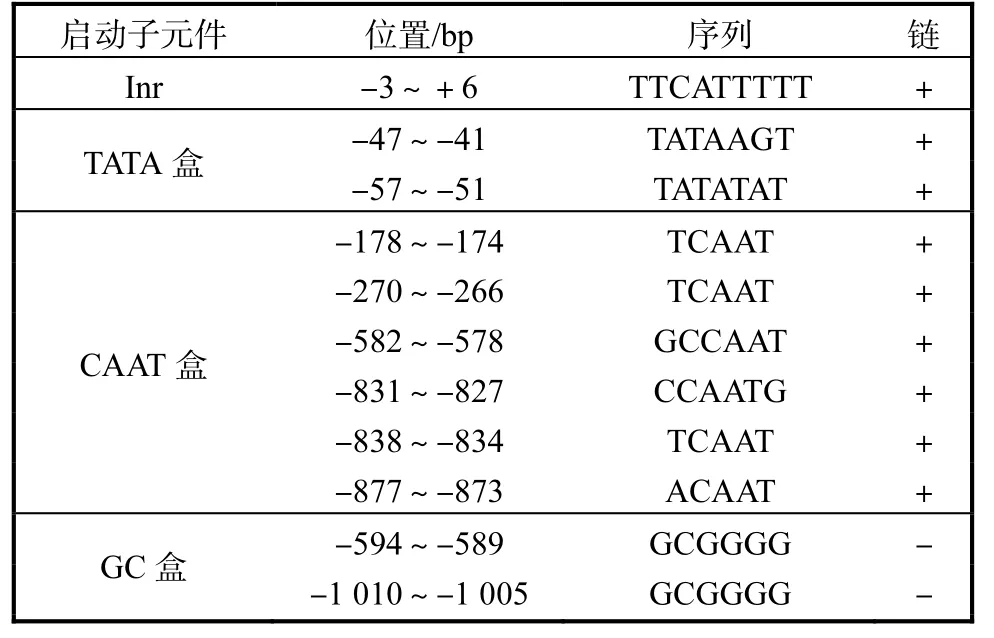
表1 PP450序列的启动子元件Tab. 1 Promoter elements of PP450 sequence
2.2 pPZP-PP450载体的构建与鉴定
将pT-PP450载体与pPZP-Pepo1载体均经HindⅢ、AvrⅡ双酶切和连接后构建成所需要的目的载体pPZP-PP450,转化大肠杆菌 JM109感受态细胞后,经Kana抗性筛选,挑取阳性转化子提质粒并用HindⅢ和 SpeⅠ进行双酶切验证,结果如图 3所示.条带与理论大小(10000bp和 3000bp)一致,说明目的载体pPZP-PP450构建成功.

图3 pPZP-PP450载体的酶切鉴定Fig. 3 Identification of pPZP-PP450 vector by digestion
2.3 黑曲霉的转化和验证
将 pPZP-PP450质粒电转入根瘤农杆菌感受态,将电转液涂布于抗性平板,挑取阳性转化子用荧光素酶验证引物进行菌落 PCR验证,结果如图 4所示.条带与理论大小(880bp)一致,证明 pPZP-PP450载体成功电转入根瘤农杆菌中.

图4 pPZP-PP450载体电转根瘤农杆菌的鉴定Fig. 4 Identification of pPZP-PP450 vector electrotransformed in A. tumefaciens
将转化成功的根瘤农杆菌与黑曲霉共培养并涂布于抗性平板,挑取单克隆转化子传代并用验证引物进行 PCR验证,结果如图 5所示.条带与理论大小(880bp)一致,说明 pPZP-PP450载体成功转化至黑曲霉中.

图5 pPZP-PP450载体转化黑曲霉的鉴定Fig. 5 Identification of pPZP-PP450 vector transformed in A. niger
2.4 启动子荧光强度的测定
将转化成功的黑曲霉转化子与出发菌株分别在48孔板中培养12h,在相应的培养孔中添加10µL诱导剂沃氏氧化物溶液并使其在不同组中的终质量浓度分别为 0、10、30µg/mL,24h后均添加 100µL 底物荧光素溶液并进行荧光检测,结果如图6所示.
从图6可以看出:出发菌株中添加诱导剂和底物后没有检测到荧光信号,说明诱导剂和底物都不产生荧光信号,出发菌株中没有荧光素酶基因表达.当黑曲霉转化子的培养物中只添加底物不添加诱导剂时,检测到非常强的荧光信号,说明 PP450启动了荧光素酶基因的表达,表明 P450启动子是一个组成型的启动子.当黑曲霉转化子的培养物中分别加入10µg/mL和 30µg/mL的诱导剂时,荧光信号随着诱导剂浓度的增加而增强,表明 P450启动子还受到沃氏氧化物的诱导调节.这说明 PP450中可能含有与沃氏氧化物有关的反应元件或增强子元件.

图6 荧光强度检测Fig. 6 Fluorescence intensity detection
3 结 语
根据前期的转录组学研究,从黑曲霉基因组克隆出细胞色素 P450基因(An11g01980)的上游片段PP450,并进行结构和功能分折.结构分析表明,该片段具有RNA聚合酶Ⅱ启动子的结构特征:含有1个标准的起始子序列,起始子上游含有 2个可能的TATA盒、2个CAAT盒和4个与CAAT盒一致序列高度相似 CAAT盒以及 2个 GC盒等启动子元件.PP450片段的-864~-106bp处有一段长为759bp的CpG区域.而且,在 PP450上还发现 1个转录因子AmyR的结合位点序列 CCGTATATGGTCCG.功能检测表明,PP450启动子是一个组成型启动子,但添加诱导剂沃氏氧化物后启动子表达强度增强,推测该启动子区域可能含有沃氏氧化物相关的反应元件或增强子,需要进一步实验进行验证.PP450启动子功能的阐明为研究细胞色素P450基因的表达调节方式和PP450启动子的应用奠定了基础.
致谢:感谢刘晓光教授对启动子分析的指导!

