床旁肺部超声评分对机械通气患儿撤机结局的预测价值
张雯澜 傅丽娟 王 莹 任 宏 陆 红 沈南平 陆 华 孙霁雯
1.上海交通大学护理学院(上海 200025);2.上海交通大学医学院附属上海儿童医学中心(上海 200127)
机械通气是救治重症患儿生命的重要手段,但长时间的机械通气易导致不良并发症,其中以呼吸机相关性肺炎最为多见,与患儿的不良预后高度相关[1]。早期撤机是有效的预防方法,成人ICU撤机指南建议对重症患者实施基于自主呼吸试验(spontaneous breathing trials,SBT)的程序化撤机法[2]。但研究表明程序化撤机并未明显缩短重症患儿的置管时间,同时存在较高的撤机失败率,仍有2%~20%的患儿发生撤机失败[3]。重症患儿的撤机与充分做好患儿的撤机准备评估密切相关,但以往常用的呼吸氧合指标评估在儿童撤机中的预测价值有限[4]。床旁肺部超声近年来被广泛应用于重症监护病房。床旁超声诊断肺脏疾病的国际共识(2012)[5]中提出,肺部超声比传统的胸部X线具有更高的敏感性和准确性,肺部超声征象的变化要比氧合的下降更早发生,基于超声技术的肺部超声评分(lung ultrasound score,LUS)能够量化、准确、动态地评估和监测患者的肺部情况。本研究旨在应用床旁LUS辅助评估患儿的撤 机准备度,探讨LUS对于撤机结局的预测价值。
1 对象与方法
1.1 研究对象
采用便利抽样方法,选取2019年1—12月在PICU住院的机械通气患儿。纳入标准:①有创机械通气超过48小时;②进行程序化撤机的患儿。排除标准:①气道狭窄、气道受压迫或解剖结构异常;②胸部皮肤大面积破损、烧伤;③中枢性呼吸衰竭;④严重肌无力及无自主膈肌活动;⑤青紫型先心患儿;⑥非计划性拔管的患儿;⑦终末期或死亡患儿。
本研究通过医院医学伦理委员会批准。
1.2 研究方法
1.2.1 程序化撤机条件[3]每日选择符合自主呼吸试验标准(动脉血PaO2>60mmHg,PaCO2<50mmHg,PaO2/FiO2>150;呼吸频率<30次/min;呼吸机参数潮气量>5mL/kg,FiO2<0.5,PEEP<5cmH2O,PIP<15 cmH2O)的患儿进行SBT并准备撤机。对每个患儿进行肺部及膈肌活动度的超声评估以排除两侧膈肌不活动的情况,膈肌没有明显自主活动的患儿不符合撤机条件予排除。
1.2.2 撤机失败定义 撤机失败指患儿撤机后48小时内无法维持有效的自主呼吸,需要再次气管插管使用机械辅助通气[2]。
1.2.3 肺部超声评分 采用基于体表分区的肺部超声(失气化)评分法,根据中国重症超声研究组发布的重症超声临床应用技术规范指南[6],将两侧肺在患者体表分为上、下、前、中、后共12个评估区域(图1),利用床旁超声机评估患儿12个区域的肺部病情。根据肺部超声的四大类征象可将肺部通气功能丧失(失气化)的程度由轻到重分为4类(图2),对每个区域内最严重的超声征象予以相应的赋值评分(表1),将12个区域评分相加所得的总分即为肺部超声(失气化)评分(LUS)[7]。
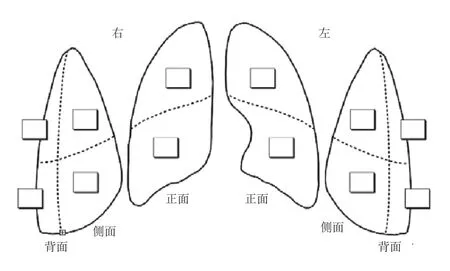
图1 肺部超声12区分区方法
1.2.4 资料采集 临床资料采集包括年龄、性别、诊断、危重度评分、血气分析、机械通气时间及PICU住院时间。LUS由肺部超声研究小组成员使用便携式床旁超声机(索诺声M-TURBO第四代)完成。对符合纳入标准的患儿在其撤机前进行肺部超声评估,保存患儿肺部超声图像并对其进行赋值评分,再由督导师通过对图像进行复核,审核后采用。同时在患儿撤机前记录其氧合指数(P/F值=PaO2/FiO2)和浅快呼吸指数[RSBI值=呼吸频率/(潮气量/体质量)],并随访记录患儿的撤机结局。
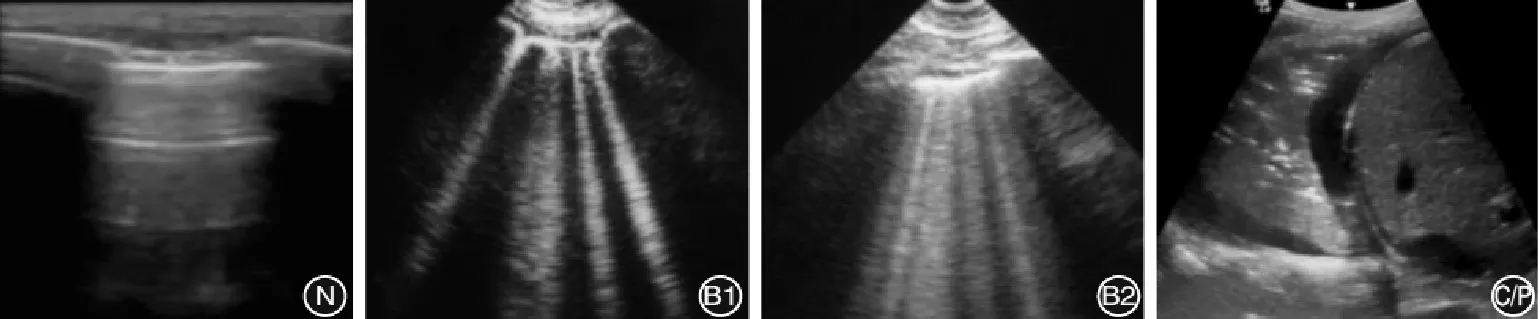
图2 肺通气功能丧失程度分类

表1 肺部超声(失气化)评分方法
1.3 统计学分析
采用SPSS 23.0和Medcalc 18.0统计软件进行数据处理。非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验。计数资料以百分比表示,组间比较采用χ2检验或Fisher精确概率法。LUS对撤机结局的预测采用受试者工作特征曲线(ROC)分析,预测价值采用曲线下面(AUC)进行评价。不同评价指标的联合预测价值采用串联形式的ROC分析,通过计算每个评价指标所对应的预测概率,以预测概率进行ROC分析,并计算AUC。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
共入组106例患儿,男62例、女44例,中位年龄为9(3,36)月,≤3岁81例(76.4%)。中位住院天数15天(10,25)天,中位置管时间10天(7,15)天。撤机成功97例(91.5%);撤机失败9例(8.5%),其中未进行手术治疗的先天性心脏病患儿5例。与撤机成功组相比,撤机失败组PICU入住时间、置管时间延长,危重度评分降低,差异均有统计学意义(P<0.05)。见表2。
2.2 撤机成功组与失败组拔管前LUS及相关氧合功能指标比较
106例患儿均存在自主膈肌活动。与撤机成功组相比,撤机失败组的LUS和RSBI较高,P/F较低,差异均有统计学意义(P<0.05)。见表3。
2.3 LUS及相关氧合功能指标对不同撤机结果的预测价值
由表4和表5所示,将LUS、RSBI、P/F与撤机结局进行ROC曲线分析,当LUS截断值≥16分时预测撤机失败的AUC最大,为0.991、灵敏度为88.9%、特异度97.9%;当P/F ≤215时预测撤机失败AUC为0.948、灵敏度为77.8%、特异度为93.8%;当RSBI>7.4时预测撤机失败AUC为0.950、灵敏度为66.7%、特异度为93.8%;当LUS联合P/F和RSBI预测撤机失败时最大,为0.994、灵敏度89.0%、特异度95.9%(P均<0.01)。LUS与P/F、RSBI的AUC差异有统计学意义(P<0.05),与三项联合预测的AUC差异无统计学意义(P>0.05)。见图3。
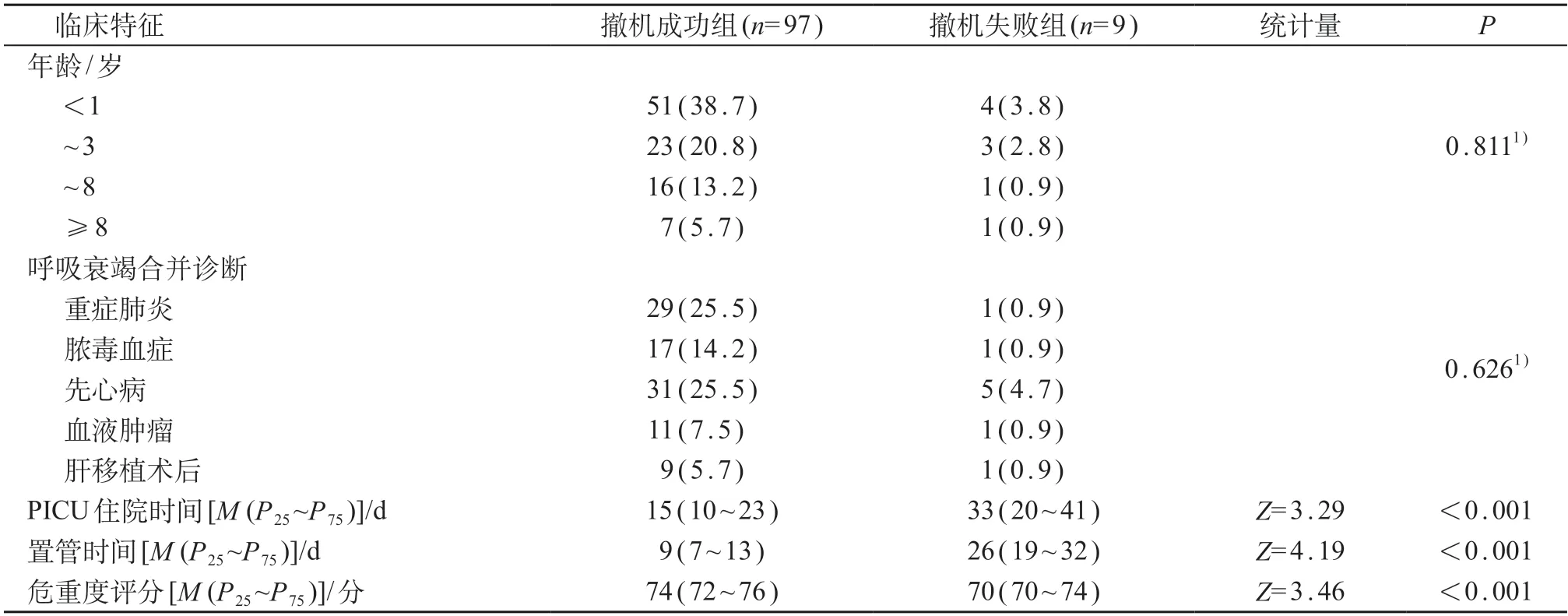
表2 106例PICU患儿临床基本资料 [n (%)]

表3 撤机成功组与失败组患儿拔管前LUS、P/F、RSBI比较 [M(P25~P75)]
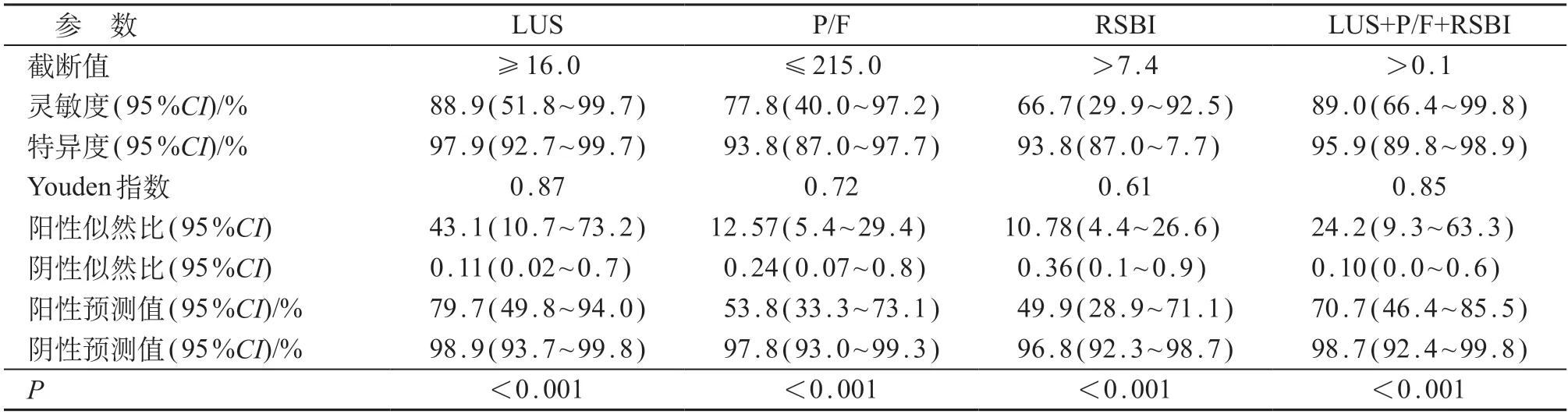
表4 参数对撤机失败发生的预测效能评价
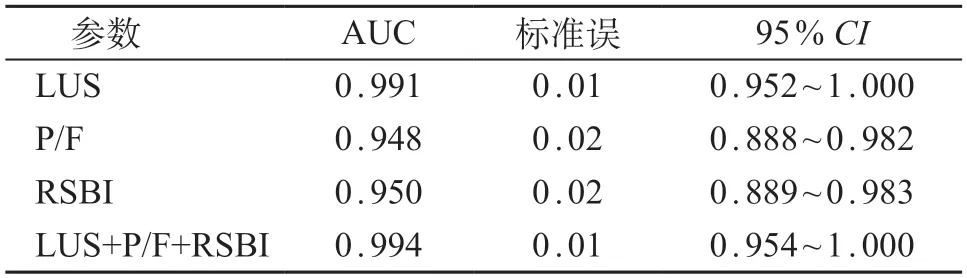
表5 各参数预测撤机结局的AUC比较
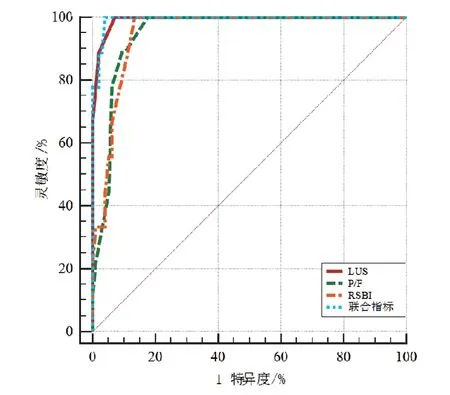
图3 各评估指标的ROC曲线
3 讨论
应用有效的评估方法对患儿潜在的撤机失败风险进行预测是近年来的研究重点。根据欧美呼吸学会的推荐意见,基于SBT的程序化撤机被认为是帮助危重患者尽早撤机的有效手段[8]。但相关研究显示,程序化撤机对儿科患者的应用价值有限[9],并未显著缩短置管时间,也未明显改善患儿的撤机结局[10],仍有约为9.8%~15.1%通过SBT的患儿发生撤机失败[11]。本研究中撤机失败发生率为8.5%,与文献报道相近。前期的研究较多针对应用呼吸氧合功能指标对患儿能否成功撤机进行预测,但因受到年龄和体质量的影响,儿童中尚未有明确的参考范围及预测价值[12-14]。本研究采用ROC曲线分析、比较LUS与几种不同评估指标对撤机结局的预测作用。结果显示,单独应用LUS预测患儿撤机失败的AUC为0.991、灵敏度88.9%、特异度97.9%,相较于P/F与RSBI更具有显著的预测优势。当LUS联合P/F及RSBI进行预测时,AUC为0.994、灵敏度为89%、特异度为95.9%,相较于单独应用LUS进行预测并未显现出明显的优势。国外研究显示,成人ICU中应用LUS能较好地预测患者能否成功撤机,灵敏度在84%~96.4%[15],与本研究结果相近。因肺部超声征象能较客观地反映患者肺部病情的本质和疾病的进展过程,与呼吸氧合功能指标相比,不容易受到呼吸机参数的影响,因此应用LUS能较客观地对患儿的撤机准备度进行评估[16],可独立作为一项准确估计撤机失败风险的无创评估工具。
LUS是基于患者肺部通气面积丧失程度多少予以赋值评分的半定量评估方法[6-7],这一方法准确描述了肺部通气面积与换气功能的非线性关系。66%的通气面积可以代偿约90%的换气功能,33%的通气面积可以代偿约60%的换气功能,但肺通气面积本身无法代偿,需经过有效治疗后缓慢恢复[17]。LUS越高代表肺通气面积受损越严重,与肺部病情严重程度呈良好的正相关[18]。在本研究中,撤机失败组患儿的LUS在拔管前与成功组存在明显差异,表明失败组患儿肺通气面积受损程度比成功组严重。且撤机失败组以未经手术治疗的先天性心脏病患儿居多,占总撤机失败人数的55.6%。正压通气时因回心血量减少而缓解了心脏负荷,但拔管后回心血量的突然升高易导致心功能不全患儿发生心源性呼吸困难[19]。其次,拔管后左向右分流的增加,尚未恢复功能的肺泡因失去正压支持,肺充血加重而出现塌陷,进而影响了肺部的氧合功能,较易导致患儿发生撤机失败。本研究发现,当LUS≥16分为预测儿童撤机失败的最佳界值,代表此时即使患儿通过了自主呼吸试验仍然存在较大的撤机失败风险,尤其对于先天性心脏病患儿,应谨慎考虑患儿的撤机时机或撤机方式。
此外,床旁肺部超声技术具有无创和无放射性的优点,可在临床反复使用。相较于胸片,超声能够更早期、客观、准确、动态地评估和监测患儿的肺部具体的病变部位情况,帮助指导医疗人员在相应的体表区域进行准确定位,对患儿实施精准的肺康复治疗[20],并减少患儿放射暴露。因此,当LUS评分<16分时,虽然提示患儿具备了一定的撤机条件,但仍有部分肺组织存在通气和换气功能不足,应早期开始重视对尚未恢复的局部肺病变区域施针对性康复治疗,如体位管理、胸部物理治疗等以加快患儿的肺功能恢复。同时,撤机后48小时内也是患儿病情变化的关键时期,仍应利用肺部超声动态监测患儿的肺部病情变化,帮助患儿顺利渡过撤机后的恢复期,减少再插管的发生。
本研究仍有不足之处,肺部超声对气道病变识别能力有限,因此气道病变被本研究排除在外,但其也可能是撤机失败的原因之一,在临床中需要重视。
综上所述,重症患儿的肺部病变具有多样性、分布不均一性、病情变化快等特点,以往评估方法的不足使得医务人员无法为患儿可能存在的撤机失败的风险作出准确的评估。随着近年来对肺部超声研究和认识的加深及推广,医务人员在接受规范化培训、掌握肺部超声的技能后,利用肺部超声能更精准地作好充分的肺部病情评估和撤机准备。

