miR-320a调控非小细胞肺癌细胞的上皮细胞间质化过程研究
王丽娟,胡 倩,薛海霞
肺癌是世界范围内最常见的恶性肿瘤之一,其中,非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌发病率的80%以上[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞向间质细胞转化的过程,从而具备间质细胞的游走迁移和浸润能力[2]。上皮源性的肿瘤细胞可通过EMT过程获得相应的迁移与侵袭能力,这在肿瘤的转移中发挥着重要作用[3]。microRNA(miRNA)是一类内源性表达的非编码RNA,可以对靶基因3’-UTR端进行特异性识别,从而对下游靶基因进行降解或者阻断靶基因的翻译,在恶性肿瘤的发展中发挥重要作用[4]。miR-320a是miRNA家族成员,已被证实在卵巢癌[5]、宫颈癌[6]等多种恶性肿瘤的发展过程中有调控作用,同时,有研究证实miR-320a能抑制NSCLC细胞的增殖[7],但其对NSCLC细胞的EMT过程是否有调控作用,尚未见报道。本研究探讨了miR-320a与NACLC细胞EMT活性的关系,为NSCLC的临床治疗寻找新的靶点。
1 对象与方法
1.1 对象 选取2017-07至2018-12在我院住院并进行手术治疗的NSCLC患者60例,术中取切除的肺癌组织标本和距癌组织5 cm以上距离的手术远端切缘的癌旁组织,所有患者均经组织病理学确诊为NSCLC并首次进行切除手术,术前未经放疗、化疗等辅助治疗。纳入研究的患者基线资料:平均(59.3±10.3)岁,其中60岁以上24例(40.0%),60岁以下36例(60.0%);男35例(58.3%),女25例(41.7%);按照国际抗癌联盟(Union for International Cancer Control,UICC)与美国癌症联合会(American Joint Committee on Cancer,AJCC)2017年联合发布的第八版TNM分期标准分期:Ⅰ、Ⅱ期36例(60.0%),Ⅲ、Ⅳ期24例(40.0%);组织分化程度:高中分化32例(53.3%),低分化28例(46.7%);有淋巴结转移者29例(48.3%),无淋巴结转移者31例(51.7%)。所有纳入研究的患者均由本人签署知情同意书,本研究经过我院伦理委员会批准。
1.2 试剂与器材 人源性NSCLC细胞系A549购于中科院上海细胞库;Trizol试剂盒、RIPA裂解液、Transwell小室购于上海Abcam公司;兔抗人E-cadherin、Vimentin、FoxM1一抗、辣根过氧化物酶标记的羊抗兔二抗、LipofectamineTM2000转染试剂盒购于美国Invitrogen公司;双荧光素酶报告基因检测系统试剂盒购于美国Fementas公司;miR-320a模拟物(mimics)、miR-320a抑制物(inhibitor)及对照(normal control, NC)序列由由广州锐博生物公司合成。
双人水平超净工作台(上海巴玖实业有限公司);二氧化碳细胞孵育箱(美国Thermo公司);低温高速离心机(美国Thermo公司);S1000型PCR扩增仪(美国BIO-RAD公司);电转仪系统(美国Bio-Rad公司);DYC-p32型电泳仪(上海巴玖实业有限公司);转膜仪(南京生兴生物经济技术有限公司);图像记录分析系统:大连Jim-X Scientific,普通光学显微镜(日本Olympus,CKX53)。
1.3 免疫组化 将癌组织和癌旁组织切片脱蜡,PBS洗涤,柠檬酸抗原修复10 min后,冷却,室温下用3%H2O2封闭内源性过氧化物酶20 min,PBS洗涤,每张切片加50 μl山羊血清,常温下封闭内源性生物素20 min,每张切片加相应一抗,4 ℃孵育过夜,PBS洗涤,加二抗,37 ℃反应2 h,PBS洗涤,脱水,封片,普通光学显微镜下采集图片,Image Pro Plus 6.0定量分析。
1.4 细胞复苏与转染 将A549细胞复苏、重悬,用含10%FBS的RPMI-1640培养液常规培养,取对数期细胞接种于6孔板,待细胞融合度达到80%以上时用LipofectamineTM2000将miR-320a mimics、miR-320a inhibitor及miR-320a NC序列转染至A549细胞中,Opti-MEM 培养液替换常规培养液,转染8 h后换为常规培养液。
1.5 划痕实验 将转染后A549细胞于不含FBS的RPMI-1640培养液中饥饿处理12 h;用10 μl的移液枪头垂直于板面划痕,之后每4 h观察一次细胞迁移状态,于倒置荧光显微镜下拍照,用作图软件处理,计算每组细胞24时和0时的划痕宽度之比,以划痕愈合率代表细胞迁移能力,划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。每组细胞设置6个复孔,取平均值。
1.6 Transwell小室实验 将转染后A549细胞于无血清培养基饥饿处理12 h,小室使用前用无血清培养基提前孵育1 h,基质胶水化后,吸取培养基,将细胞悬液接种于Transwell上室,接种细胞浓度约2×105个/ml,24孔板下室加入600 μl含5%FBS的RPMI-1640,培养24 h,结束后,取出Transwell小室,弃去孔中培养液,用无钙PBS洗2遍,之后上室100 μl,下室600 μl多聚甲醛固定20 min,将小室适当风干。0.1%结晶紫染色20 min。用棉签蘸取甲醇轻轻擦掉上层未迁移细胞,再用PBS洗3遍,晾干。400倍显微镜下随即五个视野观察细胞,记数。
1.7 RT-PCR 取冻存的癌组织和癌旁组织于液氮预冷的研钵中研磨成粉末,加1 ml Trizol,按说明书中所示步骤提取总RNA,行反转录反应。取2 μl RNA进行PCR扩增:内参β-actin引物序列:F:5′-TCGGCTTAGCTAGCCTAGCAC-3′,R:5′-TAGCTTAGCTTAGCACCAAC-3′,miR-320aa引物序列:F:5'-GCTTAGCTAACGATCCACCA-3′,R:5′-TAGGCTTAGCTAGCCATCGA-3′,扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。取5 μl PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,Image Pro Plus 6.0分析目的基因和参比基因的条带灰度值比值。
细胞实验中将各组细胞转染24 h后,取离心并洗涤后的细胞,Trizol提取总RNA,后续步骤同上,检测miR-320a基因表达。
1.8 Western Blot 将各组细胞转染24 h后,RIPA裂解液提取总蛋白,将蛋白样品加入SDS-PAGE凝胶加样孔进行电泳,使蛋白转移至PVDF膜,5%脱脂奶室温封闭2 h,TBST温和洗膜3 min后加入相对应的一抗,4 ℃孵育过夜,TBST洗涤10 min×3次,加入二抗,室温下孵育1 h,TBST洗涤10 min×3次,加入配制好的ECL发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息,图片用Image pro plus 6.0软件进行灰度分析。每个实验结果独立重复3次。
1.9 双荧光素酶实验 用StarBase数据库预测FoxM1于miR320的结合位点,设计包含该结合位点的序列,qPCR扩增。构建FoxM1野生型质粒(pmirGLO-FoxM1-Wt)和FoxM1突变型质粒(pmirGLO-FoxM1-Mut)。分别将pmirGLO-FoxM1-Wt和pmirGLO-FoxM1-Mut共转染A549细胞,48 h后检测各组细胞荧光素酶活性、迁移能力、增殖能力和 E-cadherin、Vimentin蛋白表达。

2 结 果
2.1 miR-320a在癌组织和癌旁组织内表达 miR-320a在癌组织内的相对表达量为(0.21±0.07),在癌旁组织内的相对表达量为(0.56±0.05),前者低于后者(t=10.31,P<0.001)。
2.2 FoxM1在癌组织和癌旁组织内表达 免疫组化检测FoxM1在癌组织和癌旁组织内的阳性细胞率分别为(91.2±5.10)%和(19.3±2.00)%,前者显著高于后者(t=14.83,P<0.001,图1)。
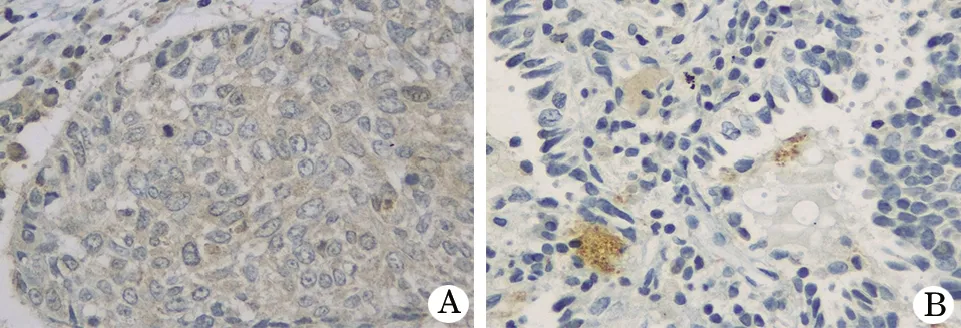
图1 癌组织和癌旁组织内FoxM1表达免疫组化结果
2.3 miR-320a对A549细胞迁移、侵袭能力的影响 转染miR-320a mimics、miR-320a NC和miR-320a inhibitor的A549细胞划痕愈合率分别为(20.1±1.34)%、(53.2±5.02)%和(79.6±7.88)%,组间存在统计学差异(F=10.31,P<0.001),转染miR-320a mimics、miR-320a NC和miR-320a inhibitor的A549细胞侵袭细胞数分别为(65.3±9.33)、(106.9±6.31)和(238.3±19.3),组间存在统计学差异(F=26.42,P<0.001),其中,miR-320a mimics组细胞迁移和侵袭能力均显著弱于miR-320a NC组(t迁移=14.31,P<0.001;t侵袭=18.31,P<0.001),miR-320a inhibitor组细胞迁移和侵袭能力均显著强于miR-320a NC组(t迁移=12.31,P<0.001;t侵袭=23.21,P<0.001)。见图2、图3。
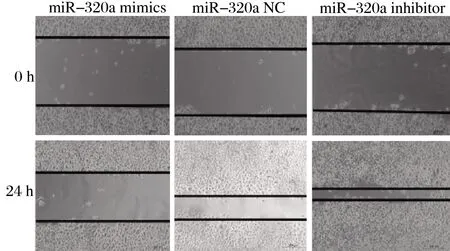
图2 划痕实验检测不同转染组细胞迁移能力
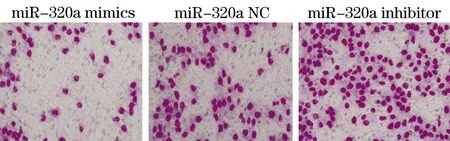
图3 Transwell小室实验检测不同转染组细胞侵袭能力
2.4 miR-320a与FoxM1靶向关系的检测 用StarBase生物信息网站和双荧光素酶报告基因检测miR-320a与FoxM1的靶向关系,发现FoxM1的3′-UTR区域存在miR-320a的结合位点(图4),过表达miR-320a能显著降低FoxM1-WT质粒的荧光素酶活性(t=7.31,P<0.001),对FoxM1-MT质粒荧光素酶活性无显著影响(t=0.42,P>0.05)。Western Blot检测结果显示,转染miR-320amimics的FoxM1-WT A549细胞中FoxM1的表达为(0.12±0.02),显著低于转染miR-320a NC的细胞的(0.31±0.08)(t=11.30,P<0.001),转染miR-320a inhibitor的细胞中FoxM1的表达为(0.89±0.12),显著高于转染miR-320a NC的细胞(t=15.42,P<0.001,图5)。
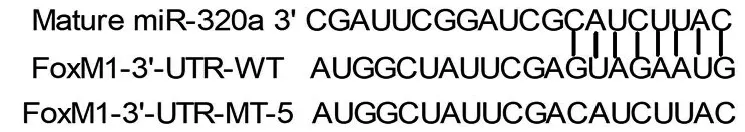
图4 StarBase生物信息网站检测miR-320a与FoxM1的靶向结合位点
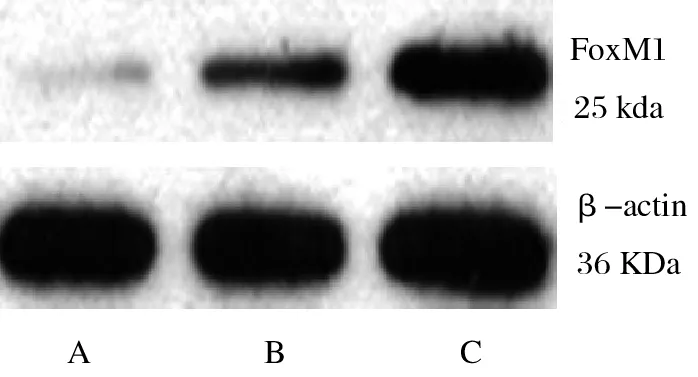
图5 Western Blot检测FoxM1-WT A549细胞中FoxM1蛋白表达结果
2.5 miR-320a对A549细胞内E-cadherin、Vimentin蛋白表达的影响 转染miR-320a mimics、miR-320a NC和miR-320a inhibitor的A549细胞E-cadherin、Vimentin蛋白表达均存在统计学差异,转染miR-320a mimics的细胞E-cadherin表达显著高于miR-320a NC组,Vimentin表达显著低于miR-320a NC组;转染miR-320a inhibitor的细胞E-cadherin表达显著低于miR-320a NC组,Vimentin表达显著高于miR-320a NC组(表1)。转染miR-320amimics、miR-320a NC和miR-320a inhibitor的FoxM1-MT A549间,FoxM1的表达无统计学差异(图6)。
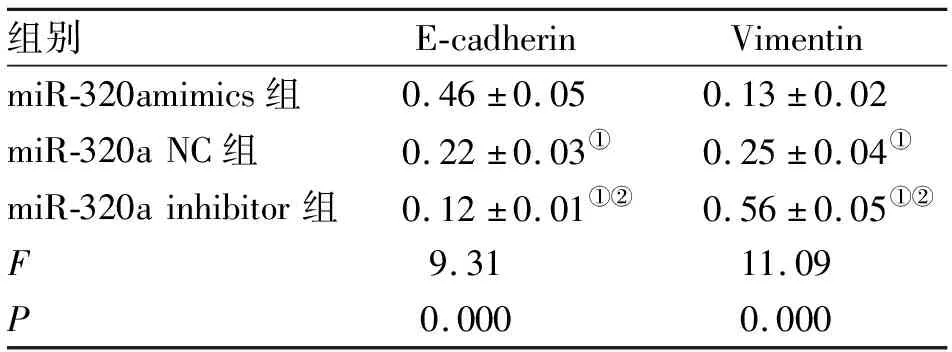
表1 A549细胞中FoxM1蛋白表达

图6 Western Blot检测A549细胞中FoxM1蛋白表达电泳图结果
3 讨 论
非小细胞肺癌(NSCLC)是临床上常见的恶性肿瘤之一,靶向药物的发展是改善中晚期结肠癌患者预后的重要方向。miRNA具有表达稳定的性质,对肿瘤的发生、发展有重要调控作用,在恶性肿瘤的诊断、靶向治疗中有重要的应用价值[4-9]。上皮-间质转化(EMT)在恶性肿瘤的发展中发挥重要作用,是肿瘤细胞获得迁移能力的重要途经。miR-320a已被证实在多种恶性肿瘤细胞的EMT过程中发挥调控作用,王晶[10]等研究证实microRNA-320d通过PBX3抑制子宫内膜癌JEC细胞上皮-间质转化功能,Ying等[11]报道miR-320a对胃癌细胞的EMT过程有调控作用,张丽丽[12]研究证实miR-320a靶向调控RASSF8抑制上皮性卵巢癌的增殖和EMT过程,以上研究说明,miR-320a通常作为抑癌基因在多种肿瘤细胞的EMT过程中发挥作用,但其在NSCLC细胞的EMT过程中发挥的作用尚未见报道,本研究首先检测了miR-320a在NSCLC癌组织和癌旁组织中的表达,结果显示,miR-320a在癌组织中的表达显著低于癌旁组织,以上研究结果提示,miR-320a在NSCLC中可能也是作为抑癌基因发挥作用,这与文献[7]报道结果一致。进一步的,为了验证miR-320a对结肠癌细胞的EMT过程是否有影响,本研究用载有miR-320a mimics、miR-320a inhibitor和miR-320a NC的质粒分别转染A549细胞,并检测24h内细胞的迁移能力,结果发现,miR-320a inhibitor组细胞的迁移、侵袭能力在三组中最强,而miR-320a mimics组细胞最弱,提示miR-320a对A549细胞的EMT过程可能有抑制作用。
叉头框转录因子(Forkhead box, FOX)包含了FOXA到FOXS等家族蛋白,在结构上具有较高的保守性[13-15],其中FoxM1在胚胎发育、DNA损伤修复过程中发挥重要作用,其在肿瘤细胞的EMT过程中发挥重要的调控作用[16,17],有研究发现,干扰FoxM1表达后,肿瘤细胞中,上皮细胞标志蛋白E-cadherin重新表达,而Vimentin、N-cadherin等与间质化关联的蛋白表达缺失[13]。同时,研究发现,FoxM1在NSCLC组织中的表达远高于正常组织,FoxM1能赋予NSCLC细胞肿瘤干细胞的特性,而这种干细胞特性来自于EMT[18]。蒋宗胜等[19]证实,FoxM1与NSCLC细胞EMT过程密切相关,过表达FoxM1的A549细胞迁移、侵袭能力增强,Vimentin、N-cadherin蛋白表达升高而E-cadherin蛋白表达下降。研究报道,miR-320a在宫颈癌[20]、结肠癌[21]、食管鳞癌[22]等多种肿瘤细胞中对FoxM1有靶向作用,基于以上理论,本研究检测了miR-320a在NSCLC细胞中与FoxM1的靶向关系,以探讨miR-320a对NSCLC细胞EMT过程调控作用的机制。结果显示,FoxM1在癌组织中的表达显著高于癌旁组织,这一结果与文献报道相一致。双荧光素酶实验结果显示miR-320a能靶向抑制A549细胞中FoxM1的表达,同时抑制Vimentin的表达,刺激E-cadherin,以上结果提示,miR-320a对NSCLC细胞EMT过程的调控作用可能是通过抑制FoxM1的表达而实现的。
综上所述,miR-320a在NSCLC中可能作为抑癌基因发挥作用,这种作用可能是通过靶向抑制FoxM1的表达,从而抑制NSCLC细胞的上皮细胞间质化过程而实现的。

