不同温度处理对红芸豆蛋白热稳定性及结构的影响
陈振家,王晓闻,荆 旭,梁亚萍
不同温度处理对红芸豆蛋白热稳定性及结构的影响
陈振家1,王晓闻1※,荆 旭1,梁亚萍2
(1. 山西农业大学食品科学与工程学院,太谷 030801; 2.山西农业大学校医院,太谷 030801)
为探究加热过程中红芸豆分离蛋白(Red Kidney Bean Protein Isolate, KPI)溶解特性和结构特性变化及评估不同温度(50~95 ℃)处理对KPI溶液热聚集特性的影响,该研究以不同温度处理KPI溶液为研究对象,采用热力学和光谱学对其热聚集特性进行分析。结果表明:随处理温度升高,红芸豆蛋白溶解度呈先升后降趋势,70 ℃时蛋白溶解度达到最高值82.68%,温度升高至95℃时,溶解度下降至65.63%;电泳结果显示,90 ℃处理蛋白上清液电泳图谱中出现一条分子量约为135 kDa的新条带。随温度升高,总巯基数量则呈下降趋势,游离巯基呈先升后降趋势。随温度上升,加热造成蛋白-螺旋结构占比呈下降趋势,不规则结构占比呈上升趋势,-折叠和-转角变化幅度不大,而KPI内源荧光的最大发射波长呈红移趋势。研究结果为红芸豆食品热加工工艺优化和质量控制提供了理论基础。
热处理;热稳定性;溶解度;红芸豆蛋白;二硫键;二级结构;内源荧光发射光谱
0 引 言
芸豆(.L)学名菜豆(俗称二季豆、四季豆或腰豆),一年生草本植物,豆科菜豆属,是亚洲、南美和非洲地区广为种植和消费的一种食用豆类。2017年,FAO统计数据显示全球芸豆产量排名第一的是印度,紧随其后的是巴西、中国和墨西哥。芸豆品种繁多,大多根据其皮色进行划分,主要有:红芸豆、白芸豆、黑芸豆和奶花芸豆等品种。红芸豆蛋白质量分数为200~300 g/kg,由于其蛋白含量高,同时具有高纤维、低脂肪的营养特性,使得红芸豆成为全世界人类和动物的高蛋白摄取来源[1]。然而其蛋白并未完全开发成为类似于大豆分离蛋白这样的商业产品,蛋白价值并未得到充分利用[2]。
红芸豆蛋白中的主要成分为菜豆球蛋白。菜豆蛋白可以分为S和T两种类型,其中S型比T型消化性更好[3]。目前球蛋白主要的3种构型为T(Tendergreen)型、C(Contender)型和S(Sanilac)型,这3种构型总计有9条不同的多肽链组成,T和S两种构型本质上完全不同,而C型介于T和S型之间[3-5]。相比动物蛋白,豆类蛋白有着自身的营养缺陷,表现为氨基酸组成中缺乏含硫氨基酸和色氨酸,蛋白中含有抗营养因子凝集素。菜豆凝集素很大程度上抑制蛋白酶活性,延缓小鼠机体生长,改变肠道组织[6],同时也会刺激幼崽过早发育[7]。
加热处理不仅能够钝化凝集素,而且能较大程度改善其消化性[8-9],因此,人类摄取豆类食物时通常有加热工序。但是,蛋白质对所处环境的变化非常敏感,任何化学和物理条件的改变都会影响其结构变化,进而导致聚集发生,蛋白结构微小差异也会影响到其消化性和热稳定性[10]。加热会导致蛋白发生变性,亚基解离、结构去折叠、疏水基团暴露于表面。变性通常伴随去折叠蛋白分子的聚集,同时会改变蛋白的部分功能特性(凝胶性、起泡性和乳化性)[11]。李向红等[12]通过不同干燥方式对大豆蛋白热聚集体形成的影响进行分析研究,结果表明干燥过程中蛋白聚集体体系结构发生重组;陶汝青等[13]发现热处理过程中大豆蛋白的热变性程度对豆腐花粉凝结的凝胶强度和所需时间具有显著影响;王喜波等[14]研究表明不同加热杀菌方式会改变牛乳清蛋白结构,导致蛋白无规则卷曲结构含量增加,结构转变更为无序;Fumio等[15]在分子角度理解大豆蛋白质的热致现象中认为,球蛋白在加热过程中会发生明显的解离,解离后的亚基会通过二硫键和其他非共价键重新形成二聚体或三聚体;Gharibzahedi等[16-18]的研究也表明,热处理对大豆分离蛋白及其制品的功能性质,如溶解性、乳化性、凝胶性等具有较大影响。
目前,国内关于加热处理对红芸豆蛋白结构及物化特性的研究鲜有报道。本文以红芸豆蛋白为研究对象,通过不同温度处理比较分析蛋白的聚集特性和结构特性变化规律,以期为实践生产中红芸豆蛋白食品热加工工艺优化和质量控制提供理论基础。
1 材料与方法
1.1 试剂
红芸豆(品芸三号),购于太谷农贸市场;电泳试剂(AMRESCO分装)、考马斯亮蓝G-250、牛血清蛋白,上海生工生物工程技术服务有限公司;低分子量标准蛋白,上海生物化学研究所。
1.2 仪器
电泳槽(DYCZ-24D型)、电泳仪(DYY-6C型),北京六一厂;凝胶成像分析系统(WD-9413A),北京六一厂;T18-basic高速剪切仪,德国艾卡设备有限公司;FD-1冷冻干燥机,北京博医康技术公司;LS55荧光分光光度计,美国Perkin-Elmer公司;Chirascan圆二色谱仪,英国Applied Photophysics公司;Q20差示扫描量热仪,美国TA公司。
1.3 试验方法
1.3.1 红芸豆分离蛋白制备
将红芸豆研磨成粉(过80目筛0.180 mm),按固液比1:10(g/mL)将红芸豆粉与石油醚混合搅拌8 h,去除石油醚油脂混合液,沉淀通风处放置24 h后即为红芸豆脱脂粉。将红芸豆脱脂粉按料液比1:15(g/mL)加蒸馏水混合,溶液调pH值至8.5,搅拌2 h,纱布过滤后2 800离心15 min,弃去沉淀,上清液调酸至pH值4.5,静置30 min后,2 800离心5 min去除上清。沉淀水洗3次后加蒸馏水复溶并调pH值至中性,最后经冷冻干燥备用,冷阱温度-40 ℃,干燥真空度0.09 MPa,干燥时间24 h。蛋白质质量分数87.45%,含水率5.36%[19]。
1.3.2 红芸豆蛋白溶液不同温度处理
配制pH值7.0,2%红芸豆蛋白(KPI)溶液(g/g),室温搅拌2 h充分水化后,分别置于50、60、70、80、90和95 ℃温度条件下处理30 min[13]。
1.3.3 蛋白溶解度测定
将不同温度处理所得红芸豆蛋白溶液10 000离心15 min后取上清液,Bradford法测定上清液中可溶性蛋白含量。
1.3.4差示扫描量热(Differential Scanning Calorimetry,DSC)分析
取10L 10%KPI溶液放入热分析铝盘中,密封后放入差示量热扫描仪中。仪器恒温至40 ℃持续15 min,此后以10 ℃/min的速率升温至120 ℃,绘制加热过程中的热流变化曲线[20]。
1.3.5 蛋白浊度测定
将不同温度处理所得红芸豆蛋白溶液用蒸馏水稀释5倍后,震荡摇匀后用10 mm比色杯在660 nm波长测其吸光值[21]。
1.3.6 游离巯基和总巯基的测定
将定量不同温度处理所得红芸豆蛋白溶液加入反应缓冲液A(0.1 mol/L pH值8.0磷酸钠缓冲液,含1 mmol/L EDTA),室温下搅拌2 h,10 000离心10 min,取5.5 mL上清液加入0.1mL Ellman′s 试剂溶液,混合均匀后室温避光放置15 min,412 nm下测量吸光值;空白加5.5 mL反应缓冲液A;根据标准曲线换算游离巯基含量。公式如下:
1=0.896+0.0023 (1)
式中为吸光值;1为游离巯基含量,mol/g。
将定量不同温度处理所得红芸豆蛋白溶液加入反应缓冲液B(0.1 mol/L 、pH 8.0磷酸钠缓冲液,含1 mmol/L EDTA,8 M尿素),室温下搅拌2 h,10 000 ×离心10min,取5.5 mL上清液加入0.1 mL Ellman′s 试剂溶液,混合均匀后室温避光放置15min,412nm下测量吸光度;空白加5.5 mL反应缓冲液B;根据标准曲线换算总巯基含量[21-23]。公式如下:
2=1.1821+0.0052 (2)
式中为吸光值;2为总巯基含量,mol/g。
1.3.7 聚丙烯酰胺凝胶电泳(SDS-PAGE)
将不同温度处理所得红芸豆蛋白溶液10 000 ×离心10 min,上清液稀释至1 mg/mL并与样品缓冲液1:1混合,100 ℃煮沸5 min,上样10L。浓缩胶质量分数5%,分离胶质量分数12%,恒压电泳(浓缩胶100 V、分离胶150 V),当溴酚蓝指示剂距胶底部5 mm时,停止电泳。固定30 min,考马斯亮蓝G-250染色8 h,脱色2 h,扫描成像,此为非还原SDS-PAGE。在上清液稀释至1 mg/mL并与样品缓冲液1:1混合过程中加入-巯基乙醇为还原SDS-PAGE[24]。
1.3.8 圆二色谱分析
将不同温度处理所得红芸豆蛋白溶液用蒸馏水稀释至0.2 mg/mL,取200L装入0.1 cm光程的样品池,在190~260 nm进行光谱扫描,扫描速度24 nm/min,重复扫描3次。采用DICHROWEB(http://dichroweb.cryst.bbk.ac.uk/ html/process.shtml)对所得结果进行在线拟合计算[25]。
1.3.9 内源荧光发射光谱
将不同温度处理所得红芸豆蛋白溶液用蒸馏水稀释至0.1 mg/mL。蛋白样品在290 nm处激发,扫描300~400 nm的荧光发射光谱,狭缝宽10 nm,扫描速率200 nm/min[26]。
1.3.10 数据统计与分析
2 结果与分析
2.1 不同温度处理对红芸豆蛋白溶解性的影响
由图1可知,红芸豆蛋白溶液度随温度升高呈先升后降趋势。50~70 ℃范围内,蛋白溶解度呈上升趋势,70 ℃时蛋白溶解度达到最高值82.68%,温度进一步升高导致蛋白溶解度下降,95 ℃时溶解度下降至65.63%。蛋白溶解度与温度的关系一方面取决于蛋白与水分的缔合程度,另一方面取决于加热过程中蛋白组分的聚集特性。一般而言,加热会促进蛋白的水化能力,加强蛋白与水的缔合能力,从而增大蛋白的溶解性;此外,加热温度超过蛋白的变性温度后,蛋白变性会导致空间结构发生变化,疏水基团暴露增强多肽链的疏水性,导致蛋白发生疏水聚集;同时蛋白在热作用下,部分通过非共价键和二硫键结合的亚基发生解离,在疏水作用力的推动下,选择性进行的疏水缔合,导致蛋白聚集沉淀,从而造成蛋白溶解度下降[27]。通过热分析可知,红芸豆蛋白只有一个明显的吸热峰值,对应温度为93.4 ℃,这说明红芸豆蛋白的变性温度为93.4 ℃。由图1可知,随温度增加直至70 ℃时,红芸豆蛋白在溶液体系中的水化能力不断增加,由图1a可知,温度超过80 ℃时,红芸豆蛋白已开始发生变性,从而造成蛋白溶解度下降。
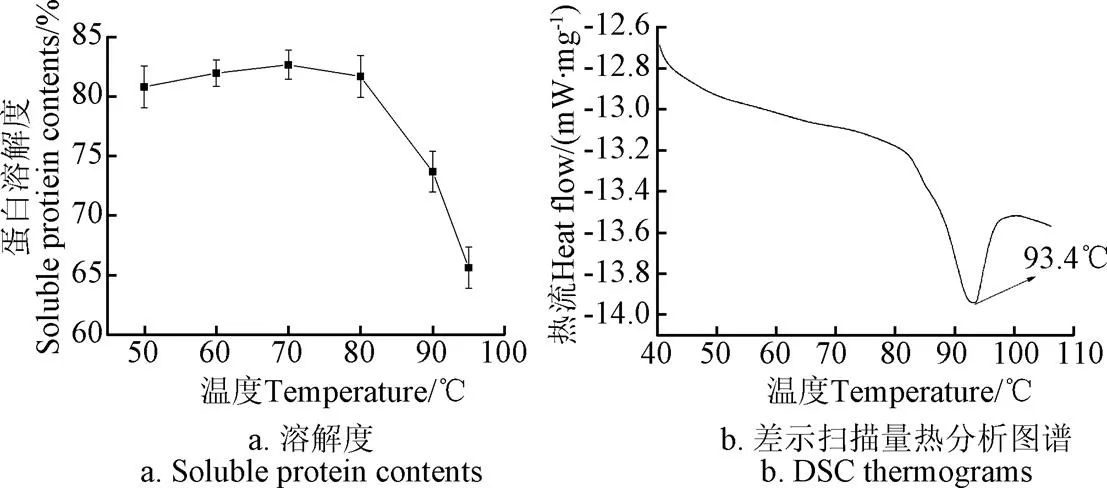
图1 不同温度条件下KPI溶解度和KPI的差示扫描量热分析图谱
2.2 不同温度处理对红芸豆蛋白浊度的影响
由图2可知,在25~50 ℃范围内,红芸豆蛋白溶液浊度呈下降趋势;50~100 ℃范围内随温度增加,浊度呈上升趋势;其中,90~95 ℃区间内,浊度有较大幅度增加。
浊度值反映蛋白溶液的聚集程度,浊度值越大,蛋白聚集程度越高。对比图1和图2,可以得知70~95 ℃区间内,红芸豆蛋白的溶解度与浊度值呈负相关。热聚集既可以形成不溶性聚集体也可以形成可溶性聚集体,这都会导致蛋白质溶解度的下降,但只有形成不溶性聚集体才会造成蛋白质的沉淀。因此,随温度升高,热聚集加剧,浊度升高而蛋白溶解度下降。

图2 不同温度下KPI浊度值
2.3 不同温度处理红芸豆蛋白SDS-PAGE
芸豆蛋白主要由豌豆球蛋白()和豆球蛋白()组成。豌豆球蛋白是一类7S球蛋白,常被称为菜豆球蛋白(),它由3~5个亚基组成,占整个蛋白含量的50%。菜豆球蛋白是由-,-和-球蛋白组成的三聚体,且分子量分布在43~53 kDa[28]。豆球蛋白是一类11~12S球蛋白,它由酸性亚基和碱性亚基组成,酸性亚基和碱性亚基解离成单一组分时常常和豌豆球蛋白发生共沉淀。分子量为47 kDa的亚基条带是豌豆球蛋白,而且其亚基之间没有二硫键相连。因此在图3中可以看到,菜豆球蛋白在非还原和还原电泳图谱中没有明显差别。图3中31、25、21和18 kDa的亚基条带一般被认为属于植物凝集素[29]。
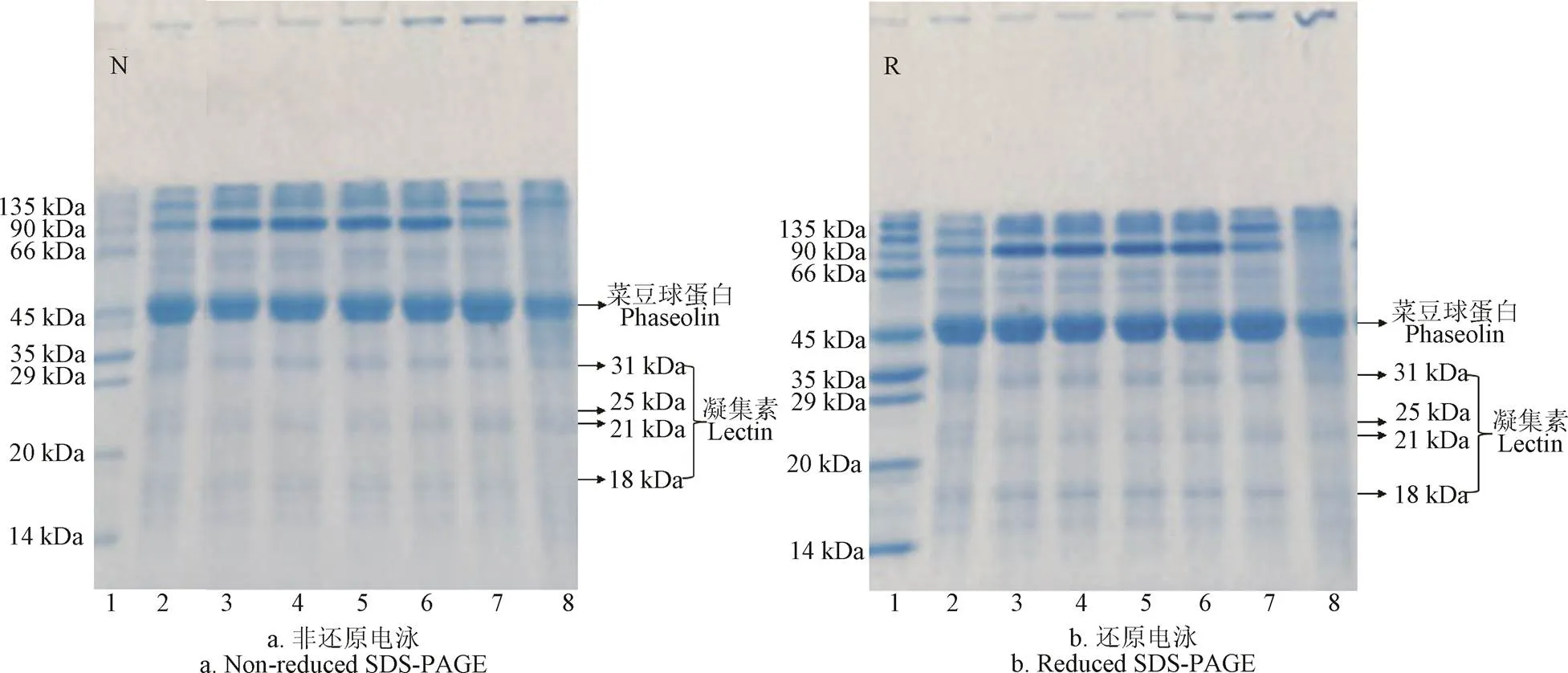
注:1:标样;2:蛋白粉;3~8表示不同温度条件,分别为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃和95 ℃。
由图3可知,红芸豆蛋白非还原和还原电泳图谱中亚基分布相似,说明红芸豆蛋白质亚基缔结形成过程中几乎没有二硫键的参与。非还原电泳图谱中,80~95 ℃浓缩胶顶部出现明显条带,而这些条带在50~70 ℃的电泳图谱中未出现,说明随温度增加红芸豆蛋白发生聚集并形成大分子可溶性聚集体,这些条带同样出现在还原电泳图谱中,说明并没有因还原电泳中添加的-巯基乙醇而发生分子量变小的现象,因此推测这些大分子可溶性聚集体不是通过非二硫键形成的。随温度变化,红芸豆蛋白亚基分布在50~80 ℃范围内未有变化;90 ℃时,90 kDa附近的亚基明显变浅,而且在135 kDa附近出现一条明显的条带。当加热至95 ℃时,90 kDa附近的亚基条带消失,而45和135 kDa附近的亚基条带变浅。对照图1、图2结果,可以得知温度升高会促使蛋白亚基的聚集,而就热聚集程度而言,90 kDa附近的亚基条带在加热过程中最易发生聚集,它是造成加热过程中溶解度降低和浊度上升的主要原因,而135 kDa附近的两条亚基条带次之,45 kDa附近的豌豆球蛋白热聚集程度最低。
2.4 不同温度处理对红芸豆蛋白巯基含量的影响
由图4可知,随温度升高,红芸豆蛋白总巯基在50~80 ℃范围内变化不大,80~95 ℃范围内,则呈下降趋势;红芸豆蛋白游离巯基在50~95 ℃范围内呈先升后降趋势,80 ℃时红芸豆蛋白游离巯基含量最大。
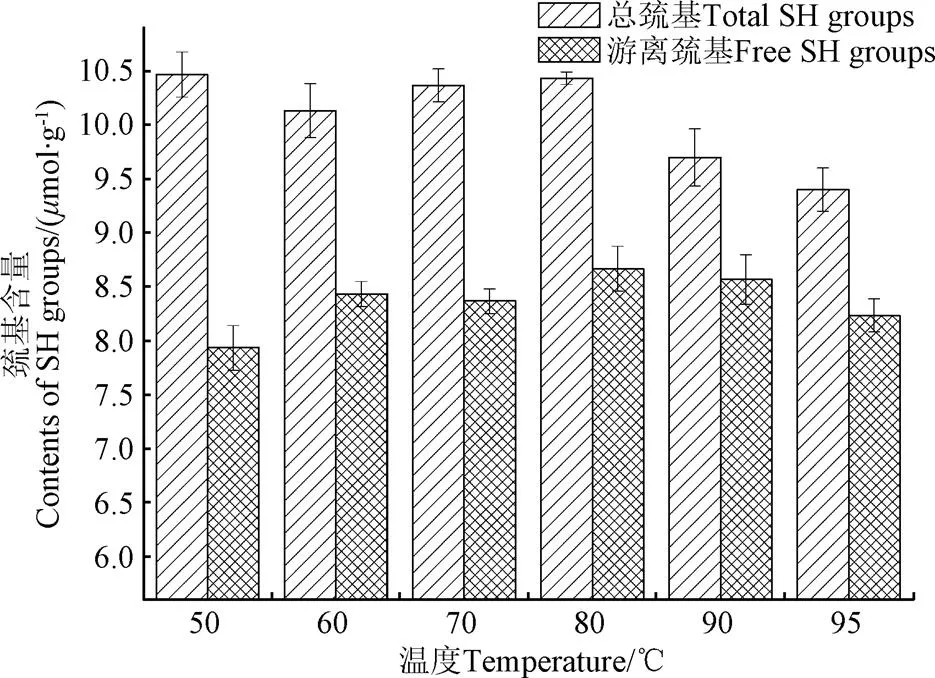
图4 不同温度条件下KPI游离巯基和总巯基含量
加热会诱导蛋白构象发生改变从而改变游离巯基的数量,同时加热处理也同时影响巯基和二硫键的相互转换[30]。适度加热能增加蛋白分子的亲水性,促进蛋白的水合作用,此时有利于部分蛋白聚集体的解离,从而增加游离巯基数量。随温度进一步上升,部分蛋白变性,蛋白空间结构解离,部分疏水内核暴露,这也提高了游离巯基数量增加的机率。当加热至蛋白变性温度时,维系蛋白亚基间的二硫键断裂,这本应继续增加游离巯基数量,但变性后的蛋白亚基在疏水作用推动下发生大量聚集,这使得已暴露的游离巯基被部分包埋[31]。其次,热致二硫键断裂形成的游离巯基大多会重新形成新的二硫键以推动聚集体的形成。比如,大豆蛋白11S在90 ℃时,AB亚基的二硫键断裂,而很快A亚基通过二硫键形成A亚基聚集体,而B亚基则和7S中的-亚基通过二硫键形成新的聚集体[32]。总巯基的数量与巯基氧化形成二硫键的数量变化呈反比,80~95 ℃范围内,总巯基数量则呈下降趋势说明加热促进了二硫键的形成,它们可能参与了不溶性聚集体的形成,因为从电泳图谱分析可知,二硫键参与形成可溶性聚集体的数量很少。
2.5 不同温度处理对红芸豆蛋白二级结构的影响
利用Far-UV CD可以测定不同温度下蛋白质二级结构的变化。由图5可知50 ℃时,红芸豆蛋白Far-UV CD图谱在接近192 nm处有一正峰,在207 nm附近处有一个负峰,在210~230 nm有较宽的肩峰,呈现典型的有序二级结构峰型。随温度增加,原207 nm处的负峰移向更低的波长并伴随强度增大,证明蛋白二级结构无序化程度增大[33]。由表1可知,随温度变化,红芸豆蛋白的二级结构也有一定程度变化。随温度升高,-螺旋结构占比呈下降趋势,而不规则结构占比呈上升趋势,-折叠和-转角变化幅度不大。

图5 不同温度条件下KPI的Far-UV CD 图谱
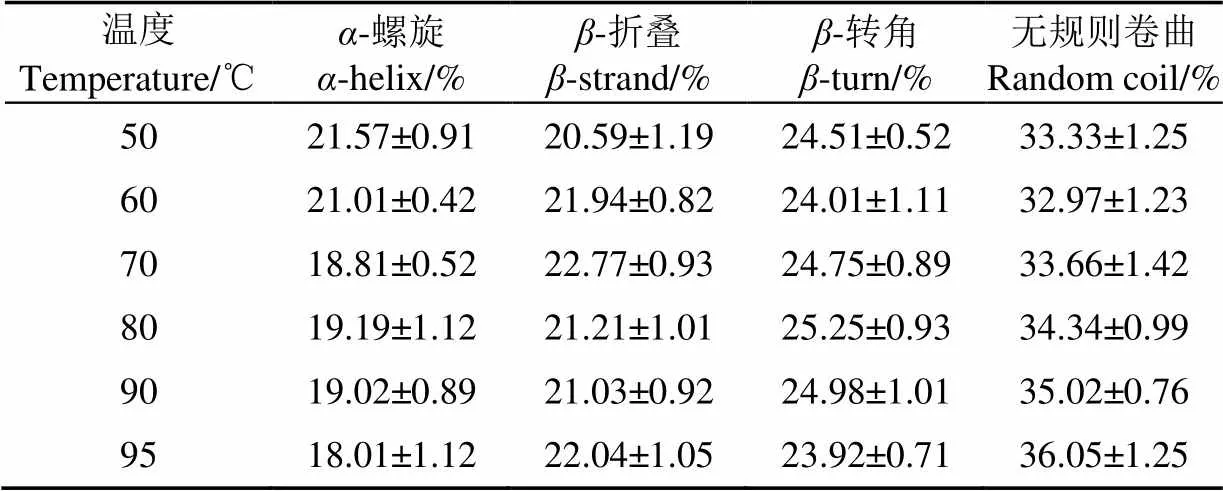
表1 不同温度条件下KPI二级结构占比Table 1 Proportion of secondary structure of KPI with different temperature treatment
Shevkani等[34]通过近红外光谱测定芸豆蛋白二级结构的平均含量为:-螺旋(22.8%),-折叠(38.6%),-转角(20.1%),A1(9.7%)和A2(2.9%)。Zirwer等[35]研究发现:牛血清蛋白加热过程中,-螺旋结构会转变为-折叠结构。天然状态下的大豆蛋白会有少量无规则结构,而在加热后大豆蛋白的无规则结构会有所增加。加热过程中蛋白的变性总体上都会降低有序结构数量,而增加无序结构数量。
2.6 不同温度处理红芸豆蛋白内源荧光图谱
蛋白质的内源荧光光谱是通过测定色氨酸残基所处环境的极性得到的,可以反映蛋白质空间构象的变化以及蛋白质之间的相互作用[36]。当蛋白质色氨酸残基所处的溶剂环境极性提高,即色氨酸残基从球蛋白内部疏水性区域转移到表面暴露在溶剂环境中时,其最大发射波长会增大即发生红移。芸豆蛋白是典型的色氨酸荧光光谱。荧光峰在332 nm处,表明色氨酸残基位于芸豆分离蛋白的疏水区域[37]。
由图6和表2可知,在50~70 ℃随温度上升,红芸豆蛋白最大发射波长发生红移,说明蛋白分子结构逐步展开,内部色氨酸暴露;80 ℃时,红芸豆蛋白最大发射波长蓝移,说明蛋白部分聚集,原来暴露的色氨酸被重新包埋,但对应溶解度数据,此时形成的聚集体应为可溶;温度继续上升,90 ℃时,红芸豆蛋白二硫键断裂造成蛋白结构新的解离,色氨酸暴露程度增加,红芸豆蛋白最大发射波长发生红移。
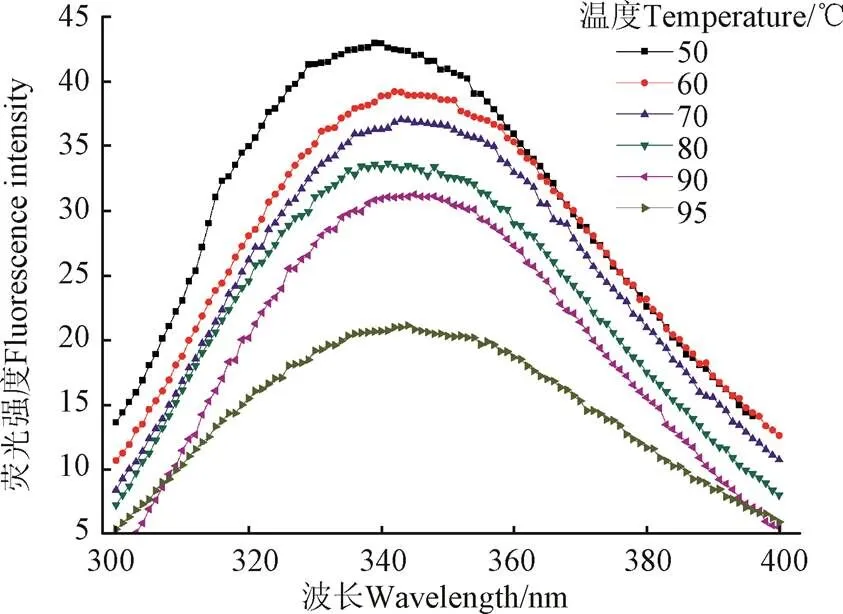
图6 不同温度条件下KPI的内源荧光发射光谱
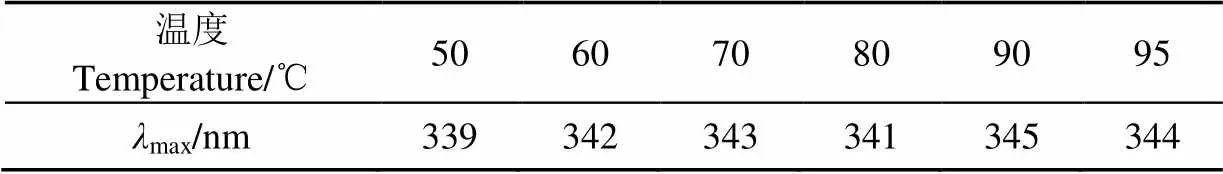
表2 不同温度条件下KPI的内源荧光最大发射波长(λmax)Table 2 Maximum emission wavelength (λmax) of KPI with different temperature treatment
3 结 论
1)加热处理对红芸豆蛋白溶解度和浊度有较大影响,50~70 ℃范围内,蛋白溶解度呈上升趋势,70 ℃时蛋白溶解度达到最高值82.68%,温度进一步升高将导致蛋白溶解度下降,95 ℃时溶解度下降至65.63%;升温过程中,蛋白浊度呈持续增加趋势;热处理导致蛋白二硫键的增加和聚集体的形成,因此蛋白总巯基数量则呈下降趋势。
2)加热处理对红芸豆蛋白亚基组成有较大影响,90 ℃时红芸豆可溶蛋白电泳图谱中出现分子量约为135 kDa的新条带;95 ℃时,可溶蛋白电泳图谱中90 kDa的条带消失。
3)加热处理造成红芸豆蛋白二级结构不规则程度增加,-螺旋结构占比呈下降趋势,不规则结构占比呈上升趋势,同时,加热也造成了红芸豆蛋白内部疏水结构的暴露,内源荧光的最大发射波长红移。
试验结果将对今后红芸豆加工过程中蛋白结构调控和提高蛋白产品热稳定性提供理论指导。
[1] Thompson H J. Dietary Bean Consumption and Human Health[J]. Nutrients, 2019, 11(12): 3074.
[2] He Q, Sun X, He S et al. PEGylation of black kidney bean (Phaseolus vulgaris L.) protein isolate with potential functironal properties[J]. Colloids and Surfaces B: Biointerfaces, 2018, 164: 89-97.
[3] Montoya C A, Gomez A S, Lallès J P, et al. In vitro and in vivo protein hydrolysis of beans (Phaseolus vulgaris) genetically modified to express different phaseolin types[J]. Food chemistry, 2008, 106(3): 1225-1233.
[4] Montoya A, Lalles J, Beebe S, et al. Influence of the Phaseolus vulgaris phaseolin level of incorporation, type and thermal treatment on gut characteristics in rats[J]. British journal of Nutrition, 2006, 95(1): 116-123.
[5] Bessada S, Barreira J, Oliveira M. Pulses and food security: Dietary protein, digestibility, bioactive and functional properties[J]. Trends in Food Science & Technology, 2019, 93: 53-68.
[6] Pusztai A, Ewen S, Grant G, et al. Relationship between survival and binding of plant lectins during small intestinal passage and their effectiveness as growth factors[J]. Digestion, 1990, 46(Suppl.2): 308-316.
[7] Radberg K, Biernat M, Linderoth A, et al. Enteral exposure to crude red kidney bean lectin induces maturation of the gut in suckling pigs[J]. Journal of Animal Science, 2001, 79(10): 2669-2678.
[8] Rovalino-Córdova M, Fogliano V, Capuano E, et al. The effect of cell wall encapsulation on macronutrients digestion: A case study in kidney beans[J]. Food Chemistry, 2019, 286: 557-566.
[9] Halabi A, Deglaire A, Hamon P, et al. Kinetics of heat-induced denaturation of proteins in model infant milk formulas as a function of whey protein composition[J]. Food Chemistry, 2020, 302, 125296.
[10] Fukuda T, Maruyama N, Kanazawa A, et al. Molecular analysis and physicochemical properties of electrophoretic variants of wild soybean Glycine soja storage proteins[J]. Journal of Agricultural and Food Chemistry, 2005, 53(9): 3658-3665.
[11] Chi E, Krishnan S, Randolph T, et al. Physical stability of proteins in aqueous solution: mechanism and driving forces in nonnative protein aggregation[J]. Pharmaceutical Research, 2003, 20(9): 1325-1336.
[12] 李向红,刘展,李伟,等. 干燥方法对大豆分离蛋白热诱导聚集体的影响[J]. 农业工程学报,2008,24(10):258-261.
Li Xianghong, Liu Zhan, Li Wei, et al. Effect of drying method on heat-induced aggregate of soy protein isolate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(10): 258-261. (in Chinese with English abstract)
[13] 陶汝青,夏宁,滕建文,等. 大豆蛋白热变性程度对速溶豆腐花粉凝胶成型的影响[J]. 农业工程学报,2017,33(11):299-305.
Tao Ruqing, Xia Ning, Teng Jianwen, et al. Effect of heat denaturation degree of soybean protein on gel property of instant soybean curd[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(11): 299-305. (in Chinese with English abstract)
[14] 王喜波,张安琪,王玉莹,等. 巴氏杀菌和超巴氏杀菌对牛乳清蛋白结构及热稳定性的影响[J]. 农业工程学报,2019,35(6):315-321.
Wang Xibo, Zhang Anqi, Wang Yuying, et al. Effect of pasteurization and ultra-pasteurization on structure and thermal stability of fresh milk whey protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(6): 315-321. (in Chinese with English abstract)
[15] Fumio, Yamauchi, Tatsunori, et al. Molecular understanding of heat‐induced phenomena of soybean protein[J]. Food Reviews International, 1991, 7(3):283-322.
[16] Gharibzahedi S M T, Hernández O C, Welti C, et al. High pressure processing of food-grade emulsion systems: Antimicrobial activity, and effect on the physicochemical properties[J]. Food Hydrocolloids, 2019, 87: 307-320.
[17] Shen Y, Tang X, Li Y, et al. Drying methods affect physicochemical and functional properties of quinoa protein isolate[J]. Food Chemistry, 2020, 339: 127823.
[18] Andrea R, Mauricio O N, Yamira C B, et al. Heat-induced changes in microstructure of spray-dried plant protein isolates and its implications on in vitro gastric digestion[J]. LWT-Food Science and Technology, 2020, 118: 108795.
[19] Byanju B, Rahman M, Hojilla-Evangelista M P, et al. Effect of high-power sonication pretreatment on extraction and some physicochemical properties of proteins from chickpea, kidney bean, and soybean[J]. International Journal of Biological Macromolecules, 2020, 145(15): 712-721.
[20] Chen Zhenjia, Shi Xiaodi, Xu Jingting, et al. Gel properties of SPI modified by enzymatic cross-linking during frozen storage[J]. Food Hydrocolloids, 2016, 56(5): 445-452.
[21] Ren C, Tang L, Zhang M, et al. Interactions between whey soybean protein (WSP) and beta-conglycinin (7S) during the formation of protein particles at elevated temperatures[J]. Food Hydrocolloids, 2009, 23(3): 936-941.
[22] Ruan Q, Chen Y, Kong X, et al. Comparative studies on sulfhydryl determination of soy protein using two aromatic disulfide reagents and two fluorescent reagents[J]. Journal of Agricultural and Food Chemistry, 2013, 61(11): 2661-2668.
[23] Arzeni C, Martinez K, Zema P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472.
[24] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature. 1970, 227: 680-685.
[25] Wan Y, Liu J, Guo S. Effects of succinylation on the structure and thermal aggregation of soy protein isolate[J]. Food chemistry, 2018, 245: 542-550.
[26] Shen L, Tang C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118.
[27] Rahmati N, Koocheki A, Varidi M, et al. Introducing Speckled sugar bean (Phaseolus vulgaris) protein isolates as a new source of emulsifying agent[J]. Food Hydrocolloids, 2018, 79: 498-508.
[28] Wani I, Sogi D, Shivhare U, et al. Physico-chemical and functional properties of native and hydrolyzed kidney bean (Phaseolus vulgaris L.) protein isolates[J]. Food Research International, 2014, 76(8): 11-18.
[29] Rui X, Boye J, Ribereau S, et al. Comparative study of the composition and thermal properties of protein isolates prepared from nine Phaseolus vulgaris legume varieties[J]. Food Research International, 2011, 44(8): 2497-2504.
[30] Alting A C, Weijers M, De Hoog E H A , et al. Acid-induced cold gelation of globular proteins: effects of protein aggregate characteristics and disulfide bonding on rheological properties[J]. Journal Agricultural and Food Chemistry, 2004, 52(3): 623-631.
[31] Nishinari K, Fang Y, Guo S, et al. Gums and stabilisers for the food industry 17: Properties and applications of soy proteins[M]. London: Royal Society of Chemistry, 2014: 28-45.
[32] Wu C, Wang J, Yan X, et al. Effect of partial replacement of water-soluble cod proteins by soy proteins on the heat-induced aggregation and gelation properties of mixed protein systems[J]. Food Hydrocolloids, 2019, 100: 105417.
[33] Wan Y, Liu J, Guo S. Effects of succinylation on the structure and thermal aggregation of soy protein isolate[J]. Food Chemistry, 2018, 245: 542-550.
[34] Shevkani K, Singh N, Kaur A, et al. Structural and functional characterization of kidney bean and field pea protein isolates: A comparative study[J]. Food Hydrocolloids, 2015, 43: 679-689.
[35] Zirwer D, Gast K, Welfle H, et al. Secondary structure of globulins from plant seeds: A re-evaluation from circular dichroism measurements[J]. International Journal of Biological Macromolecules, 1985, 7: 105-108
[36] Pallarès I, Vendrell J, Avilés F X, et al. Amyloid fibril formation by a partially structured intermediate state of α-chymotrypsin[J]. Journal of Molecular Biology, 2004, 342(1): 321-331.
[37] He S, Zhao J, Cao X, et al. Low pH-shifting treatment would improve functional properties of black turtle bean (Phaseolus vulgaris L.) protein isolate with immunoreactivity reduction[J]. Food Chemistry, 2020, 330: 127217.
Effects of different temperature treatments on thermal stability and structure of red kidney bean protein
Chen Zhenjia1, Wang Xiaowen1※, Jing Xu1, Liang Yaping2
(1.,030801,; 2.,,030801,)
Heat is the most common physical agent that denatures proteins. Heat-induced denaturation unfolds protein structure, exposes surface hydrophobic groups and dissociates proteins into their constituent subunits. Denaturation decreases protein solubility, resulting in aggregation of the unfold molecules due to changes in functional properties, such as water absorption, gelation, foaming, and emulsification. An in-depth study was carried out to investigate the physicochemical properties and aggregation characteristics of red kidney bean protein isolate (KPI) during heating and to determine the influence of different temperatures on the thermal aggregation behavior of KPI. The protein solubility, turbidity, content of total and free sulfhydryl groups, subunit composition, and protein secondary structure of native KPI aqueous dispersions (2% g/mL) thermally treated at different temperatures (50, 60, 70, 80, 90 and 95 ℃)were analyzed by different detection methods and techniques. High temperature caused the dissociation and association of protein subunits leading to the formation of soluble and insoluble aggregates, which reduced the solubility of the protein to some extent and increased the turbidity of the protein solution. Results of protein concentration showed that the solubility of red kidney bean protein increased initially and then decreased with the increase of temperature. The solubility of KPI increased by more than 82% at 70 ℃, but decreased to 65.63% at 95 ℃ (near denaturation temperature 93.4 ℃). The turbidity of the protein solution of red kidney bean increased with temperature. Results of SDS-PAGE gel electrophoresis revealed that proteins of red kidney bean tended to form macromolecule aggregates at high temperature. The protein profiles obtained from SDS-PAGE analysis performed in the absence and presence of-mercaptoethanol were not significantly different when thermal treatment was carried out at a temperature below 90 ℃. A new band with a molecular weight of approximately 135 kDa appeared in the electrophoretic pattern at 90 ℃. The subunit bands with a molecular weight of approximately 90 kDa disappeared in the electrophoretic pattern at 95 ℃, indicating that the protein subunits underwent dissociation and aggregation to a certain extent during heating. A gradual decrease in the content of total sulfhydryl groups was observed and the amount of free sulfhydryl groups initially increased and then decreased as the temperature increased. These results suggested that thermal treatment enhanced protein aggregation and oxidation of SH group. Results of circular dichroism spectroscopy revealed that heat treatment affected the secondary structure of KPI, whereas the content of-helix in KPI decreased with the rising heating temperature, and the content of random coil increased, but there was no apparent change in the content of-strand and-turn. Fluorescence analysis showed that red-shift of KPI solution occurred when the temperature was over 80 ℃, indicating that thermal treatments greatly changed the secondary and tertiary structure of KPI. This implies that high temperature destroys the tertiary structure of KPI and increases the polarity of protein microenvironment. The results can provide the important theoretical basis for controlling the thermal behavior and aggregation properties of red kidney bean products.
heat treatment; thermal stability; solubility; red kidney bean protein; disulfide bonds; secondary structure; intrinsic fluorescence emission spectra
陈振家,王晓闻,荆旭,等. 不同温度处理对红芸豆蛋白热稳定性及结构的影响[J]. 农业工程学报,2020,36(19):306-312.doi:10.11975/j.issn.1002-6819.2020.19.035 http://www.tcsae.org
Chen Zhenjia, Wang Xiaowen, Jing Xu, et al. Effects of different temperature treatments on thermal stability and structure of red kidney bean protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(19): 306-312. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.19.035 http://www.tcsae.org
2020-05-27
2020-09-10
山西省重点研发计划项目(201903D11006);山西农业大学博士科研启动项目(2016ZZ06)
陈振家,博士,副教授,主要从事植物蛋白研究。Email:13453216350@163.com
王晓闻,博士,教授,主要从事杂粮加工研究。Email:wwxw11@163.com
10.11975/j.issn.1002-6819.2020.19.035
TS201.7
A
1002-6819(2020)-19-0306-07

