山药低聚糖制备分离及对五种益生菌的增殖作用
丁伯乐,蔡为荣,闻志莹,岳丹伟,朱樱,李晶晶
(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000)
益生菌具有促进机体吸收营养物质[1],提高机体免疫力[2],提高机体抗氧化水平[3],抑制肠道炎症[4]等功能,对人体健康具有重要作用。有研究表明,功能性低聚糖具有良好的增殖作用[5-7],同时具有改善便秘[8]、防腹泻[9]、降血糖[10]、防肿瘤[11]等多种生理活性。
山药低聚糖(yam oligosaccharide)是山药中重要的活性物质之一,由甘露糖、葡萄糖、半乳糖和葡萄糖醛酸[12]组成,具有良好的增殖作用[13]和抗氧化活性[12]。同时,有研究指出不同分子质量的低聚糖会对双歧杆菌的生长产生影响[14]。对于不同分子质量的山药低聚糖是否会影响益生菌生长的研究尚未见报道,因此,本文通过分离纯化山药低聚糖,利用山药低聚糖取代葡萄糖为碳源,探究其不同组分对婴儿双歧杆菌(Bifidobacteriuminfantis),两歧双歧杆菌(Bifidobacteriumbifidum),青春双歧杆菌(Bifidobacteriumadolescentis),BB-12双歧杆菌(Bifidobacteriumanimalsssp.lactis)以及罗伊氏乳杆菌(Lactobacillusreuteri138-1)5种益生菌的体外增殖作用。同时进一步将山药低聚糖分离纯化出3个组分,进而研究不同组分山药低聚糖对不同益生菌的增殖作用,期望为山药低聚糖的进一步开发提供理论基础。
1 材料与方法
1.1 材料与试剂、培养基
山药购于当地市场,产地安徽,品种为淮山药,新鲜度与成熟度良好。婴儿双歧杆菌、两歧双歧杆菌CCFM16,青春双歧杆菌CCFM16以及罗伊氏乳杆菌138-1 CCFM8631,江南大学微生物实验室;双歧杆菌BB-12,科汉森(中国)有限公司。低聚木糖,浙江一诺生物科技有限公司。参照刘露等[13]的方案配置,得到乳酸菌基础培养基。
1.2 仪器与设备
YQX-2厌氧培养箱,上海新苗器械制造有限公司;JK-JH01超净台,安徽杰克欧德实验室设备有限公司;IMark酶标仪,美国伯乐有限公司;JY-1002电子天平,上海良平天平厂;TY10超纯水机,上海精密仪器仪表有限公司;日立S-4800扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 山药低聚糖制备、还原糖及分子质量测定
工艺流程如下:
鲜山药→切片→50 ℃烘10~12 h→粉碎,过120 目筛→样品(水分6.23%)称质量→超声波辅助提取→抽滤浓缩→聚酰胺脱蛋白→醇沉→上清液浓缩→冷冻干燥→活性炭色谱柱→LH-20凝胶色谱柱→不同组分低聚糖提取物
山药低聚糖的初步纯化采用加入料液比为1∶4(g∶mL)的聚酰胺,室温摇床振荡4 h,进行脱蛋白处理,抽滤,加3倍90%(体积分数)乙醇醇沉,除去多糖得到初步纯化的山药低聚糖。利用活性炭色谱柱[m(活性炭)∶m(硅藻土)=1∶1],色谱柱规格2.6 cm×40 cm,上样量为10 mL,每隔5 min收集一管,每管5 mL,用体积分数为15%,30%,45%的乙醇进行梯度洗脱。利用LH-20凝胶色谱柱对初分的不同组分山药低聚糖分别进行再次纯化,色谱柱规格1.6 cm×80 cm,上样量20 mg/mL,每管5 mL,每隔10 min收集一管。
参照贺苹苹[5]的方法,得到葡萄糖标准曲线为y=0.404 53x+0.002 45(R2=0.999 6);其中x为葡萄糖浓度,y为吸光值。
样品的测定:样品溶液按照贺苹苹[5]的方法进行处理,于490 nm处测定吸光度,测定时使样品吸光值落在标准曲线线性范围内,通过标准曲线计算样品中的低聚糖浓度。
根据原超[15]的低聚糖纯度计算公式得到粗多糖、粗低聚糖纯度计算如公式(1)所示:
(1)
式中:P,粗多糖或粗低聚糖纯度,%;C1,粗多糖或粗低聚糖溶液中总糖质量浓度,mg/mL;N1,测定粗多糖或粗低聚糖中总糖时样品的稀释倍数;C2,粗多糖或粗低聚糖溶液中还原糖质量浓度,mg/mL;N2,测定粗多糖和粗低聚糖中还原糖时样品的稀释倍数;V,溶液体积,mL;m1,粗多糖、粗低聚糖质量(干基计),mg。
对3组分山药低聚糖进行分子质量的测定,色谱条件:色谱柱UItrahydrogelMLinear 300 mm×7.8 mm×2,流动相0.1 mol/L NaNO3,流速0.9 mL/min,柱温45 ℃,样品制备:将样品溶解于流动相中,用微孔过滤膜过滤后供进样。分子质量校正曲线所用标准品分子质量分别为135 350、36 800、9 750、2 700、180。
1.3.2 山药低聚糖的扫描电镜分析
取少量山药低聚糖黏附于样品台上,置于真空喷镀仪内镀上导电层,采用S-4800扫描电子显微镜观察。
1.3.3 益生菌菌种增殖活化
从冻库管中吸取青春双歧杆菌,婴儿双歧杆菌,两歧双歧杆菌,BB-12乳双歧杆菌以及罗伊氏乳杆菌各400 μL,加入到活化培养基中培养48 h,将活化培养基中的菌种转移到增殖培养基中培养24 h,活化3次。
1.3.4 山药低聚糖对益生菌生长曲线的影响
以山药低聚糖替代葡萄糖为唯一碳源,以无糖,葡萄糖,低聚木糖作为对照,分别加入到青春双歧杆菌、婴儿双歧杆菌、两歧双歧杆菌、BB-12乳双歧杆菌以及罗伊氏乳杆菌5种益生菌中,每隔6 h从试管中吸取200 μL发酵液,利用酶标仪测定OD600值。利用Origin 8.0绘制曲线,比较不同碳源培养基随着时间的变化对益生菌生长情况的影响。
1.3.5 不同组分山药低聚糖对益生菌生长曲线的影响
向培养基中分别加入质量分数为0.5%、1.0%、1.5%和2.0%的山药低聚糖,替代葡萄糖为唯一碳源,通过测定益生菌的OD600值,得到最佳山药低聚糖加入量。将3种组分不同的山药低聚糖按照最佳加入量配制培养基,培养上述实验结果较好的益生菌,每隔6 h从试管中吸取200 μL发酵液,利用酶标仪测定OD600值。利用Origin 8.0绘制曲线,比较不同组分山药低聚糖为碳源的培养基随着时间变化对益生菌生长情况的影响。
1.3.6 统计分析
运用SPSS 22.0对数据进行显著性分析,P<0.05为数据之间存在显著性差异,并通过GraphPad Prism 5 进行作图。综合评价不同组分山药低聚糖对不同益生菌的影响。
2 结果与分析
2.1 山药低聚糖的分离纯化
本实验中粗山药低聚糖的得率为8.15%,高于周丽等[16]用微波法的得率6.31%,低于CHEN等[12]用H2O2水解制备的得率11.89%,但本实验相较于H2O2水解法具有无污染、易控制、成本低等特点。如图1所示,按1.3.1方法,在85~125管得到第1个峰,收集馏分,为馏分1,测得纯度为78.15%,在145~155管得到第2个峰,收集馏分,为馏分2,测得纯度为80.52%,在210~220管得到第3个峰,收集馏分,为馏分3,测得纯度为79.23%。

图1 山药低聚糖活性炭层析柱线性梯度洗脱曲线Fig.1 Elution profile of yam oligosaccharides on activated carbon column
葡聚糖凝胶LH-20对于分离纯化中等大小的生物分子具有良好的作用,刘聪等[17]曾用葡聚糖凝胶LH-20对棉籽低聚糖进行了分离纯化,取得了较好的结果。本实验样品通过凝胶柱的再次分离纯化,得率为5.86%。如图2所示,按照1.3.1方法,将馏分1过凝胶柱,得到馏分1吸光度,如图2-a,收集10~25管的馏分,作为组分1(Fr1),测得纯度为93.24%,同理,如图2-b、图2-c,收集10~30管以及10~25管的馏分,分别作为组分2(Fr2)和组分3(Fr3),测得纯度分为93.17%和92.35%。

a-馏分1;b-馏分2;c-馏分3图2 山药低聚糖LH20凝胶色谱柱线性梯度洗脱曲线Fig.2 Elution profile of yam oligosaccharides on LH20 gel column
2.2 三种不同组分分子质量的测定
如图3所示,测得Fr1的数均分子质量为0.74 kDa,Fr2的数均分子质量为0.95 kDa,Fr3的数均分子质量为1.25 kDa。
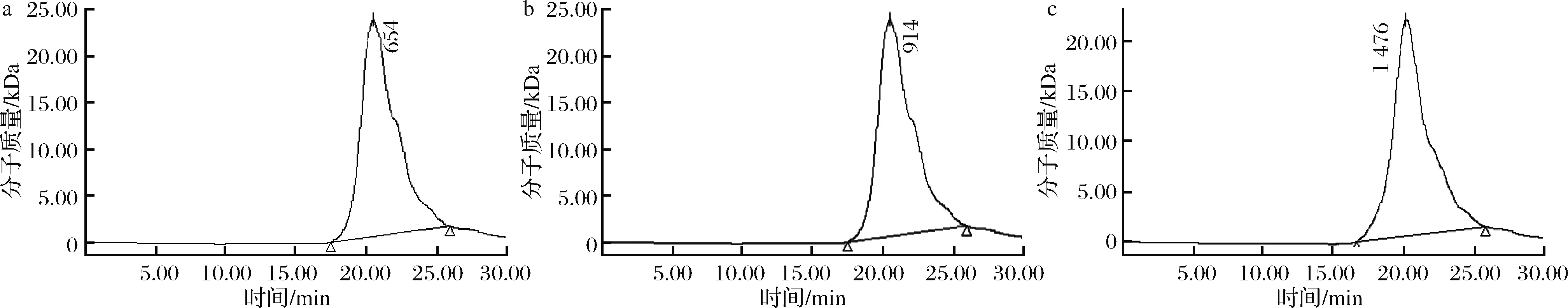
a-Fr1;b-Fr2;c-Fr3图3 三种山药低聚糖不同组分分子质量分布图Fig.3 Molecular weight distribution of different components of three yam oligosaccharides
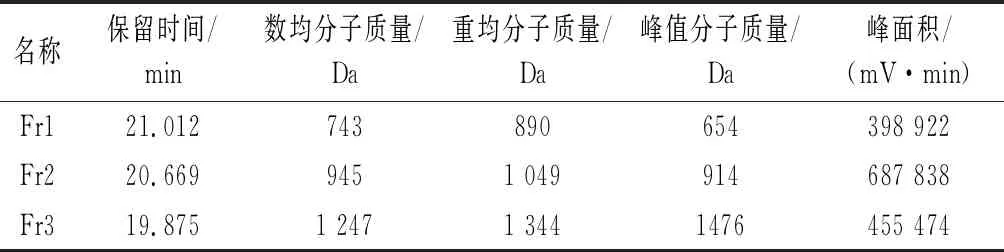
表1 高效凝胶色谱法测得各组分的分子质量分布结果Table 1 Molecular weight distribution of each component measured by high performance gel chromatography
2.3 山药低聚糖扫描电镜结果分析
调节加速电压 5 kV,放大 30~80 000 倍,用随机工作站进行拍摄,观察低聚糖表面的形态。如图4所示,观察发现35、4 000、11 000以及35 000倍下的山药低聚糖均呈不规则的几何外形,表面凸凹不平,表面结合较为紧密,同时集聚体整体性较强,说明山药低聚糖是一种较为固定紧密的立体结构。

a-35倍;b-4 000倍;c-11 000倍;d-35 000倍图4 山药低聚糖不同倍数的扫描电镜图Fig.4 SEM image of yam oligosaccharides with different multiples
2.4 山药低聚糖对五种益生菌体外生长曲线的影响
图5-a、图5-d中,青春双歧杆菌和婴儿双歧杆菌均在30 h达到最大值,但2种菌的OD600值均小于添加低聚木糖和葡萄糖的培养基;在图5-b、图5-c、图5-e中,两歧双歧杆菌在前18 h在山药低聚糖培养基中生长最快,BB-12双歧杆菌在18 h达到最大值,罗伊氏乳杆菌在前12 h在山药低聚糖培养基中生长最快,能够发现在整个生长周期中,3种菌的OD600值均略低于葡萄糖组成的培养基,同时均高于益生性较好的低聚木糖培养基。
以葡萄糖为碳源培养的长双歧杆菌在28 h达到稳定期[18],这和图5的实验结果相符。低聚木糖是公认的具有较好效果的益生元[19-21],观察图5-b、图5-e,能够发现山药低聚糖对两歧双歧杆菌和罗伊氏乳杆菌的增殖效果与低聚木糖相似,说明山药低聚糖具有良好的益生性。张泽生等[22]则指出不同来源的低聚果糖会使得BB-12双歧杆菌的体外增殖效果不同。由图5-c可知,BB-12双歧杆菌培养到18 h,达到稳定期,同时能够发现山药低聚糖的增殖效果低于葡萄糖,但明显高于低聚木糖,表明山药低聚糖对于BB-12双歧杆菌具有较好的增殖作用。
2.5 不同组分山药低聚糖对三种益生菌体外生长曲线的影响
由图6可知,在山药低聚糖质量分数为1.5%时,益生菌的OD值最大,这表明山药低聚糖最适添加量为1.5%,低聚糖浓度较高时,OD值不再升高,可能是因为溶液的渗透压较高抑制了益生菌的生长。
由图7-a、图7-b、图7-c可知,3种益生菌(罗伊氏乳杆菌、两歧双歧杆菌、BB-12双歧杆菌)的OD600值在18 h达到最大,随后趋于平缓,说明3种益生菌的前18 h是生长期。山药低聚糖的3个组分对于罗伊氏乳杆菌增殖效果为Fr1>Fr2>Fr3,这可能是和组分的分子质量不同有关,分子质量低的组分益生效果较好;山药低聚糖的3个组分对于两歧双歧杆菌的增殖效果为Fr2>Fr1>Fr3;山药低聚糖的3个组分对于BB-12双歧杆菌的增殖效果为Fr1>Fr2>Fr3。通过数据图能够看出,Fr1和Fr2对益生菌的增殖效果较好,而Fr3对益生菌的增殖效果较差,这可能是因为分子质量较小时,益生菌更容易利用,而分子质量较大可能造成益生菌消化吸收的速率较慢。本研究结果发现山药低聚糖Fr1对BB-12双歧杆菌以及罗伊氏乳杆菌增殖效果较好,而山药低聚糖Fr2对两歧双歧杆菌的增殖效果较好,对于山药低聚糖不同组分会促进不同益生菌的增殖生长,这在国内外报道中尚属首次。

a-青春双歧杆菌;b-两歧双歧杆菌;c-BB-12双歧杆菌;d-婴儿双歧杆菌;e-罗伊氏乳杆菌图5 山药低聚糖对五种益生菌体外生长曲线的影响Fig.5 Effects of yam oligosaccharides on the growth curves of five probiotics in vitro
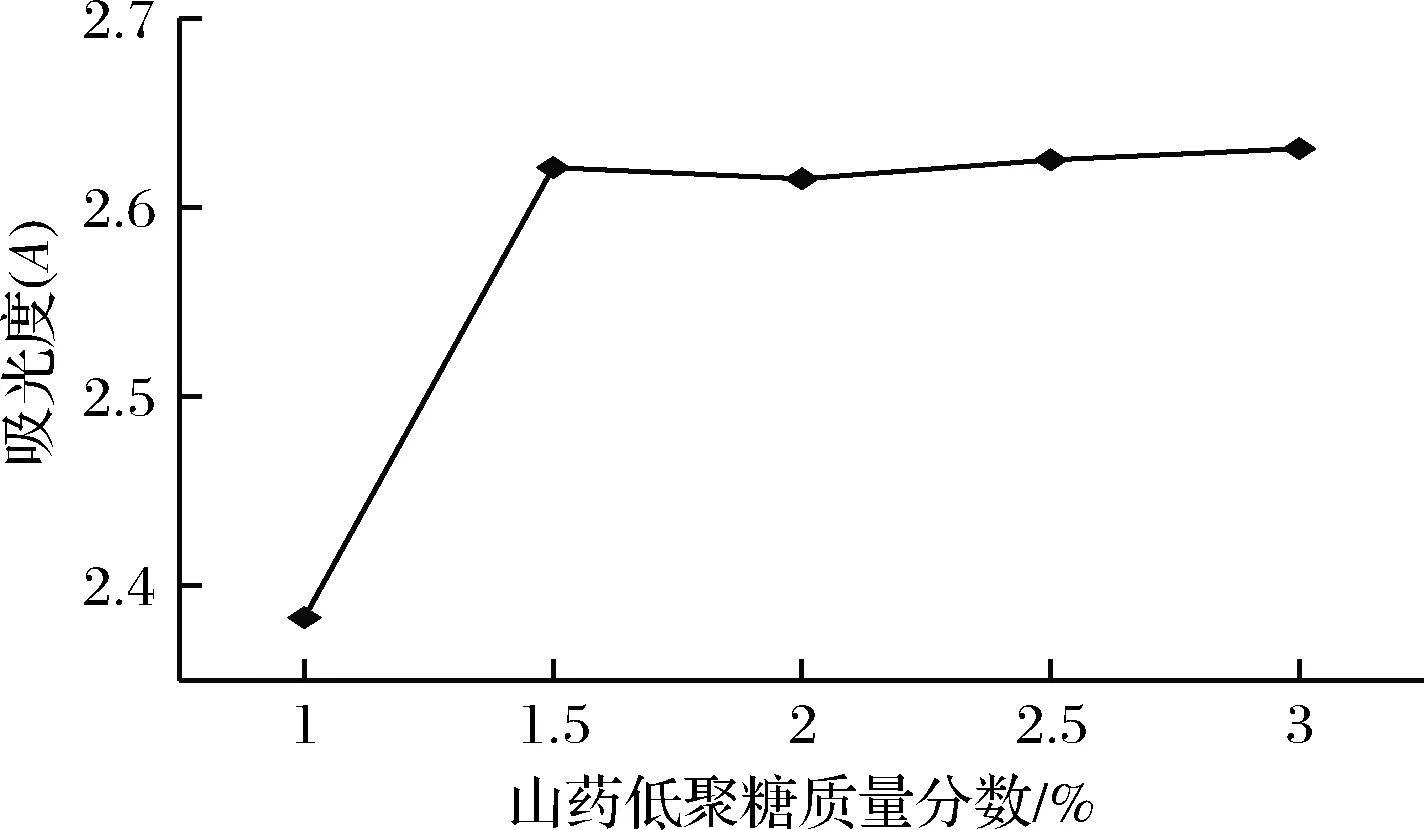
图6 不同含量山药低聚糖对益生菌的影响Fig.6 Effects of different contents of yam oligosaccharides on probiotics
国内外研究表明,碳水化合物促进益生菌的增殖生长主要是和单糖组成、聚合度、糖苷键类型以及益生菌的培养条件和种类有关。山药低聚糖促进益生菌的生长可能与聚合度、糖苷键组成有关,需要进一步探究。
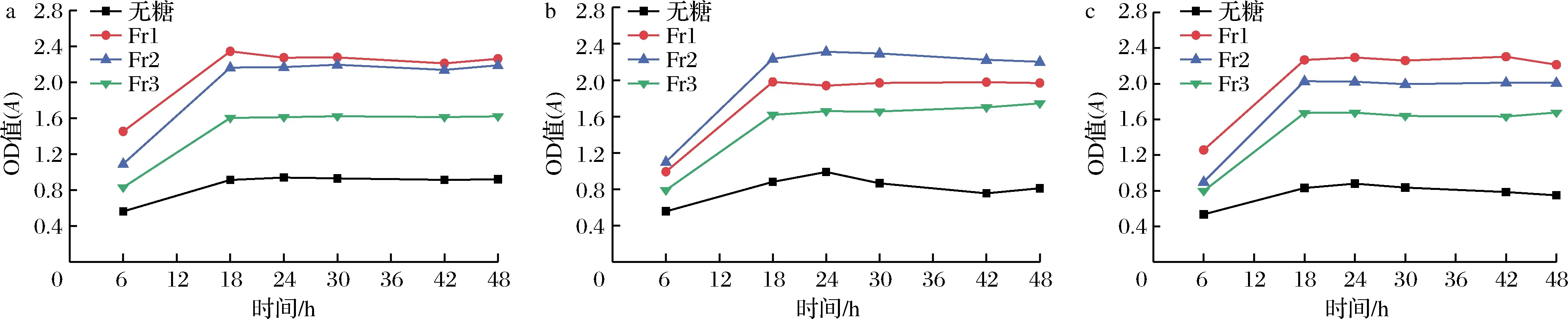
a-罗伊氏乳杆菌;b-两歧双歧杆菌;c-BB-12双歧杆菌图7 三种组分山药低聚糖对三种益生菌生长曲线的影响Fig.7 Effects of three yam oligosaccharides on the growth curves of three probiotics
2.6 不同组分山药低聚糖对益生菌影响的显著性分析
图8为不同组分山药低聚糖对益生菌的影响。由图8可知,在3种菌中,添加不同组分山药低聚糖的培养基相较于无糖培养基均具有显著性(P<0.05),且Fr1和Fr2显著高于无糖组(P<0.05),同时Fr1和Fr2两组相较于Fr3组具有显著性(P<0.05);在BB-12双歧杆菌和两歧双歧杆菌中,Fr1和Fr2之间有差异,但不显著(P>0.05);在罗伊氏乳杆菌中,Fr1组和Fr2组不存在显著性差异(P>0.05),与上述结论一致。
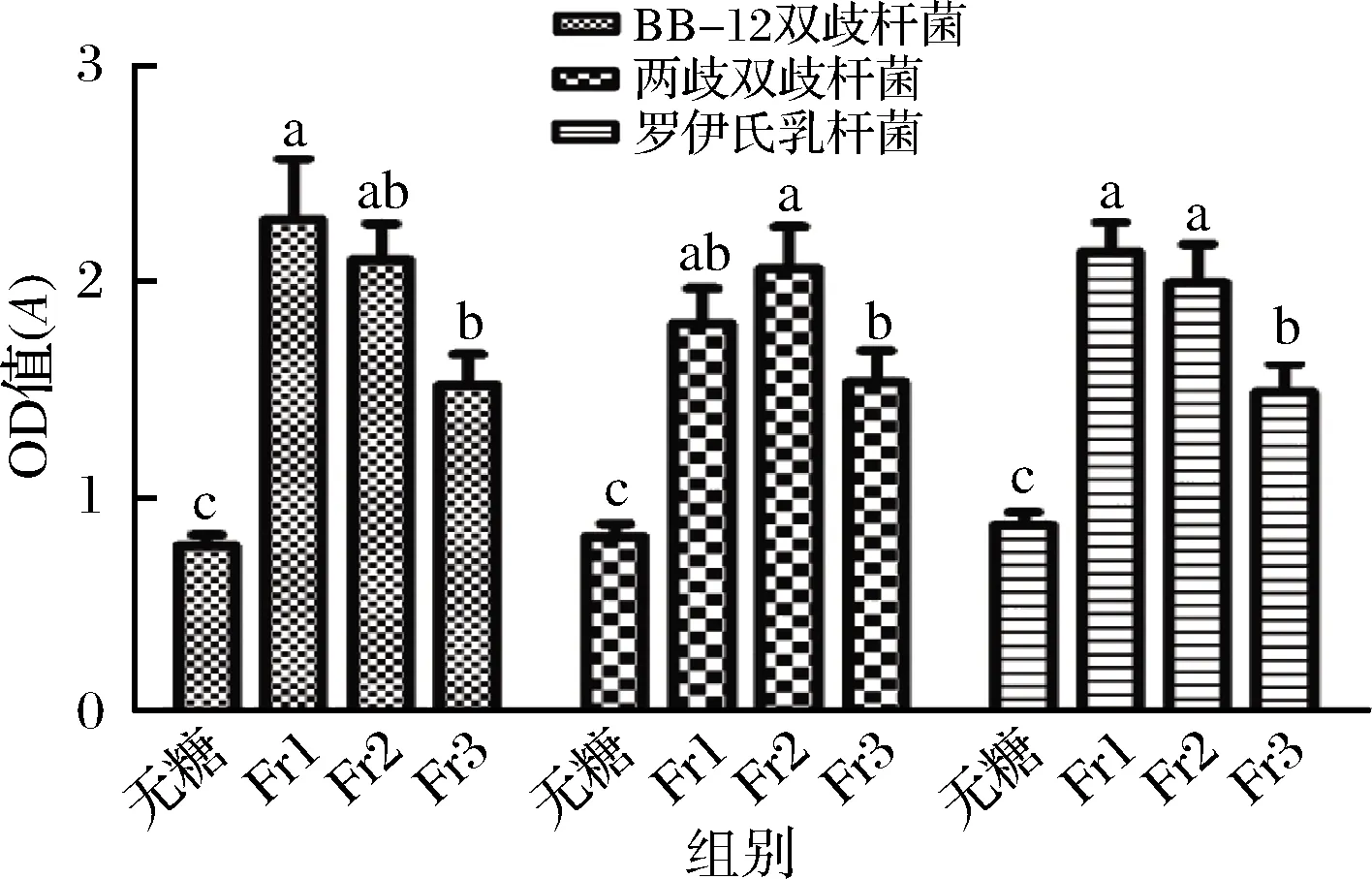
图8 三种组分山药低聚糖对三种益生菌的显著性分析图Fig.8 Three components of yam oligosaccharides on the three probiotics significance analysis注:不同小写字母表示差异显著
3 结论
经粗提得粗山药低聚糖经过活性炭色谱柱,乙醇进行梯度洗脱,再通过Sephadex LH-20 凝胶色谱柱得到数均分子质量分别为0.74、0.94、1.25 kDa 3个组分山药低聚糖;以粗山药低聚糖作为培养基的唯一碳源,对BB-12双歧杆菌、两歧双歧杆菌和罗伊氏乳杆菌有增殖作用,且效果优于纯低聚木糖培养基,OD600值分别提高了13.9%,8.24%和7.18%;山药低聚糖组分对两歧双歧杆菌,BB-12双歧杆菌以及罗伊氏乳杆菌增殖效果分别为Fr2>Fr1>Fr3、Fr1>Fr2>Fr3、Fr1>Fr2>Fr3。

