微弧氧化羟基磷灰石涂层金属钛调控Wnt通路促进骨髓间充质干细胞的增殖*
王艳玲, 邵 喆, 何 巍, 朱兰省
1河南省中医院(河南中医药大学第二附属医院)口腔科,郑州 4500022武汉大学口腔医院口腔颌面外科,武汉 430079 3郑州大学第一附属医院口腔科,郑州 450052
种植体植入口腔后,其种植成功与否取决于种植体骨结合是否成功。种植体骨结合是牙槽骨不断改建和吸收的动态改建过程,其中起源于骨髓间充质干细胞(bone marrow stromal cells,BMSC)的成骨细胞起到极其重要的作用[1]。BMSC是一种多能干细胞,具有自我更新增殖和多向分化的能力,并且可以分化为成骨细胞而促进种植体与骨更好地结合[2]。种植体与BMSC共同移植可以发挥BMSC自我更新的潜能,通过自我增殖产生更多的BMSC,从而可以分化为更多的成骨细胞而促进骨结合。
金属钛和其合金因具有良好的生物相容性和机械性能而被广泛应用于口腔种植体和骨科领域的研究中[3]。金属钛表面的特性对于其生物相容性至关重要,通过改变其表面特性可以改善其对细胞的相容性,可以促进细胞粘附和组织再生[4]。目前羟基磷灰石(HA)涂层被认为是提升金属钛生物相容性的良好表面涂层。其可以作为桥梁连接金属与正常骨组织,同时可以诱导BMSC向成骨细胞分化和新生骨形成[5]。目前主要有2种制备HA涂层的方式,分别为普通电化学法(ELC)和微弧氧化法(MAO)。本研究旨在探究2种方式制备的金属钛材料对BMSC的粘附和增殖的影响,从而为研发性能更佳的种植体提供研究基础。
1 材料与方法
1.1 微弧氧化HA涂层与电化学HA涂层制备
金属钛薄片(10 mm×10 mm×1 mm,宝鸡英耐特医用钛有限公司)充分打磨、抛光后备用,分别使用MAO法和ELC法制备HA涂层金属钛。MAO法:金属钛片浸没于纳米掺锶羟基磷灰石涂层组电解液之中,阳极为金属钛,阴极为不锈钢片,恒压(350 V)电解5 min,频率50 Hz,占空比50%,最后得到MAO-HA涂层金属钛片。ELC法:金属钛片置于电解液(3 mmol/L Ca(NO3)2、1.75 mmol/L NH4H2PO4、0.1 mmol/L NaCl、pH6.0)中,阳极为金属铂片,阴极为金属钛片,保持电流强度10 mA,电泳温度85℃,电泳1 h。随后得到ELC-HA涂层金属钛片。
1.2 BMSC培养
BMSC取自200 g成年雌性Wistar大鼠(10只,河南中医药大学动物中心提供)。使用冷乙醇(75%)浸泡脱颈处死的大鼠10 min。严格无菌操作条件下取大鼠股骨、胫骨和肱骨等长骨,置于DMEM中。切断长骨干骺端,使用无菌注射器抽吸DMEM培养液冲洗长骨髓腔。随后收集冲洗下的细胞,1000 r/min离心5 min。使用DMEM(含10% FBS)重悬细胞并种植于6孔板中。12 h换液,移除漂浮细胞,之后每隔3天换液1次。使用第3代的BMSC进行后续实验,铺板密度为1×107/L。细胞分为2组:ELC组加入ELC-HA涂层金属钛片,MAO组加入MAO-HA涂层金属钛片,每组设置4个复孔(n=4)。
1.3 BMSC免疫荧光染色鉴定
将细胞培养板中的BMSC培养液移除,冷PBS清洗细胞,多聚甲醛(4%)固定10 min,0.3% Triton X-100渗透10 min,PBS清洗细胞后,使用封闭血清封闭过夜。PBS清洗细胞后使用BSA(1%)稀释的一抗(CD29和CD90)4℃条件下孵育过夜。随后加入荧光二抗孵育2 h。PBS清洗细胞后加入DPAI细胞核染液孵育10 min,封片,拍照。
1.4 2种涂层的水滴接触角检测
将1.0~2.0 μL双蒸水滴于材料上,水滴与材料的接触角使用SDC-100测量仪(聚创时代中国)进行观察和记录。
1.5 扫描电镜观察
使用扫描电镜观察MAO组和ELC组材料表面形态,同时观察在金属片上培养48 h的BMSC形态,观察材料对细胞粘附性的影响。吸出细胞的培养液,平衡盐溶液清洗细胞后加入电镜固定液(戊二醛,2.5%)固定1~2 h。使用PBS再次清洗细胞及金属板3次,随后锇酸固定(1%,4℃,1 h)。乙醇脱水(脱水乙醇浓度依次为30%、50%、70%、90%、100%,每个浓度脱水15 min),干燥、喷金,随后拍照。
1.6 CCK-8法检测细胞增殖
细胞培养板中放置ELC和MAO方法制备的金属圆片材料(直径略小于培养孔直径),将BMSC铺在底部为材料的孔板中,铺板后24、48、72 h使用CCK-8试剂盒(碧云天,中国)检测两组细胞增殖。吸弃培养液,平衡盐溶液清洗细胞和金属片,加入CCK-8试剂后37℃培养箱继续培养4 h,随后吸取100 μL样品液放入新的96孔板中,进而检测各组样品在450 nm波长处的吸光度值。以各组吸光度值与ECL 24 h组吸光度值的比值反映各组细胞增殖情况。
1.7 Western blot法检测Wnt通路蛋白表达
为了检测MAO-HA涂层金属钛材料调控BMSC增殖是否通过Wnt通路,在培养72 h后收集MAO组和ELC组细胞并使用Western blot法检测Wnt-3a、β-catenin、GSK3β和p-GSK3β蛋白的表达。收集细胞,使用平衡盐溶液清洗细胞,随后加入细胞裂解液和蛋白酶抑制剂(碧云天公司)。对各个样本蛋白浓度进行定量(BCA试剂盒,碧云天公司)。SDS-PAGE(10%)凝胶电泳分离样品蛋白,转移到PVDF膜上,使用脱脂奶粉(5%)封闭后分别孵育一抗(Wnt-3a、β-catenin、GSK3β和p-GSK3β(Abcam公司)和辣根过氧化物酶标记二抗(Goat-anti-Rabbit-IgG-H&L-HRP)。采用ECL法显影,GAPDH作为内参,以目的蛋白与内参条带的吸光度比值反映蛋白的表达量。
1.8 统计学分析
2 结果
2.1 亲水性检测
首先对ELC组和MAO组材料的亲水性进行检测,比较水滴滴在材料表面形成的接触角,当接触角越小时,证明材料亲水性越好。结果显示ELC组的接触角为(73.0±1.5)°,MAO组的接触角为(50.1±1.9)°,两组比较差异具有统计学意义(P<0.01),说明MAO涂层材料具有更好的亲水性(图1)。

A:ELC组水滴接触形态与接触角;B:MAO组水滴接触形态与接触角;C:两组接触角统计分析,*P<0.01图1 ELC组与MAO组材料亲水性比较Fig.1 Comparison of hydrophilicity between ELC group and MAO group
2.2 BMSC鉴定
培养的BMSC均匀生长,呈多角形和梭形,细胞充分伸展并平铺于细胞培养板中。细胞免疫荧光染色显示培养的BMSC细胞呈CD90(红色)阳性和CD29(绿色)阳性,细胞同时表达BMSC特异性标志物CD90和CD29,证实所培养的细胞为BMSC(图2)。
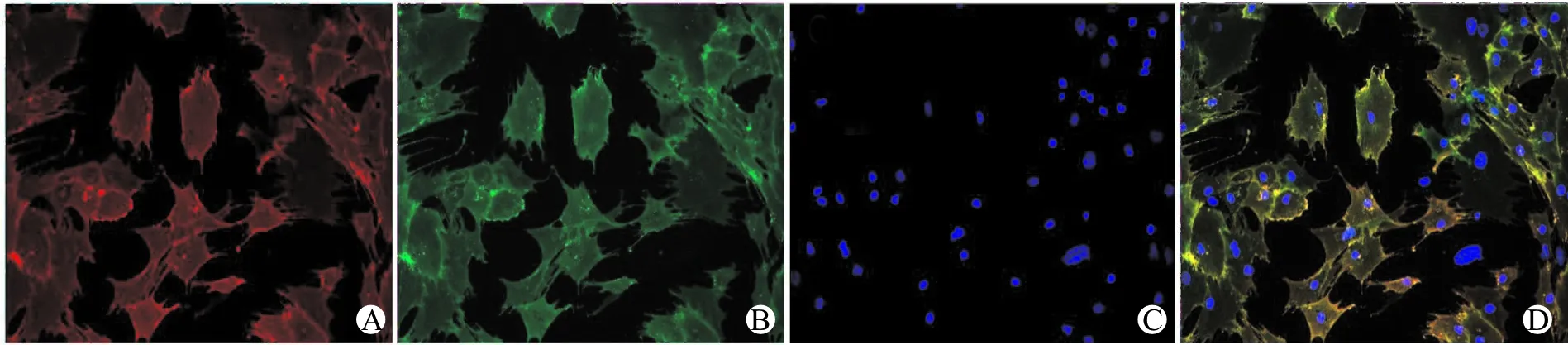
A:CD90;B:CD29;C:DAPI;D:融合图图2 BMSC细胞免疫荧光染色鉴定(×200)Fig.2 Immunofluorescence staining for identification of BMSC cells(×200)
2.3 扫描电镜下观察BMSC在ELC-HA涂层和MAO-HA涂层材料表面生长的形态
对ELC-HA涂层材料和MAO-HA涂层材料表面的微观地形进行扫描电镜检测,结果显示MAO组涂层材料表面具有较均匀的粗糙孔隙,而ELC组材料表面较平滑(图3)。而BMSC在MAO组细胞充分伸展,突起粗大,而ELC组细胞与材料贴合不完全,细胞较小,突起较细,证实MAO涂层材料更适合BMSC粘附和生长(图4)。

A、B:ELC组;C、D:MAO组;A、C:放大300倍,B、D:放大10000倍图3 扫描电镜观察两组材料的表面地形Fig.3 Surface topography of the materials between the two groups by SEM

A:ELC组;B:MAO组图4 扫描电镜下观察BMSC在两组材料上的生长情况Fig.4 Growth of BMSC in two groups observed by SEM
2.4 两组材料对BMSC增殖的影响
检测ELC-HA涂层材料和MAO-HA涂层材料对BMSC增殖的影响。使用CCK-8方法检测在两组材料上培养24、48和72 h后细胞增殖情况。结果显示(图5):ELC组和MAO组BMSC细胞均随着时间延长而增殖,在24 h时间点两组增殖情况无明显差异,而在48 h和72 h,MAO组细胞增殖显著优于ELC组,且差异具有统计学意义(P<0.05)。证实相比于ELC-HA涂层材料,MAO-HA涂层材料具有更佳的促进BMSC增殖的特性。
2.5 MAO-HA涂层材料对BMSC细胞Wnt通路的调控作用
为了验证MAO-HA涂层材料调控BMSC细胞增殖的内在通路和机制,采用Western blot法检测Wnt通路关键蛋白Wnt-3a、β-catenin、GSK3β和p-GSK3β在Control组、ELC组和MAO组BMSC细胞中的表达水平。结果显示(图6):相比于ELC组,Wnt-3a、β-catenin和p-GSK3β在MAO组的表达均显著上调(均P<0.05),而总GSK3β在两组表达水平相当。结果证实MAO-HA涂层材料可以调控BMSC中Wnt通路。

*P<0.05图5 ELC组和MAO组材料对BMSC细胞增殖的影响Fig.5 Effect of materials of ELC group and MAO group on BMSC proliferation
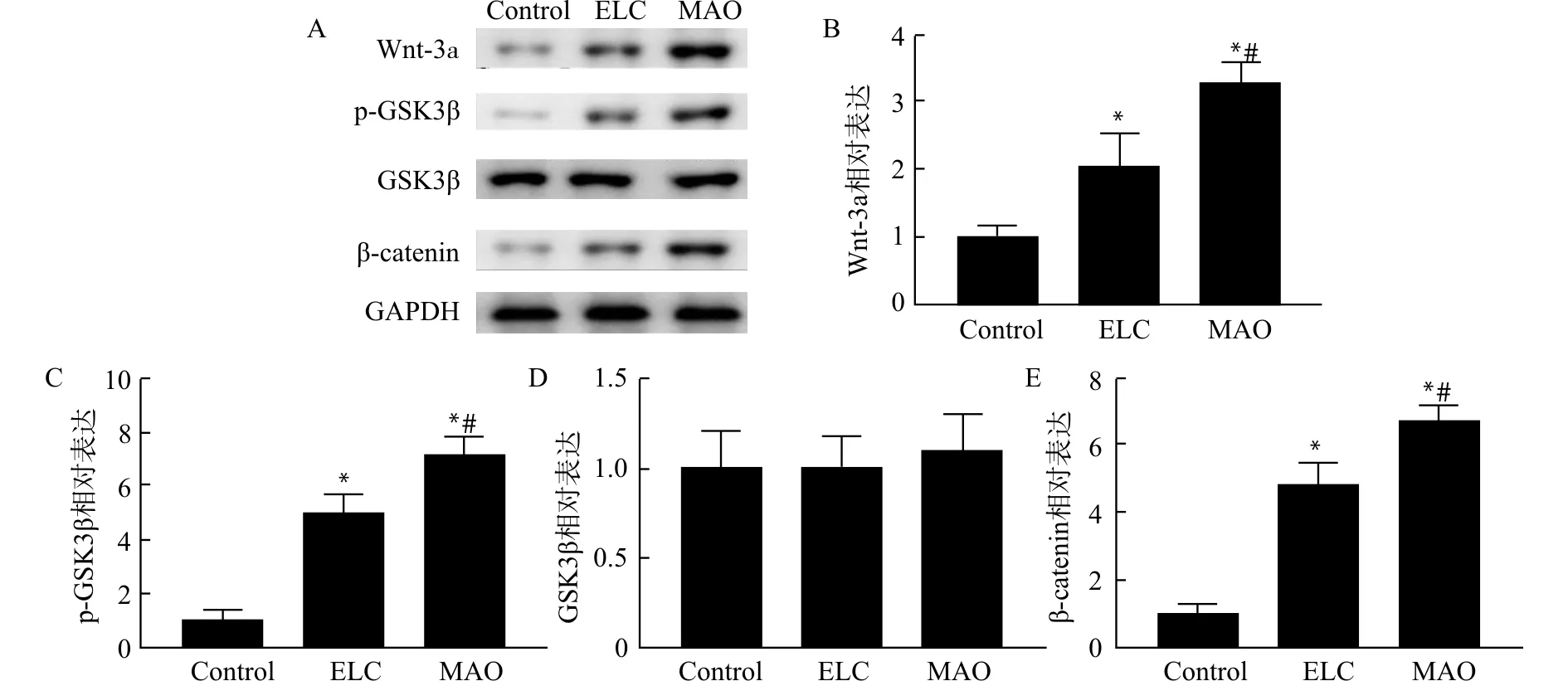
A:Western blot检测结果灰度图;B:Wnt-3a蛋白表达量柱状统计图;C:p-GSK3β蛋白相对表达量统计柱状图;D:GSK3β蛋白相对表达量统计柱状图;E:β-catenin蛋白相对表达量统计柱状图;与Control组比较,*P<0.05;与ELC组比较,#P<0.05图6 Control组、ELC组和MAO组材料对Wnt通路的调控作用Fig.6 Regulatory effect of materials of Control group,ELC group and MAO group on Wnt pathway
3 讨论
种植体植入的成功与否与骨结合密不可分,成骨细胞的粘附是骨结合的第一步,成骨细胞来源于BMSC。作为决定骨结合是否完全的种子细胞,BMSC的数量直接决定可以促进骨结合的成骨细胞的数量,最终影响种植体骨结合。因此,找到性能更佳、促进BMSC粘附和增殖的种植体材料对于种植体植入的成功尤为重要。本研究比较了ELC涂层材料和MAO涂层材料对BMSC粘附、增殖和Wnt通路的影响。结果显示,MAO材料具有更优的表面地形,具有良好的亲水性,更适于BMSC细胞在其表面生长。MAO材料显著促进了BMSC的增殖,Wnt通路蛋白检测发现MAO可以调控BMSC细胞中Wnt通路而促进细胞增殖。
GSK3β是Wnt通路重要的关键蛋白,是一种调节细胞代谢的激酶[6-7]。β-catenin是Wnt通路下游关键功能性蛋白,由细胞质进入细胞核后发挥功能,可以调节BMSC成骨分化[8]。GSK3β可以通过结合β-catenin而抑制Wnt信号通路的激活,磷酸化后的GSK3β(p-GSK3β)失去结合活性而导致Wnt通路激活[9]。有研究表明使用锂可以抑制GSK3β活性从而激活Wnt通路[10]。Wnt通路参与到骨骼发育和修复过程中,同时也参与到干细胞的增殖和分化中[11]。有研究显示Wnt信号通路配体蛋白与羟基磷灰石(HA)共同移植可以显著促进种植体周围骨形成[12]。本研究结果显示MAO-HA涂层材料可以抑制GSK3β活性和提高β-catenin表达,从而激活Wnt通路,促进BMSC细胞增殖。
综上所述,本研究证实了MAO-HA涂层金属钛材料具有良好的亲水性,适于BMSC细胞在其表面生长,可以激活Wnt通路,促进BMSC细胞增殖。提示MAO-HA涂层金属钛材料可以作为一种生物相容性良好的材料用于制作骨结合能力更好的种植体,从而增加种植体置入的稳定性和成功率。

