杜仲胶生物合成机制研究进展
徐钰涵,任园园,吕玉红,李 澳,岳昌武,屈汉林,王伊璠,马瑞晨
(延安市微生物药物创新及转化重点实验室, 延安大学医学院, 陕西 延安 716000)
中国每年消费的天然橡胶量高达500万吨,位列全球首位。以顺式聚异戊二烯为主要成分的三叶橡胶是工业用天然橡胶的主要原料,但目前我国天然三叶橡胶年产量仅为80万吨,难以满足国内需求,严重依赖于国外橡胶进口,因而开发三叶橡胶的可替代资源刻不容缓。杜仲(EucommiaulmoidesOliver.)是在我国广泛分布、具有重要的药用价值的特有珍稀野生药用物种和经济植物资源[1]。研究发现,在杜仲植物的果实、树皮、叶和根中均含有丰富的结构为反式聚异戊二烯的杜仲胶(EucommiaulmoidesOliver. gum)[2]。与三叶橡胶相比,杜仲胶具有“橡塑二重性”的特性[3],即杜仲胶在室温时为无色或略带杂色的皮革状坚韧物质,具有可塑性,10℃时为晶体,当加热到40℃左右时杜仲胶开始表现出弹性,继续加热到100℃时软化,冷却后可恢复原来的性质。基于杜仲胶的热塑性、热弹性和橡胶弹性等优点[4],可利用杜仲胶作为原料开发出各种新式材料,在军工、航空、运输工具、通讯、电力、医疗、建筑工程、体育赛事等方面由着极大应用前景。然而,与成熟的三叶橡胶工业相比,现阶段杜仲胶的产量过低而生产成本相对过高,这在很大程度上制约了杜仲胶的应用和产业的发展。通过对植物体内杜仲胶生物合成代谢途径和分子调控机制的解析,为科学家研究杜仲胶产量提高以及改性提供思路,为杜仲胶的工业化发展提供借鉴。例如,以杜仲胶生物合成代谢途径中的关键酶作为切入点,将相关基因在杜仲体内过量表达或抑制表达,从而使杜仲胶的含量提高,或通过向杜仲体内转入其他物种的产胶相关基因以实现对杜仲胶的改性。
1 杜仲胶
杜仲胶是平均分子量为160000~173000的化学结构为反式聚异戊二烯的长分子链生物大分子(图1)。杜仲胶长链分子结构有序、易堆砌结晶。杜仲胶的晶型有α-晶型和β-晶型两种,二者的熔融温度峰值分别为62℃与52℃[5]。杜仲胶的有序分子链中含有大量的不饱和碳-碳双键,可以在一定条件下对其进行逐步硫化,工业上可充分利用杜仲胶独有的硫化过程这一特性对杜仲胶进行加工利用[6]。
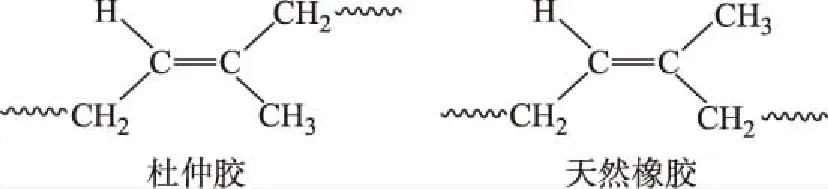
图1 杜仲胶与天然橡胶化学结构单元Fig.1 Structural units of E. ulmoides gum and India rubber
杜仲不同部位的细胞合成杜仲胶的能力不同。杜仲的含胶细胞是一种体积较小、丝状的、两端膨大的单细胞,在其内完成了杜仲胶的生物合成和贮存[7],且广泛存在于杜仲树皮的韧皮部、各级叶脉的韧皮部、部分薄壁组织以及叶片的海绵组织中[8]。含胶细胞完成杜仲胶的生物合成后,由于细胞内空间狭小,新合成的杜仲胶分子只能在细胞内整齐、密集而紧凑的排列在一起,没有交织卷曲现象,形成多个结晶区。含胶细胞内杜仲胶大分子链之间存在着低范德华力,胶丝互不干涉交织,没有水湿润性以及黏性,可以在拉伸和弯曲时自由运动、独立伸长。杜仲胶的聚合量与杜仲细胞的的生长具有一致性,杜仲胶的聚合度会随着杜仲植物体的生长发育、杜仲分泌细胞的延长而不断升高,分子量可达30万以上。
2 杜仲胶生物合成机制
杜仲胶的分子结构为反式聚异戊二烯(Trans-1,4-polyisoprene,TPI),杜仲细胞通过2-C-甲基-D-藓醇-4-磷酸(2-C-Methyl-D-erythritol-4-phosphate,MEP)途径或甲羟戊酸(Mevalonate,MVA)途径生成前体物质异戊烯焦磷酸(Ispentenyldiphosphate,IPP)。部分IPP 在异戊烯基焦磷酸异构酶(Isopentenyl diphosphate isomerase,IDI)的作用下转化为其同分异构体DMAPP。不同分子数的IPP与DMAPP在异戊烯转移酶(Prenyltransferase)的作用下聚合缩合生成起始物香叶基二磷酸(Geranyl diphosphate,GPP)、法呢基二磷酸(Farnesyl diphosphate,FPP)、香叶基香叶基二磷酸(Geranylgeranyl diphosphate,GGPP)[9]。这些起始物在萜类合酶(Terpenesynthases,TPS)的作用下生成TPI,但是起始物到TPI的具体生物合成步骤尚不明确。TPI在细胞质中以颗粒状态积累,并且颗粒之间形成有膜状物,最后TPI颗粒互相交融,颗粒间的膜状物消失,直到整个含胶细胞被TPI充满,形成纤维状的TPI,即为杜仲胶[10]。
2.1 前体物IPP的生物合成
MVA途径(图2)以2个乙酰辅酶A分子(Acetyl-CoA)为起始底物,利用乙酰辅酶A-乙酰基转移酶(Acetyl-CoA-C-acetyltransferase,AACT)、羟甲基戊二酸辅酶A(Hydroxymethylglutaryl-CoA synthase,HMGS)、羟甲基戊二酸辅酶A还原酶(Hydroxymethylglutaryl-CoA reductase,HMGR)、甲羟戊酸激酶(Mevalonate-kinase,MK)、5-磷酸甲羟戊酸激酶(5-Phosphomevalonate kinase,PMK)、4-羟基-3-甲基-2-苯基二磷酸还原酶(4-Hydroxy-3-methylbut-2-enyldiphosphate reductase,HDR)等酶进行一系列生化反应生成IPP。
MEP途径(图2)以丙酮酸和甘油醛-3-磷酸为起始底物,利用1- 脱氧-D-木酮糖-5-磷酸合酶(1-Deoxy-D-xylulose-5-phosphate synthase,DXS)、脱氧木酮糖磷酸盐还原异构酶(1-Deoxy-D-lxylulose-5-phosphate reductoisomerase,DXR)、2-C-甲基-D-赤藓糖醇-4-磷酸胞苷基转移酶(2-C-Methyl-D-erythritol-4-phosphate cytidylyltransferase,MCT)、4-二磷酸胞苷-2-C-甲基赤藓糖激酶(4- Diphosphocytidyl-2-C-methyl-D-erythritolkinase,CMK)、2-甲基赤藓糖-2,4-环二磷酸合酶(2-C-Methyl-D-erythritol 2,4-cyclodiphosphate synthase,MCS)、1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶【1-Hydroxy-2- methyl-2-(E)-butenyl-4-diphosphate synthase,HDS】,异戊烯基单磷酸激酶(Isopentenyl monophosphate kinase,IPK)等酶进行一系列生化反应生成IPP。
2.2 杜仲胶的缩合聚合
IPP与DMAPP形成之后,不同分子数的IPP与DMAPP进行缩合聚合。1分子IPP与1分子DMAPP在香叶基二磷酸合酶(Geranyl diphosphate synthase,GPPS/GPS)的作用下经过缩合生成GPP。2 分子 IPP 和 1 分子DMAPP 在法呢基二磷酸合酶(Farnesyl diphosphate synthase,FPPS/FPS)的作用下生成FPP。3分子IPP 和1分子 D M A P P在香叶基香叶基二磷酸合酶(Geranylgeranyl diphosphate synthase,GGPPS/GGPS)的作用下生成GGPP。
杜仲胶生物合成过程如图2。

图2 杜仲胶生物合成过程Fig. 2 Biosynthesis process of E. ulmoides gum
2.3 杜仲胶生物合成的关键酶
HMGR:HMGR为MVA 途径中的第一个限速酶。杜仲HMGR蛋白定位于内质网上,该酶控制的反应为不可逆反应,具有调控靶点的重要作用[11]。荆腾认为HMGR的过量表达利于异戊二烯的积累且对GGPS、FPS、GPS等基因的表达具有帮助作用[12]。
FPPS:FPPS是杜仲胶生物合成途径分支点的关键酶,FPS催化生成的FPP为重要中间产物[13]。王淋提出杜仲Ⅱ类FPS基因在杜仲胶的合成中起重要作用[14]。Suzuki等通过特定实验证明FPS2和FPS4基因是具有FPS功能的,可能是短链合成相关的基因,即FPS2、FPS4对短链TPI的合成具有重要作用[15]。赵丹通过试验证明转杜仲FPS基因的含胶细胞含胶量多于对照组[16]。
SRPP:小颗粒橡胶蛋白(Small particle rubber protein,SRPP)。Nawamawat等认为橡胶颗粒的膜表面带有负电荷,互相排斥,橡胶颗粒可以融合在一起是因为SRPP起到稳定的作用[17]。然而,刘惠敏认为杜仲橡胶颗粒并不会相排斥,SRPP起到参与杜仲胶合成的作用,并且SRPP与杜仲胶合成酶FPS2共同合成杜仲胶[18],这与Wu-Yun等的发现一致[19]。
REF:橡胶延伸因子(Rubber elongation factor,REF)天然橡胶合成过程中发挥着重要作用。Jin等认为REF3可能参与了杜仲橡胶颗粒膜的稳定性[20]。杨署光等发现巴西橡胶REF的表达水平与胶产量呈现高相关性,这为杜仲REF在杜仲胶生物合成中的相关性研究提供借鉴[21]。
3 展 望
杜仲胶生物合成过程较为复杂,研究发现至少有10余种酶类参与了这一过程,目前对研究较多、功能较为明晰的几个关键酶及其相应编码基因的研究进展进行了回顾。此外,有相关研究推测ACCT2、DXS2、GGPS6等基因对杜仲胶生物合成亦有重要作用。杜仲胶生物合成的过程中miRNA的调控作用也必不可少,叶靖等[22]证明了杜仲n-eu-miR15对其靶基因GGPS6的负调控作用。种种迹象表明杜仲胶生物合成并不是单一的直链过程,而是由多种途径以及相关因子共同作用的结果。
研究发现,包括微生物在内的很多物种体内都存在着完全或不完全的合成杜仲胶的重要中间产物IPP的次级代谢途径,本课题组曾从多株海洋来源的链霉菌基因组中发现了参与XIAMYCIN生物合成的XIA基因簇可以通过MEP途径产生IPP[23]。随着转基因技术水平的提高,研究人员对杜仲胶生物合成的过程了解的更为透彻,从而使我们更加全面地达到调控杜仲胶合成的目的。例如可以考虑将XIA基因簇导入杜仲胶合成细胞,通过植物细胞工程技术,可望实现工厂化体外杜仲胶的生物合成。同样的,将杜仲胶合成细胞中合成IPP下游的基因导入含有IPP合成的上游基因的微生物体内也有望实现杜仲胶的体外工厂化生产。此外,利用基因组编辑技术,定点敲除杜仲胶合成负调控基因,高表达其限速反应的关键基因等也促进杜仲胶产量的提高。总之,随着科学研究的进一步深入以及以现代组学为代表的次级代谢相关技术的不断提高,杜仲胶的生物合成机制终会被研究的更加透彻,从而可能实现工厂化大规模的杜仲胶生产。

