日光诱导叶绿素荧光反演及其在植被环境胁迫监测中的研究进展
彭金龙 李萌 褚荣浩 倪锋 谢鹏飞 蒋跃林 申双和

摘要:日光诱导叶绿素荧光(solar-induced chlorophyll fluorescence,SIF)作为光合作用的直接探针,能对植物的生理状态作出快速、灵敏的响应,与传统监测方法相比具备早期监测植被环境胁迫的能力,弥补了当前植被遥感监测的不足。因此,SIF在植被环境胁迫监测中具有良好的应用前景。然而,有很多因素会对SIF产生影响,使得SIF对植被环境胁迫监测的应用变得更为复杂。本文首先介绍了SIF的来源和反演方法,对比分析了各种反演方法的优缺点,剖析了SIF的影响因素,总结了目前SIF在植被环境胁迫监测中的应用研究,在此基础上指出目前SIF在植被环境胁迫监测应用领域中的不足,最终提出今后可以从SIF的影响因素、反演过程及SIF与植被环境胁迫之间的机制关系等方面开展进一步的研究,旨在为陆地生态系统碳循环及植被胁迫监测等提供理论支持。
关键词:日光诱导叶绿素荧光;反演;植被;胁迫监测;遥感;环境胁迫
中图分类号: S127;S184文献标志码: A
文章编号:1002-1302(2021)24-0029-11
收稿日期:2021-04-22
基金项目:国家自然科学基金(编号:41905100);安徽省自然科学基金(编号:2108085QD157、1908085QD171);国家重点研发计划(编号:2018YFD0300905);安徽农业大学引进与稳定人才资助项目(编号:yj2018-57);安徽农业大学青年基金重点项目(编号:2018zd07)。
作者简介:彭金龙(1996—),男,安徽宿州人,硕士研究生,主要從事农业气象研究。E-mail:jinlongpeng@ahau.edu.cn。
通信作者:李 萌,博士,讲师,主要从事农业气象研究。E-mail:mengli@ahau.edu.cn。
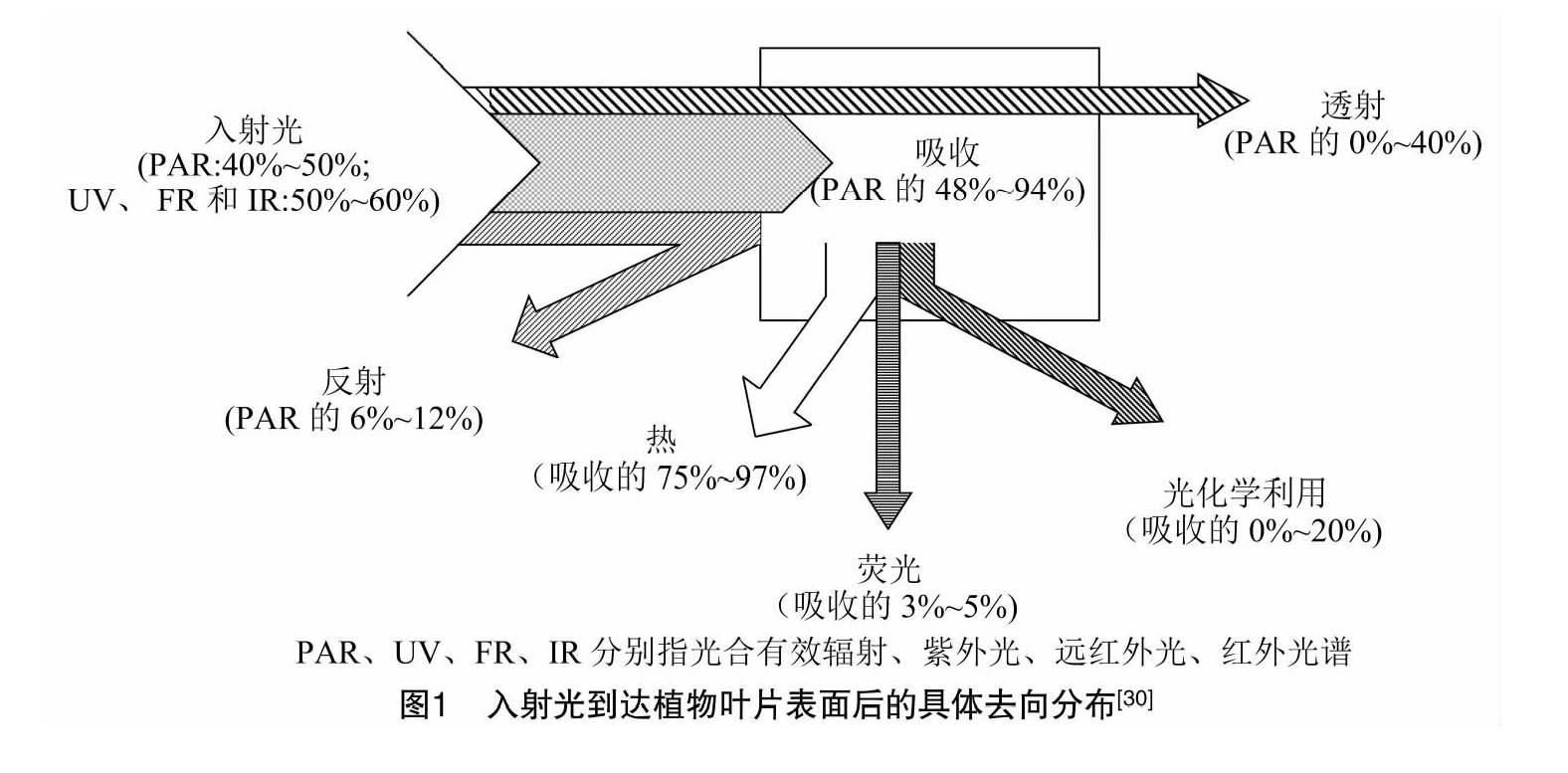
光合作用作为地球上最重要的生物化学反应,是高等植物从陆地大气环境中获取能量的唯一途径[1]。在该途经中,绿色植物通过吸收太阳能,将水和二氧化碳转化为有机物,同时释放出氧气,进而为高等植物进行生命活动提供必要的物质基础[2]。光能在植物叶片内的分配途径主要包括反射、透射和吸收[3],其中被叶片吸收的光能一部分被叶绿素利用后用于进行光合作用,一部分以热的形式向外耗散,另一部分则以荧光的形式重新释放出来[3-4]。其中,日光诱导叶绿素荧光(solar-induced chlorophyll fluorescence,SIF)是植被光合作用吸收光后重新激发的能量,能直接反映植物实际光合作用的动态变化,被认为是监测植被生理状态的直接探针,能够为植被功能变化的准确诊断提供更早期、更直接的方法,并可在大区域尺度下对植被生理状态进行无损监测[5]。目前,由于与光合作用之间存在密切的联系,SIF已被广泛用于近地面、飞机和卫星等多尺度下作物环境胁迫信息的监测。
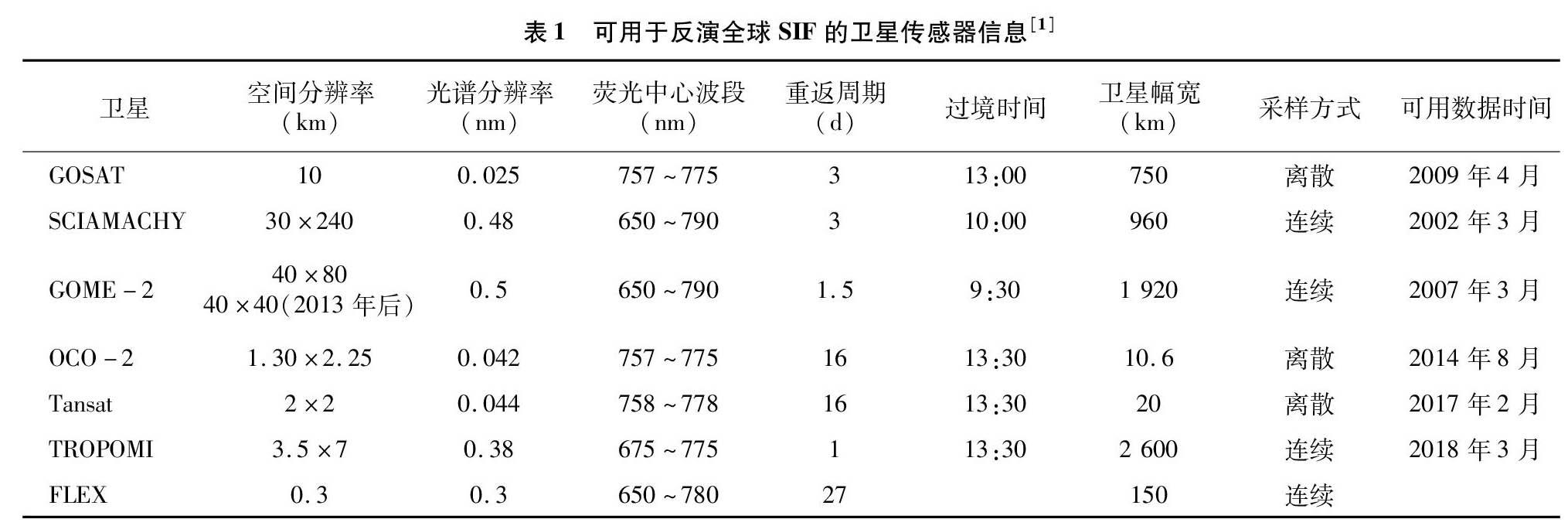
随着科学技术不断发展,SIF相关研究在近10年取得了长足进步。Frankenberg等利用日本温室气体观测卫星(greenhouse gases observing satellite,GOSAT)首次从太空观测到全球陆地叶绿素荧光的季节变化,并反演出全球首张陆地SIF地图,该成果使卫星SIF的应用研究得到了较大推进[6]。尽管GOSAT卫星所搭载的传感器拥有较高的光谱分辨率,但其不能提供空间连续的地表SIF数据[7]。因此,Joiner等利用搭载在欧洲环境卫星(environmental satellite,EnviSat)上的大气层制图扫描成像吸收频谱仪(scanning imaging absorption spectrometer for atmospheric cartography,SCIAMACHY)的观测数据获取了全球空间连续的866 nm处的SIF数据集[7]。Joiner等基于搭载在EUMETAST极地系统MetOp-A/B卫星平台的GOME-2传感器数据,利用主成分分析(principle component analysis,PCA)算法提取出740 nm处的全球连续网格化的SIF数据[8-9]。由于GOME-2能够提供覆盖全球、空间连续的SIF观测数据,且可在开源数据网站上获取相应的格点(空间分辨率为05°×0.5°)和非格点产品数据(ftp://fluo.gps.caltech.edu/data/Philipp/GOME-2/),使其在目前的研究中应用得最广泛[8-9]。然而,当空间尺度较大时(>10 km),很多生态系统会出现较强的空间异质性[10]。考虑到上述SIF产品的较低空间分辨率,且不能在生态系统尺度上与通量站点数据进行直接对比,因此很难将其应用于生态系统尺度上的监测研究[11-13]。Frankenberg等基于太阳同步轨道碳观测卫星2(Orbiting Carbon Observatory-2,OCO-2)携带的高分辨率光谱仪观测数据,利用与GOSAT相似的SIF提取算法,准确提取了757、771 nm 处的SIF数据[11,13]。OCO-2 SIF数据具有较高的空间分辨率,可以很好地在生态系统尺度上直接与通量站点的观测数据进行比较分析[13]。此外,由于OCO-2使用窄波段拟合,使其反演精度更高,但是OCO-2在采用高光谱分辨率、高空间分辨率的同时牺牲了其空间上的连续性,导致部分区域的SIF数据缺失,呈条带状分布。中国的碳卫星(Tansat)于2016年12月发射,其卫星设置与 OCO-2 类似[14]。Du等基于Tansat数据提取出 758.8 nm 处的非连续SIF产品数据,空间分辨率为2 km×2 km,且算法精度明显优于GOME-2等同类产品[14]。尽管OCO-2、Tansat等SIF产品数据有较高的空间分辨率,但是其在空间上具有不连续性,而具有空间连续性的SIF产品数据的空间分辨率普遍较低,上述因素均制约着当前SIF产品数据的应用,使得满足目前各类研究需求的卫星SIF产品依然比较匮乏[15-16]。针对上述问题,Yu等采用原始OCO-2 SIF观测数据和MODIS BRDF校正的沿OCO-2轨道的七波段地表反射率,结合人工神经网络算法构建了高分辨率(时间分辨率为16 d,空间分辨率为0.05°×005°)且空间上连续的全球SIF产品数据(SIFoco2_005)[17]。Li等采用MODIS、MERRA-2数据,通过选定预测模型估算生成了2000—2017年全球SIF产品数据GOSIF(时间分辨率为8 d,空间分辨率为0.05°×0.05°)[18]。此外,欧洲航天局(European Space Agency,ESA)于2017年10月发射了哨兵-5(Sentinel-5P)卫星,其搭载的TROPOMI传感器在725~775 nm内具有 0.38 nm 的光谱分辨率,同样能满足SIF数据反演的需求[19]。Khler等利用TROPOMI传感器的观测数据,在743~758 nm的窗口内获取了740 nm处的SIF数据[19],该产品几乎每天都可进行空间尺度上的连续观测,能够提供覆盖全球的SIF数据,解决了上述SIF产品存在的系列问题。另外,欧洲航天局也预计于2022年发射荧光探测器(fluorescence explorer,FLEX)探测卫星,该卫星能够提供空间上连续且分辨率为0.3 km的全波段SIF产品数据,全面提高了SIF在监测植被环境胁迫方面的能力和精度[1,15]。表1为目前可用于反演全球SIF的相关卫星传感器信息(包括在轨运行和计划发射的)。
综上所述,由于SIF与光合作用之间的独特联系,与传统植被指数相比,其已成为遥感监测植被环境胁迫的全新手段,并能够准确、提前地探测到植被所遭受的环境胁迫信息。在以往的研究中,王冉等着重总结了SIF的原理、反演算法和相关应用研究[4,20],Mohammed等对近50年以来SIF的原理、反演方法及不同平台的综合应用和发展情况进行了归纳总结[21],Jonard等着重分析了植被SIF信息与水文参数之间的关联机制[22],章钊颖等详细介绍了SIF在全球碳循环监测方面的研究进展[5],詹春晖等概述了叶片、冠层和生态系统尺度的相关SIF模型,从建模机制角度对比分析了SIF模型的优劣,并对其未来发展应用前景进行展望[23]。上述研究虽然对SIF的相关应用研究进行了具体总结,但是均未对植被环境胁迫监测方面的研究进展进行详细述评。因此,本文拟着重阐述SIF反演及其在植被环境胁迫监测方面的最新研究进展,并针对SIF的影响因素、反演及与植被环境胁迫之间的机制研究等方面提出建设性研究展望,以期为科研工作者进一步开展SIF相关研究提供指导性建议。
1 SIF的来源
叶绿素荧光是叶绿素分子吸收光能后,在极短的时间内重新释放的红光和近红外波段的光子[12]。当太阳光入射到植物叶片表面时,通常被反射、透射或吸收[24]。如图1所示,植物叶片对红光和蓝光的吸收能力较强,当吸收的能量超过植物光合作用所需的能量时,多余的能量则会以热、荧光等形式释放出来[20]。荧光集中的波段主要包括蓝光(440~450 nm)、绿光(520~530 nm)、红光(690 nm)和远红光(735~780 nm)等。蓝光、绿光波段的荧光主要由不含叶绿素的叶片表皮与叶脉细胞壁的肉桂酸等释放,而红光、远红光波段的荧光主要由叶片叶肉细胞中叶绿体的叶绿素a释放[24]。就单一作物而言,叶片在蓝光和绿光波段释放的荧光强度保持不变,而叶绿素荧光与光合作用之间却呈相反的变化关系[25]。
由于获取手段的差异性,叶绿素荧光主要包括主动、被动诱导叶绿素荧光[15,26],前者以人工光源为辐射源,该方法获取的叶绿素荧光信息量丰富且基本不受天气条件影响[27];后者以太阳光为激发光源,该方法获取的叶绿素荧光受自然条件的影响较大,被称为SIF[27]。总体而言,叶绿素分子吸收光能后主要用于驱动光合作用(光化学反应)、光子形式的再释放(荧光)及热耗散[28]等3个过程,这3个过程之间相互关联而非孤立存在,其中叶绿素荧光发射量与光合作用效率直接相关,可以提供关于光化学反应和热耗散量子效率的有价值的信息[29]。可见,SIF可以作为植被瞬时光合作用活性的理想探针,在植被环境胁迫监测研究中具有很大应用潜力[23]。
2 SIF的获取方法
根据计算过程中的不同物理参数类别,获取SIF的方法主要包括以下几个:(1)基于辐射数据,如天琅禾费荧光测定(Fraunhofer line discrimination,FLD)算法[31]、多光谱数据的3FLD(three bands FLD)算法[32]和cFLD(correct FLD)算法[33]、基于高光谱数据的iFLD(improved FLD)算法[34]以及波谱拟合法(spectral fitting method,SFM)[35]。(2)基于反射率数据,该方法通过叶绿素荧光对叶片或冠层反射的贡献来建立相应的反射率指数,并以该指数作为叶绿素荧光的指征[16]。(3)模型模拟法,该方法也是一种常用的叶绿素荧光获取方法,其中最为典型的冠层尺度模型为土壤冠层观测、光化学与能量通量(soil canopy observation,photochemistry and energy fluxes,SCOPE)模型[36]。
2.1 基于辐亮度的方法
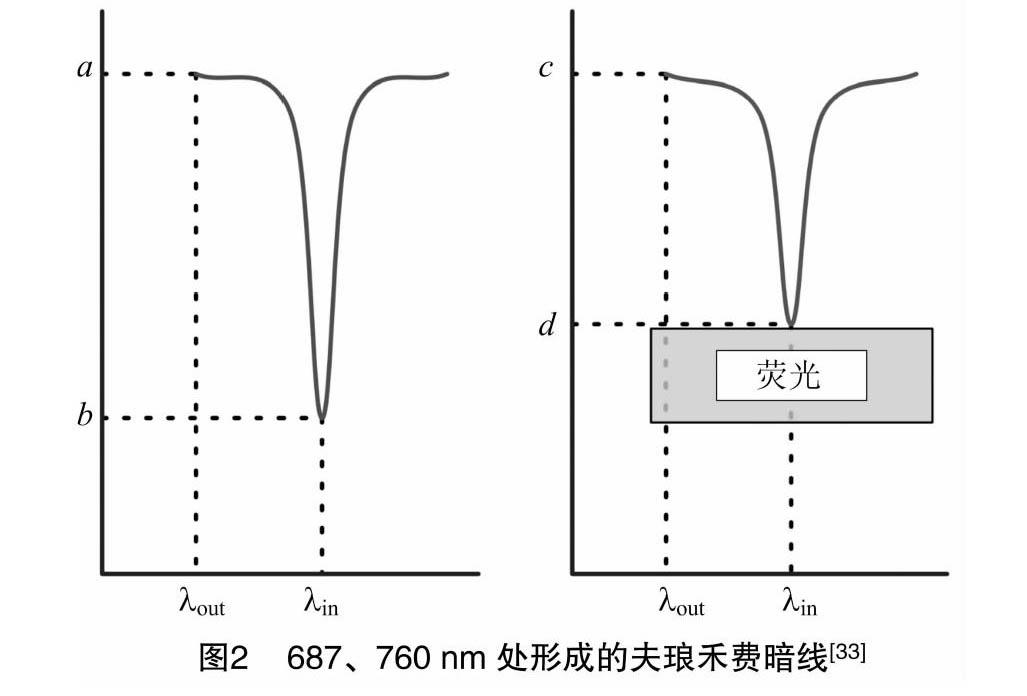
2.1.1 FLD算法 与叶片反射的辐射相比,荧光信号强度非常弱[31]。因此,为了能够较好地测量荧光信号,一般选择入射光很低而荧光比例较高的波长[31]。FLD算法利用大气吸氧带测定植被发出的荧光,氧气(O2)在2个特定的区域强烈吸收辐射,包括760 nm处的O2-A波段和687 nm处的O2-B波段,这2个区域均位于一个非常窄的波段内(≈2 nm),因此到达叶片的波长非常低[33]。FLD算法利用夫琅禾费线内和夫琅禾费线外波段(即λin、λout)的表观辐亮度,同时假设2个波段足够临近[31]。如图2所示,通过将参考目标的吸收线深度(图2中的a、b,在测量中没有荧光发射)与同时测量的植被目标的吸收线深度(图2中的c、d)进行比较,可以估算出植物发出的荧光量(f)和实际的反射率(R)[33],具体计算见公式(1)和公式(2)。
f=a×d-c×da-b;(1)
R=c-da-b。(2)
目前,学者们已基于FLD算法开展了系列研究,McFarlane等利用夫琅禾费暗线原理,研制了叶绿素荧光仪,并对葡萄等植株的荧光参数及荧光量进行探测[37]。张永江等利用FLD算法监测小麦条锈病,结果表明采用该算法得到的荧光强度能够探知田间植株的健康状况[38]。Cheng等使用FLD算法獲得了荧光信号反演的总初级生产力(gross primary production,GPP),并指出该算法能够很好地反映植物光合作用的季节变化[39]。
2.1.2 3FLD算法 虽然FLD算法操作简便,但在实际使用过程中,吸收的线内外波段的反射率值和荧光值之间往往存在一定差异,进而对荧光估算值的准确性产生影响[32]。为了解决FLD算法假设的局限性,Maier等提出了3FLD算法,该算法主要利用夫琅禾费暗线上的1个波段及线上的左右2个波段建立方程并求解,同时假设吸收线附近的荧光和反射率值满足线性变化[32]。该算法在FLD算法的基础上,主要采用吸收线左右两侧波段的太阳入射或反射辐亮度的加权平均值来替代吸收线左侧的太阳入射或反射辐亮度[32]。
2.1.3 iFLD算法 FLD算法假设夫琅禾费暗线内外的荧光值和反射率值是相等的,然而Alonso等研究发现,这一假设可能会给叶绿素荧光反演带来数倍的误差,并提出了一种改进的FLD算法(iFLD),该算法假设吸收线内外的荧光值和反射率值呈非线性变化,并且可以通过2个校正系数来表示[34]。由于荧光光谱和真实反射率难以直接获取,Alonso等采用表观反射率光谱比值代替真实反射率光谱比值,该算法在夫琅禾费暗线外部需要多个波段,在内部需要1个波段,通过3次样条函数对吸收线两侧的波段进行插值并得到插值后的表观反射率,最后用该表观反射率替代真实反射率计算得到反射率比值校正系数[34]。
2.1.4 cFLD算法 该算法是由Gomez-Chova等研究并提出的,其对FLD算法进行了改进,提高了反演值的准确性,包括对O2吸收带反射率和荧光曲线更真实的模拟[33]。结果表明,虽然760 nm波段处的光谱分辨率不是最高的,但是降低了标准FLD算法中色散的估计误差。另一方面,由于基线反射率曲线的假设不合理,即使使用标准的FLD算法,687 nm波段的荧光绝对值也存在较大偏差,但是这个波段对荧光变化仍然很敏感。因此可见,cFLD算法具有较好的辐射灵敏度,可用于760 nm处的荧光估计。
2.1.5 SFM算法 该算法由Meroni等提出,其认为夫琅禾费暗线附近的荧光值和反射率变化均可通过简单的数学方法来描述,从而弥补了FLD算法的线性假设造成的误差[35]。Damm等比较了FLD算法、3FLD算法和iFLD算法发现,FLD算法计算得到的荧光值高于其余2种方法计算得到的荧光值,而3FLD算法、iFLD算法获取的荧光值更加准确[40]。Meroni等利用模拟数据对SFM算法和FLD算法进行对比发现,在任何噪声干扰的情况下,SFM算法的精度都要高于FLD算法[35]。以上几种算法都需要相应的假设前提条件,并不完全符合植被所处的真实环境状况,因此上述几种算法在估算荧光值的过程中均会产生一定误差[4,16],在使用过程中需要根据具体需求选择最优算法。
2.2 基于反射率的方法
该方法实际获取的是反映荧光强度大小的反射率指数[4]。基于反射率的荧光指数大致可分为以下3种类型:反射率比值指数(reflectance ratio index)[41]、导数指数(reflectance derivative index)[42]和填充指数(reflectance infilling index)[43]。
2.2.1 反射率比值指数 Dobrowski等于2005年提出了反射率比值指数,该指数的基本原理是通过计算1个弱荧光波段和1个强荧光波段的反射率的比值,以过滤与反射率相关的光谱信息,进而获取荧光信息[41]。
2.2.2 反射率导数指数 与比值指数类似,反射率导数指数也是一种归一化方法[16],该指数是对反射率进行一阶导数计算得到的[4,16]。Zarco-Tejada等研究发现,计算反射率的一阶导数可以增加荧光的影响,进而能有效监测荧光所引起的微弱变化[42]。
2.2.3 反射率填充指数 Perez-Priego等于2005年研究并提出了反射率填充指数,发现其荧光信号主要通过2个波段反射率的差值相关联[43]。然而,考虑到夫琅禾费暗线的深度受到大气和太阳观测角度变化的共同影响,荧光的大小和夫琅禾费暗线的深度均会对该指数产生一定影响,因此该指数仅适用于相同时间、相同观测条件下的数据对比。
2.3 模型模拟法
SCOPE模型是荷兰特温特大学国际地理信息科学与地球观测学院(ITC)学院的van der Tol等于2009年研究开发的一种综合辐射传输与能量守恒的一维模型,该模型是当前模拟SIF认可度最高且最广泛的模型之一[36]。SCOPE模型中的Fluspect模块和基于任意倾斜叶片散射(scattering by arbitrarily inclined leaves,SAIL)模型的RTMo模块可以分别计算植物叶片和冠层尺度的SIF[44],其中Fluspect模型增加了叶片尺度上SIF的辐射传递,是对PROSPECT模型的进一步扩展[45]。Verrelst等研究发现,SCOPE模型的最大优势是耦合了叶片生理模型和冠层辐射传输模型,能够定量分析不同输入参数对SIF的敏感性,消除生理、非生理参数对SIF的影响[46]。奚雷等研究指出,SCOPE模型可以模拟水稻不同生育期的SIF和GPP[44]。
截至目前,荷兰特温特大学ITC学院的Yang等在首個SCOPE模型版本(SCOPE 1.0)的基础上不断更新完善,于2020年底跳跃性地更新发布了SCOPE 2.0版本[47]。SCOPE 2.0版本的主要目的是通过物理方式将卫星观测的可见光、红外和远红外数据与陆地表面过程联系起来,并量化冠层的微气候[47]。此外,SCOPE 2.0版本也具备了许多新的功能:(1)可以定义由具有不同特性的叶片组成的层,进而可以模拟植被下层或垂直叶绿素浓度梯度;(2)模拟土壤反射率;(3)模拟由叶黄素循环引起的叶片和冠层反射率变化;(4)计算速度与以往版本相比提高了90%。上述新增功能使得SCOPE模型表征复杂植被冠层的能力得到了很大提升,同时也探索了遥感信号对植被生理生态的响应[47]。计算速度的提高使得SCOPE 2.0可以用于卫星数据和地表通量的模拟,还进一步加强了从卫星或机载数据进行地面SIF产品反演的可操作性。
3 SIF的影响因素
影响SIF的因素较多,主要包括植物生理参数和环境因子两大类[15]。其中,植物生理参数方面的影响因素主要包括叶绿素浓度及叶片、冠层结构等[15,48]。
植物吸收光量或光合有效辐射吸收比例的改变主要通过调整其叶片中叶绿素含量的大小来实现的[49]。Adams等研究指出,在较高叶绿素浓度下,单位叶绿素浓度吸收的光能随叶绿素浓度的增加而减少,叶绿素浓度和光吸收量之间存在非线性关系[50-51]。Porcar-Castell等研究发现,植物体内叶绿素对红光、蓝光具有强烈的吸收作用,且红光的穿透力较强,这使得植物吸收不同波段的光照度会随着叶绿素含量的变化而变化[52]。此外,不同叶片结构也会改变进入叶片内部和叶片反射能量的大小,进而影响叶绿素荧光与光合作用之间的关系[53]。Fukshansky等研究指出,光线在叶片内部会经历复杂的反射与散射过程,其进入植物叶片体内的平均路径长度是叶片厚度的2~4倍,这主要是由于叶片分子分布不均匀,进而导致光线在经过等长的路径时遇到的分子数量也有所差异[53]。因此可见,叶片结构是引起辐射传输过程中能量差异的主要原因。此外,在叶片和冠层尺度以高空观测的过程中,叶绿素荧光的重吸收比例及其激发光的穿透能力将对探测器接收荧光能量的大小产生重要影响[54]。
环境因子方面的影响因素主要包括空气温度、饱和水汽压差、太阳天顶角、水分胁迫等[55],其对叶绿素荧光(尤其是SIF)影响重大。Almeida等指出,空气温度和饱和水汽压差等在一定程度上决定了植物气孔的开闭程度,进而通过影响蒸腾作用、光合作用效率来改变SIF。这是由于叶片气孔的关闭直接影响CO2进入植物叶片内,导致光合速率下降、SIF增加[56-57]。Daumard等研究发现,太阳辐射在大气中的穿行路径长度主要取决于太阳天顶角,太阳天顶角越小,其穿行的路径越短,散射辐射越小,叶片接收的能量越强[58]。水分胁迫是一种常见的环境胁迫,Chaves等指出,水分胁迫对植物的影响主要体现在以下2个方面:一是会导致细胞水势减小和气孔关闭,从而减少进入植物体内CO2,最终抑制植物光合作用;二是会损害叶肉光合器官,阻碍光合作用进程[59-60]。上述环境因子在常规状态下通常相伴而生,比如太阳天顶角的变化会改变入射能量的大小,导致地表温度和饱和水汽压差发生改变,进而影响植被蒸腾速率和水分吸收与运输能力,最终引发不同程度的干旱胁迫,改变植物光合速率和SIF释放量[15,48-49]。
4 SIF在植被环境胁迫监测中的研究进展
由于SIF与光合作用之间存在直接联系,其能够从近地面、飞机和卫星等多尺度上监测作物的胁迫信息。与基于传统植被指数的监测方法相比,SIF能够对植被环境胁迫作出快速响应,同时能够提供更为丰富的信息[5]。由于SIF对水分、温度等环境因子的响应十分敏感,因此SIF在植被环境胁迫监测方面的应用研究主要集中在水分胁迫、温度胁迫等方面。
4.1 水分胁迫
水分胁迫主要包括干旱和涝渍胁迫,其中影响较大的是干旱胁迫。干旱会对居民生活用水、农业生产活动、陆地生态系统等产生重大影响,并最终对经济和社会发展产生不利影响[61]。特别是在近年来全球气候变暖加剧、水资源需求增加的背景下,干旱风险日益成为世界性的突出问题[61-62]。准确、及时地监测大规模干旱事件,对于明晰植被对气候变化的响应、保证粮食安全等至关重要[63]。
近几十年来,遥感一直是监测水分胁迫状态的重要手段[64-65]。可见光波段、近红外波段的冠层反射率可以提供植被生长的有效信息,因此基于冠层反射率的各类植被指数(vegetation indices,VIs)相继被开发,并用于田间、区域尺度植被水分胁迫的监测中[66-68]。传统VIs在监测植被对降水的响应过程中存在一定的滞后性,不能及时准确地监测到植被体内水分的动态变化,其中归一化植被指数(normalized difference vegetation index,NDVI)在水分胁迫监测中的应用最为广泛[69]。基于卫星遥感产品数据[如中分辨率成像光谱仪(MODerate resolution imaging spectroradiometer,MODIS)],NDVI可以精确地监测到连续水分胁迫的时空变化特征,在水分胁迫监测和评估中发挥着重要作用[69-70]。然而,NDVI只能反映植被生物量或绿度变化的后期响应,不能反映植物光合作用的早期变化,这限制了其在早期水分胁迫监测中的适用性。因此,亟需找到一种新的监测工具或手段来解决传统VIs在水分胁迫监测中存在的问题。经过国内外学者长期努力探索,SIF作为一种全新的工具被发现,由于SIF与光合作用之间的密切关系,目前利用SIF监测植被水分胁迫状态的研究主要集中在地面试验和航空航天尺度。
在田间试验尺度方面,研究者主要以农作物为监测对象,采用人工控水的处理方法来形成不同梯度等级的水分胁迫,并采用便携式光谱仪等来获取作物冠层光谱信息,实时监测作物生长状况[5]。Perez-Priego等研究证明,冠层SIF可以用于基于地面测量的水分胁迫监测[43]。Dobrowski等研究发现,在红边光谱区域计算的简单反射率指数可以追踪水分胁迫引起的SIF变化,从而实现与植物生理过程直接相关的作物水分胁迫的快速评估[41]。Daumard等通过SIF的连续地面测量进一步指出,SIF可以较早地检测到高粱田发生的可逆性水分胁迫,且从航空图像SIF信号中可以检测到高粱田在水分胁迫条件下的生理变化[71]。Acˇ等研究指出,在叶片和冠层尺度上,SIF信号强度的下降与水分胁迫有关[72]。Liu等在对干旱条件下小麦SIF响应机制的研究中发现,SIF对干旱的发生极为敏感,能够提供更早的干旱发展信息,可用于干旱的早期监测中[73]。此外,SIF在封閉性冠层的干旱监测中更为可行,可以检测土壤湿度,提供不同干旱条件下表层土壤的水分信息。
在航空航天尺度开展基于SIF的水分胁迫监测研究,数据来源主要包括机载光谱设备或卫星遥感影像等,其中机载光谱设备与地面监测设备需要保持同步运行,以保证观测数据的一致性,进而采用地面监测结果对高空监测结果的精度进行有效验证[5,74]。卫星遥感影像可以实现大范围连续实时观测,对SIF在区域尺度的应用具有重要意义。Zarco-Tejada等通过航空高光谱数据探究了叶绿素含量和叶面积指数(LAI)等植被冠层参数对荧光信息的影响,指出可以使用机载传感器来获取冠层尺度的荧光信息,并可用于监测作物的干旱胁迫状态[75]。Lee等研究发现,干旱胁迫会使SIF和传统VIs同时降低,但在不同干旱胁迫程度下,二者的递减趋势不一致,在严重干旱胁迫下,二者的下降趋势较为明显;在中度干旱胁迫下,SIF显著降低,而传统VIs变化较小。此外,不同植被覆盖类型的SIF信息对干旱事件的响应程度也存在差异[76]。Yoshida等研究指出,混交林的SIF对干旱的敏感性不如农田和草原[77]。Sun等研究发现,SIF对植被结构和生理生化参数的变化十分敏感,具有极佳的动态干旱监测潜力[78]。Wang等研究发现,SIF与通量估算的GPP之间具有很好的一致性,在极端干旱条件下,SIF和GPP保持同步下降;在生长高峰期,SIF的下降幅度大于GPP;而在衰老过程中,GPP仍在继续降低,而SIF的降低趋势有所缓解[79]。Chen等发现,SIF对干旱的发生较为敏感,可用于及时监测农业生态系统上发生的干旱[80]。Wang等研究发现,SIF可以合理地捕捉干旱事件发展的时空动态变化,且在干旱的早期发展阶段,SIF较传统VIs有明显的下降和提前的响应,对于准确和及时监测干旱事件的发展具有很大潜力[81]。Zhang等研究发现,SIF作为植被实际光合作用的直接探针,比传统VIs具有更多的优势[82]。因此可见,卫星SIF可以用来进行大尺度下的水分胁迫监测研究。但是由于目前荧光产品数据较少,暂时不能直接提供高分辨率且空间连续的地表SIF数据,后期仍需开展大量工作[19,49]。
综上,利用SIF对水分胁迫的监测研究仍然处于早期阶段,已有的研究仍较少或不全面。此外,在实际情况下,水分胁迫并不会单独存在,其他因子也会对SIF产生一定影响,如何系统探究SIF对复合胁迫的响应仍需进一步探讨。
4.2 温度胁迫
极端温度是限制作物产量最严重的非生物胁迫之一。然而,考虑到气候变化下热浪或低温事件的频率和严重程度的增加,了解农作物对温度胁迫的响应仍然有限。卫星遥感对植被生长状况的观测为量化温度对作物的影响提供了独特的机会[83]。传统VIs,如NDVI和增强型植被指数(enhanced vegetation index,EVI)等通常用来评价作物生长状况和预测作物产量[84-86]。其他植被指数如捕捉叶黄素循环的光化学指数(photochemical reflectance index,PRI),可以监测到叶黄素色素环氧化的状态,并可指征植物色素由于光能利用率的变化而变化[87-88]。然而,植被指数可能无法检测到由气候因子胁迫引起的植被光合功能的快速变化[89]。许多研究发现,SIF与植物实际光合作用有直接关系,当植物受到温度胁迫时,SIF可以实现快速响应。
与水分胁迫类似,利用SIF对温度胁迫的监测研究也是从地面试验和航空航天尺度开展的。Agati发现,在低温胁迫下,红光波段荧光的增加值要低于远红光波段荧光的增加值,进而导致两者比值降低[90]。Dobrowski等研究发现,在红边光谱区域计算的简单反射率指数可以追踪到温度胁迫引起的SIF变化,从而提供与植物生理生长过程直接相关的胁迫信息的快速评估[41]。Acˇ等研究指出,在叶片水平上,低温会使SIF显著提高,而热胁迫并不会使SIF显著降低[72]。Song等在对印度恒河平原冬小麦热胁迫的研究中发现,SIF异常的空间形态与研究区热应力的时间演变密切相关,且SIF可以提供大规模、与生理相关的小麦胁迫响应[89]。Wang等指出,SIF可以合理地捕捉热胁迫发展的时空动态,在热胁迫的早期阶段,SIF产量与传统植被指数相比有提前反应,呈现明显的下降趋势[81]。此外,SIF产量异常对高水汽亏缺比低土壤水分更為敏感,SIF对于准确及时地监测热胁迫的发展也具有很大潜力。Zhang等研究发现,与植物吸收的光合有效辐射(absorbed photosynthetically active radiation,APAR)相比,SIF对温度更为敏感。对于不同植被覆盖类型而言,其对应的SIF对温度的响应程度也不一致[82]。Pinto等研究发现,将SIF与相关反射率指数相结合来估计热胁迫引起的冠层光合作用的变化是有潜力的[91]。
综上所述,与传统VIs相比,SIF在机制上与光合作用有关,且在温度胁迫监测方面显示出一定的优势。同时,有研究发现,SIF在植被遭受温度胁迫时具有早期预警能力。然而,在区域及全球尺度条件下,SIF是否具有高温及其他胁迫的早期预警能力还需要进一步研究。
4.3 其他胁迫
目前,基于SIF的植被环境胁迫监测的研究主要集中在水分胁迫和温度胁迫方面,关于其他胁迫的研究仍较少且缺乏系统性。在重金属胁迫相关研究方面,瞿瑛等研究发现,农作物在受到重金属Cu胁迫时,其SIF的辐射特征会发生改变[92-93],进而可以采用SIF来间接指征植被遭受重金属胁迫时的强度。在病害胁迫研究方面,赵叶等研究指出,SIF与传统反射率光谱数据相比,对小麦条锈病的响应更为敏感,能够实现作物病害的早期诊断[94]。陈思媛等研究发现,SIF能够显著提高小麦条锈病病情严重程度的光谱探测精度,进而能够有效地应用于小麦条锈病的遥感探测中[95]。竞霞等在将基于反射率方法提取的SIF数据用于小麦条锈病病情严重度估测模型的构建中,发现该模型更加适用于小麦条锈病病情严重度的遥感探测[96]。此外,竞霞等研究发现,冠层SIF数据更加适用于冬小麦条锈病的早期探测[97]。
5 结论与展望
5.1 结论
作为光合作用的直接探针,SIF反应灵敏、测定快速且简便,同时对样本无损害,可以直接反映植物的光合作用状态及其与环境胁迫之间的关系。然而,目前关于SIF的研究仍处于初级阶段,SIF作为一种十分灵敏的植被信息,容易受到多种因素的影响,使得SIF对植被环境胁迫监测的研究变得更加复杂。因此,有必要针对SIF的影响因素、反演算法和SIF与环境胁迫之间的关系等方面开展深入研究,从而进一步发挥SIF在植物环境胁迫监测中的重要作用和价值,也可为植物生理学、农业科学、生态学、农业气象学等相关领域的研究提供理论支撑。
5.2 展望
随着研究技术的不断发展,植被叶绿素荧光遥感在近10年间取得了长足进步,特别是Frankenberg等于2011年利用GOSAT数据反演出全球首张陆地SIF地图,极大推进了SIF遥感研究应用的进步[6]。本研究介绍了已有卫星SIF产品的研究进展,分析了SIF的来源、反演方法及其优缺点,阐述了SIF的影响因素,重点总结了SIF在植被环境胁迫监测方面的发展状况。但是目前仍没有专门进行SIF探测的卫星,所使用的卫星SIF产品也存在时空分辨率低、空间不连续等问题,且在SIF的影响因素、SIF的反演算法、SIF与植被环境胁迫之间的机制等研究领域依然存在诸多问题。针对上述存在的问题及研究状况,未来可从以下几个方向开展相关研究。
(1)SIF的影响因素。由于不同植被类型的SIF释放量水平受到不同光合途径、不同冠层特征和不同生理特性等的影响,在今后的研究中,有必要对不同地物类型进行分类,根据不同地物的SIF释放特征进行细化研究。此外,由于不同波段SIF的特征也有差异,因此有必要对比不同波段的SIF特征,以选取最适波段进行后续研究。
将SIF信息从叶片尺度上升到冠层尺度以及从冠层尺度再上升到生态系统尺度的升尺度过程中存在尺度效应问题,目前解决该问题仍存在一定挑战。在叶片尺度上,SIF信息与植被光合作用过程密切相关,而当研究尺度上升到冠层尺度之后,冠层的结构特征及光线在冠层中的吸收、散射规律等均会对SIF信息造成不同程度的影响。尤其在植被受到环境胁迫时,冠层结构特征将会发生改变,进一步造成SIF信息的复杂化。因此,在今后的研究中,可以同时关联分析叶片尺度的SIF信息和对应冠层尺度的SIF信息,以明晰尺度效应的影响。在SIF信息从冠层尺度上升到生态系统尺度的研究中,尺度效应主要受到空间和时间2个方面因素的限制。在空间因素方面,由于SIF信号的释放存在强烈的不均一性,同时环境因子也存在不同程度的空间异质性,加大了升尺度研究的难度;在时间因素方面,作物生长季的变化、生物量的变化以及冠层结构特征的变化均会对遥感SIF信息的获取造成一定影响,进一步加深了研究的难度。由于无人机、航空飞机等观测系统的观测尺度可以达到米至数千米,因此在今后的研究中,可以引入无人机、航空飞机观测系统来进行进一步的细化研究。
由于植被光合作用极易受到外界因素的影响,进而导致SIF信息也容易受到外界环境的影响,在后续的研究中,可以综合考虑植被类型、地理因素、环境因素等诸多因素的影响,借助模型找出主要影响因子来获取相应数据。此外,植物受到的环境胁迫往往是极其复杂的,比如高温和干旱胁迫经常相伴而生且互相影响,在多种环境胁迫的共同影响下,SIF在不同时空尺度、不同作物类型中的演变规律也有待进一步研究。
(2)SIF的反演。根据SIF反演算法的原理,其反演过程主要利用SIF对夫琅禾费暗线的“井”填充效应,而夫琅和费暗线的宽度极窄,通常在亚纳米级。因此,如果传感器的光谱分辨率愈高,则原始暗线深度愈深,“井”填充效应也更加显著,使得反演结果的可靠性越强。在今后的研究中,针对卫星尺度SIF的反演,其反演精度与传感器的分辨率、信噪比等密不可分。综合考虑当前光谱分辨率、信噪比、光谱覆盖范围等因素,大多数数据源为679~780 nm波段且具有0.3 nm左右分辨率的数据。然而,目前大多数反演算法集中于近红外波段,红光波段的SIF反演仍不够成熟,红光波段及红边波段的SIF反演仍有待进一步深入研究,以期为全波段SIF的反演和SIF数据的深入挖掘提供有力帮助。此外,现有的一些SIF反演算法存在误差较大、不确定性高等问题,如何改进现有算法也有待进一步探讨。
(3)SIF与植被环境胁迫之间的机制研究。由于自然界中胁迫发生的过程往往十分复杂,一种胁迫的发生往往会带来其他胁迫因子,因此在今后的研究中,有必要针对多种胁迫因子影响下的SIF发生机制进行研究,分析不同胁迫因子对SIF的影响程度及SIF对不同胁迫因子的敏感性差异。此外,由于植物在不同生长季、不同等级胁迫的敏感程度不同,因此有必要针对不同等级胁迫发生的不同时期,定量分析其对植物的影响。
对于同类型的植被而言,在不同空间尺度下,由于观测水平受到辐射传输过程的影響,SIF的产生和传输必然会受到相应影响,尤其在胁迫因子的作用下,植被的生理特性、冠层结构等会使传输过程变得更为复杂。因此,有必要研究不同空间尺度、多种观测角度下植被SIF对胁迫因子的响应差异。
此外,陆地生态系统往往由多种植被类型共同构成,因此有必要研究SIF信息在不同植被类型下的敏感性差异,以期为区域尺度SIF的相关研究奠定理论基础。
参考文献:
[1]黄 鹏. 基于日光诱导叶绿素荧光的陆地总初级生产力估算[D]. 武汉:武汉理工大学,2019.
[2]张永江. 植物叶绿素荧光被动遥感探测及应用研究[D]. 杭州:浙江大学,2006.
[3]刘青瑞,居为民,张永光,等. 日光诱导叶绿素荧光估算中国典型生态系统总初级生产力的能力[J]. 遥感技术与应用,2017,32(2):363-373.
[4]王 冉,刘志刚,杨沛琦. 植物日光诱导叶绿素荧光的遥感原理及研究进展[J]. 地球科学进展,2012,27(11):1221-1228.
[5]章钊颖,王松寒,邱 博,等. 日光诱导叶绿素荧光遥感反演及碳循环应用进展[J]. 遥感学报,2019,23(1):37-52.
[6]Frankenberg C,Fisher J B,Worden J,et al. New global observations of the terrestrial carbon cycle from GOSAT:Patterns of plant fluorescence with gross primary productivity[J]. Geophysical Research Letters,2011,38(17):351-365.
[7]Joiner J,Yoshida Y,Vasilkov A P,et al. Filling-in of near-infrared solar lines by terrestrial fluorescence and other geophysical effects:simulations and space-based observations from SCIAMACHY and GOSAT[J]. Atmospheric Measurement Techniques,2012,5:809-829.
[8]Joiner J,Guanter L,Lindstrot R,et al. Global monitoring of terrestrial chlorophyll fluorescence from moderate-spectral-resolution near-infrared satellite measurements:methodology,simulations,and application to GOME-2[J]. Atmospheric Measurement Techniques,2013,6:2803-2823.
[9]Khler P,Guanter L,Joiner J. A linear method for the retrieval of sun-induced chlorophyll fluorescence from GOME-2 and SCIAMACHY data[J]. Atmospheric Measurement Techniques,2015,8:2589-2608.
[10]Pickett S T A,Cadanasso M L. 景观生态学:生态系统的空间异质性[J]. 生态学杂志,1999,18(6):71-74.
[11]Frankenberg C,ODell C,Berry J,et al. Prospects for chlorophyll fluorescence remote sensing from the Orbiting Carbon Observatory-2[J]. Remote Sensing of Environment,2014,147:1-12.
[12]关琳琳. 基于叶绿素荧光的植被总初级生产力估算[D]. 北京:中国科学院大学(中国科学院遥感与数字地球研究所),2017.
[13]Sun Y,Frankenberg C,Jung M,et al. Overview of solar-induced chlorophyll fluorescence (SIF) from the Orbiting Carbon Observatory-2:retrieval,cross-mission comparison,and global monitoring for GPP[J]. Remote Sensing of Environment,2018,209:808-823.
[14]Du S S,Liu L Y,Liu X J,et al. Retrieval of global terrestrial solar-induced chlorophyll fluorescence from TanSat satellite[J]. Science Bulletin,2018,63(22):1502-1512.
[15]刘雷震,武建军,周洪奎,等. 叶绿素荧光及其在水分胁迫监测中的研究进展[J]. 光谱学与光谱分析,2017,37(9):2780-2787.
[16]问静怡. 基于日光诱导荧光的水稻铜胁迫遥感监测机理研究[D]. 杭州:杭州师范大学,2019.
[17]Yu L,Wen J,Chang C Y,et al. High-resolution global contiguous SIF of OCO-2[J]. Geophysical Research Letters,2019,46(3):1449-1458.
[18]Li X,Xiao J. A global,0.05-degree product of solar-induced chlorophyll fluorescence derived from OCO-2,MODIS,and reanalysis data[J]. Remote Sensing,2019,11(5):517.
[19]Khler P,Frankenberg C,Magney T S,et al. Global retrievals of solar-induced chlorophyll fluorescence with TROPOMI:first results and intersensor comparison to OCO-2[J]. Geophysical Research Letters,2018,45(19):10456-10463.
[20]张永江,刘良云,侯名语,等. 植物叶绿素荧光遥感研究进展[J]. 遙感学报,2009,13(5):963-978.
[21]Mohammed G H,Colombo R,Middleton E M,et al. Remote sensing of solar-induced chlorophyll fluorescence (SIF) in vegetation:50 years of progress[J]. Remote Sensing of Environment,2019,231:111177.
[22]Jonard F,Cannière S D,Brüggemann N,et al. Value of sun-induced chlorophyll fluorescence for quantifying hydrological states and fluxes:current status and challenges[J]. Agricultural and Forest Meteorology,2020,291:108088.
[23]詹春晖,章钊颖,张永光. 日光诱导叶绿素荧光辐射传输模型研究进展[J]. 遥感学报,2020,24(8):945-957.
[24]丑述仁. 光化学植被指数和日光诱导叶绿素荧光与作物光合作用的关系[D]. 南京:南京大学,2018.
[25]梁 寅,李军营,张云伟. 日光诱导叶绿素荧光遥感探测的研究进展[J]. 中国农学通报,2013,29(14):107-112.
[26]刘新杰. 日光诱导叶绿素荧光的遥感反演研究[D]. 北京:中国科学院大学,2016.
[27]胡姣婵. 植被冠层叶绿素荧光遥感反演及不确定性分析[D]. 北京:中国科学院大学,2015.
[28]郭 健. 塔基平台的日光诱导叶绿素荧光观测与GPP估算[D]. 西安:西安科技大学,2019.
[29]程占慧,刘良云. 基于叶绿素荧光发射光谱的光能利用率探测[J]. 农业工程学报,2010,26(增刊2):74-80.
[30]Vidaver W E,Lister G R,Brooke R C,et al. A manual for the use of variable chlorophyll fluorescence in the assessment of the ecophysiology of conifer seedlings[R]. Victoria,BC:Forestry Canada,Pacific Forestry Centre and the BC Ministry of Forests,1991.
[31]Plascyk J A. The MK Ⅱ Fraunhofer Line Discriminator (FLD-Ⅱ) for airborne and orbital remote sensing of solar-stimulated luminescence[J]. Optical Engineering,1975,14(4):339-346.
[32]Maier S W,Günther K P,Stellmes M. Sun-induced fluorescence:a new tool for precision farming[M]. Germany:ASA Special Publications,2004.
[33]Gomez-Chova L,Alonsochorda L,Amoros-Lopez J,et al. Solar induced fluorescence measurements using a field spectroradiometer[J]. AIP Conference Proceedings,2006,852:274-281.
[34]Alonso L,Gomez-Chova L,Vila-Frances J,et al. Improved fraunhofer line discrimination method for vegetation fluorescence quantification[J]. IEEE Geoscience and Remote Sensing Letters,2008,5(4):620-624.
[35]Meroni M,Busetto L,Colombo R,et al. Performance of spectral fitting methods for vegetation fluorescence quantification[J]. Remote Sensing of Environment,2010,114(2):363-374.
[36]van der Tol C,Verhoef W,Timmermans J,et al. An integrated model of soil-canopy spectral radiances,photosynthesis,fluorescence,temperature and energy balance[J]. Biogeosciences,2009,6:3109-3129.
[37]McFarlane R,Hamilton C. A fluorescence based dissolved oxygen sensor[J]. Proceedings of SPIE,1987,798:324-330.
[38]张永江,黄文江,王纪华,等. 基于Fraunhofer线的小麦条锈病荧光遥感探测[J]. 中国农业科学,2007,40(1):78-83.
[39]Cheng Y B,Middleton E M,Zhang Q,et al. Integrating solar induced fluorescence and the photochemical reflectance index for estimating gross primary production in a cornfield[J]. Remote Sensing,2013,5(12):6857-6879.
[40]Damm A,Erler A,Hillen W,et al. Modeling the impact of spectral sensor configurations on the FLD retrieval accuracy of sun-induced chlorophyll fluorescence[J]. Remote Sensing of Environment,2011,115(8):1882-1892.
[41]Dobrowski S Z,Pushnik J C,Zarco-Tejada P J,et al. Simple reflectance indices track heat and water stress-induced changes in steady-state chlorophyll fluorescence at the canopy scale[J]. Remote Sensing of Environment,2005,97(3):403-414.
[42]Zarco-Tejada P J,Pushnik J C,Dobrowski S,et al. Steady-state chlorophyll a fluorescence detection from canopy derivative reflectance and double-peak red-edge effects[J]. Remote Sensing of Environment,2003,84(2):283-294.
[43]Perez-Priego O,Zarco-Tejada P J,Miller J R,et al. Detection of water stress in orchard trees with a high-resolution spectrometer through chlorophyll fluorescence in-filling of the O2-A band[J]. IEEE Transactions on Geoscience and Remote Sensing,2005,43(12):2860-2869.
[44]奚 雷,單 楠,杨沈斌,等. 基于SCOPE模型的水稻不同生育期日光诱导叶绿素荧光及GPP模拟研究[J]. 遥感技术与应用,2019,34(3):488-499.
[45]Hu J C,Liu X J,Liu L Y,et al. Evaluating the performance of the SCOPE model in simulating canopy solar-induced chlorophyll fluorescence[J]. Remote Sensing,2018,10(2):250.
[46]Verrelst J,Rivera J P,van der Tol C,et al. Global sensitivity analysis of the SCOPE model:what drives simulated canopy-leaving sun-induced fluorescence?[J]. Remote Sensing of Environment,2015,166:8-21.
[47]Yang P Q,Prikaziuk E,Verhoef W,et al. SCOPE 2.0:a model to simulate vegetated land surface fluxes and satellite signals[J]. Geoscientific Model Development,2021,14(7):4697-4712.
[48]張永江,赵春江,刘良云,等. 被动荧光探测水分胁迫对玉米叶片影响的初步研究[J]. 农业工程学报,2006,22(9):39-43.
[49]薛惠云. 基于高光谱和荧光的棉花水分胁迫探测研究[D]. 保定:河北农业大学,2013.
[50]Adams W W,Demmig-Adams B. Carotenoid composition and down regulation of photosystem Ⅱ in three conifer species during the winter[J]. Physiologia Plantarum,1994,92(3):451-458.
[51]Gitelson A A,Buschmann C,Lichtenthaler H K. Leaf chlorophyll fluorescence corrected for re-absorption by means of absorption and reflectance measurements[J]. Journal of Plant Physiology,1998,152(2/3):283-296.
[52]Porcar-Castell A,Tyystjrvi E,Atherton J,et al. Linking chlorophyll a fluorescence to photosynthesis for remote sensing applications:mechanisms and challenges[J]. Journal of Experimental Botany,2014,65(15):4065-4095.
[53]Fukshansky L,Remisowsky A M V,McClendon J,et al. Absorption spectra of leaves corrected for scattering and distributional error:a radiative transfer and absorption statistics treatment[J]. Photochemistry and Photobiology,2010,57(3):538-555.
[54]Meroni M,Colombo R. Leaf level detection of solar induced chlorophyll fluorescence by means of a subnanometer resolution spectroradiometer[J]. Remote Sensing of Environment,2006,103(4):438-448.
[55]钱 新. 基于叶绿素荧光遥感的植被干旱胁迫指数构建[D]. 南京:南京大学,2019.
[56]Almeida A C,Landsberg J J. Evaluating methods of estimating global radiation and vapor pressure deficit using a dense network of automatic weather stations in coastal Brazil[J]. Agricultural and Forest Meteorology,2003,118(3/4):237-250.
[57]Xu L K,Baldocchi D D. Seasonal trends in photosynthetic parameters and stomatal conductance of blue oak (Quercus douglasii) under prolonged summer drought and high temperature[J]. Tree Physiology,2003,23(13):865-877.
[58]Daumard F,Goulas Y,Champagne S,et al. Continuous monitoring of canopy level sun-induced chlorophyll fluorescence during the growth of a sorghum field[J]. IEEE Transactions on Geoscience and Remote Sensing,2012,50(11):4292-4300.
[59]Chaves M M,Pereira J S. Water stress,CO2 and climate change[J]. Journal of Experimental Botany,1992,43(8):1131-1139.
[60]Flexas J,Bota J,Galmés J,et al. Keeping a positive carbon balance under adverse conditions:responses of photosynthesis and respiration to water stress[J]. Physiologia Plantarum,2006,127(3):343-352.
[61]郭艳春. 干旱灾害风险评估及管理对策探析[J]. 地下水,2019,44(4):148-149.
[62]纪瑞鹏,于文颖,冯 锐,等. 作物对干旱胁迫的响应过程与早期识别技術研究进展[J]. 灾害学,2019,34(2):153-160.
[63]胡鹏飞. 基于多源遥感数据的农业旱情监测方法比较研究[D]. 兰州:西北师范大学,2019.
[64]张 峰,周广胜. 植被含水量高光谱遥感监测研究进展[J]. 植物生态学报,2018,42(5):517-525.
[65]李 萌. 夏玉米理化参数对连续水分胁迫的响应特征及遥感监测[D]. 南京:南京信息工程大学,2018.
[66]孙 慧. 基于高光谱监测的干旱胁迫下冬小麦生长生理响应研究[D]. 太原:山西农业大学,2019.
[67]庞素菲. 基于温度-植被-降水指数(TVPDI)的中国北方干旱监测研究[D]. 兰州:西北师范大学,2020.
[68]杨菲菲,李世娟,刘升平,等. 作物环境胁迫高光谱遥感监测研究进展[J]. 中国农业科技导报,2020,22(4):85-93.
[69]张小强,冯 彬,王云燕. 运用MODIS对我国西南地区极端干旱情况监测与评估研究——以2009—2010年遥感数据为例[J]. 环境保护科学,2020,46(1):135-141.
[70]黄泽林. 利用MODIS数据监测大面积土壤水分与农作物旱情研究[J]. 安徽农业科学,2008,36(11):4784-4787.
[71]Daumard F,Champagne S,Fournier A,et al. A field platform for continuous measurement of canopy fluorescence[J]. IEEE Transactions on Geoscience and Remote Sensing,2010,48(9):3358-3368.
[72]Acˇ A,Malenovsk Z,Olejnícˇková J,et al. Meta-analysis assessing potential of steady-state chlorophyll fluorescence for remote sensing detection of plant water,temperature and nitrogen stress[J]. Remote Sensing of Environment,2015,168:420-436.
[73]Liu L Z,Yang X,Zhou H K,et al. Evaluating the utility of solar-induced chlorophyll fluorescence for drought monitoring by comparison with NDVI derived from wheat canopy[J]. Science of the Total Environment,2018,625:1208-1217.
[74]王 冉,刘志刚,冯海宽,等. 基于近地面高光谱影像的冬小麦日光诱导叶绿素荧光提取与分析[J]. 光谱学与光谱分析,2013,33(9):2451-2454.
[75]Zarco-Tejada P J,Berni J A J,Suárez L,et al. Imaging chlorophyll fluorescence with an airborne narrow-band multispectral camera for vegetation stress detection[J]. Remote Sensing of Environment,2009,113(6):1262-1275.
[76]Lee J E,Frankenberg C,van der Tol C,et al. Forest productivity and water stress in Amazonia:observations from GOSAT chlorophyll fluorescence[J]. Proceedings of the Royal Society B:Biological Sciences,2013,280:20130171.
[77]Yoshida Y,Joiner J,Tucker C,et al. The 2010 Russian drought impact on satellite measurements of solar-induced chlorophyll fluorescence:insights from modeling and comparisons with parameters derived from satellite reflectances[J]. Remote Sensing of Environment,2015,166:163-177.
[78]Sun Y,Fu R,Dickinson R,et al. Drought onset mechanisms revealed by satellite solar-induced chlorophyll fluorescence:insights from two contrasting extreme events[J]. Journal of Geophysical Research:Biogeosciences,2016,120(11):2427-2440.
[79]Wang S,Huang C,Zhang L,et al. Monitoring and assessing the 2012 drought in the Great Plains:analyzing satellite-retrieved solar-induced chlorophyll fluorescence,drought indices,and gross primary production[J]. Remote Sensing,2016,8(2):61.
[80]Chen X J,Mo X G,Zhang Y C,et al. Drought detection and assessment with solar-induced chlorophyll fluorescence in summer maize growth period over North China Plain[J]. Ecological Indicators,2019,104:347-356.
[81]Wang X R,Qiu B,Li W K,et al. Impacts of drought and heatwave on the terrestrial ecosystem in China as revealed by satellite solar-induced chlorophyll fluorescence[J]. Science of the Total Environment,2019,693:133627.
[82]Zhang L F,Qiao N,Huang C P,et al. Monitoring drought effects on vegetation productivity using satellite solar-induced chlorophyll fluorescence[J]. Remote Sensing,2019,11(4):378.
[83]石 涛,杨太明,黄 勇,等. 无人机多光谱遥感监测水稻高温胁迫的关键技术[J]. 中国农业气象,2020,41(9):597-604.
[84]陈朝晖,朱 江,徐兴奎. 利用归一化植被指数研究植被分类、面积估算和不确定性分析的进展[J]. 气候与环境研究,2004,9(4):687-696.
[85]谢晓金,李映雪,李秉柏,等. 高温胁迫下水稻产量的高光谱估测研究[J]. 中国水稻科学,2010,24(2):196-202.
[86]谢晓金,申双和,李映雪,等. 高温胁迫下水稻红边特征及SPAD和LAI的监测[J]. 农业工程学报,2010,26(3):183-190.
[87]吴朝阳,牛 铮. 植物光化学植被指数对叶片生化组分参数的敏感性[J]. 中国科学院研究生院学报,2008,25(3):346-354.
[88]彭 濤,姚 广,高辉远,等. 植物叶片和冠层光化学反射指数与叶黄素循环的关系[J]. 生态学报,2009,29(4):1987-1993.
[89]Song L,Guanter L,Guan K,et al. Satellite sun-induced chlorophyll fluorescence detects early response of winter wheat to heat stress in the Indian Indo-Gangetic Plains[J]. Global Change Biology,2018,24(9):4023-4037.
[90]Agati G. Response of the in vivo chlorophyll fluorescence spectrum to environmental factors and laser excitation wavelength[J]. Pure and Applied Optics,1999,7(4):797.
[91]Pinto F,Celesti M,Acebron K,et al. Dynamics of sun-induced chlorophyll fluorescence and reflectance to detect stress-induced variations in canopy photosynthesis[J]. Plant,Cell & Environment,2020,43(7):1637-1654.
[92]瞿 瑛,刘素红,李小文. 重金属Cu胁迫下典型农作物叶片日光诱导荧光辐射特征提取研究[J]. 光谱学与光谱分析,2012,32(5):1282-1286.
[93]朱冰雪,陈圣波,周 超,等. Cu胁迫下油菜叶片日光诱导荧光辐射特征[J]. 科学技术与工程,2018,18(10):1-5.
[94]赵叶,竞 霞,黄文江,等. 日光诱导叶绿素荧光与反射率光谱数据监测小麦条锈病严重度的对比分析[J]. 光谱学与光谱分析,2019,39(9):2739-2745.
[95]陈思媛,竞 霞,董莹莹,等. 基于日光诱导叶绿素荧光与反射率光谱的小麦条锈病探测研究[J]. 遥感技术与应用,2019,34(3):511-520.
[96]竞 霞,白宗璠,张 腾,等. 3FLD和反射率荧光指数估测小麦条锈病病情严重度的对比分析[J]. 中国农机化学报,2019,40(11):136-142.
[97]竞 霞,吕小艳,张 超,等. 基于SIF-PLS模型的冬小麦条锈病早期光谱探测[J]. 农业机械学报,2020,51(6):191-197.

