凡纳滨对虾急性肝胰腺坏死病病原分离鉴定及耐药性分析
林 楠
(福建省水产技术推广总站,福建 福州 350002)
近年来随着对虾养殖业的不断发展,各类新型对虾传染性疾病频发,如急性肝胰腺坏死病(Acute hepatopancreas necrosis disease,AHPND)[1]、肝肠胞虫(Enterocytozoon hepatopenaei,EHP)病[2]、虹彩病毒(Shrimp hemocyte iridescent virus,SHIV)病[3]等,已经严重威胁我国对虾产业的可持续发展。急性肝胰腺坏死病是近年全球范围内对对虾养殖影响较为严重的急性传染病之一。患病对虾主要临床症状表现为肝胰腺萎缩、颜色变浅,空肠空胃,甲壳变软,失去活力等,常为急性死亡,死亡率高达100%。由于该病主要感染放养后7~30 d的虾苗,又被称为早期死亡综合征(Early mortality syndrome,EMS),可感染包括凡纳滨对虾(Litopenaeusvannamei)、斑节对虾(Penaeusmonodon)和中国明对虾(Penaeusjaponicus)等对虾种类[4]。该传染病是由携带含毒力基因pirAVP和pirBVP质粒pVA1的弧菌引起的,该质粒能够表达毒力蛋白PirAVP和PirBVP。目前已报道可引起AHPND的病原菌有副溶血弧菌(Vibrioparahemolyticus)、欧文氏弧菌(Vibrioowensii)、坎贝氏弧菌(Vibriocampestris)等[5-7]。2019年7月,福州市某养殖场发生养殖凡纳滨对虾暴发死亡,死亡率约70%,发病对虾临床症状符合典型AHPND症状。本研究对疑似患AHPND的对虾进行了病原分离鉴定、致病性和耐药性分析,以期掌握该病原的生物学基本特征,为AHPND的流行病学研究和防控技术开发提供基础资料。
1 材料与方法
1.1 试验材料
1.1.1 试验用虾
患病凡纳滨对虾样品于2019年7月采自福建省福州市某养殖场,个体全长为6.2~7.3 cm。回归感染实验用健康凡纳滨对虾来源于福州另一家养殖场,全长为4.1~5.5 cm。实验期间养殖水温为(28±1)℃,按照正常对虾养殖方式管理。实验前实验用虾暂养1周。
1.1.2 主要实验仪器
PCR仪来自BIO-RAD公司,型号:T100TMThermal Cycler;凝胶成像仪来自Bio-Rad,型号:GelDoc XR+;全自动细菌鉴定系统来自梅里埃公司,型号:VITEK 2 Compact;基质辅助激光解析电离飞行时间质谱仪(Matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)来自BRUKER公司,型号:microflex LT。
1.1.3 主要实验试剂
TCBS(Thiosulfate-citrate-bile salt-sucrose agar,硫柠胆蔗琼脂)、TSA(Tryptic soy agar,胰蛋白胨大豆琼脂)、TSB(Tryptic soy broth,胰蛋白胨大豆肉汤)、弧菌显色培养基、血琼脂培养基、营养琼脂平板均购自广东环凯公司,核酸提取试剂盒、PCR premix试剂盒均购自宝生物工程公司。药物敏感性试验所用抗生素类原料药均由全国水产技术推广总站提供,包括氨苄青霉素、硫酸新霉素等14种药物。
1.2 试验方法
1.2.1 病原分离与鉴定
1)细菌分离
在无菌条件下用接种环蘸取患病对虾肝胰腺组织,划线接种于TCBS培养基、TSA培养基和弧菌显色培养基固体平板,于28℃恒温倒置培养24~48 h,观察菌落形态特征。对分离菌株进行革兰氏染色,观察其个体形态和染色特性。挑取固体平板上占优势的单菌落进行培养。培养后用40%甘油保存于-80℃冰箱。
2)回归感染实验
分离菌株划线接种营养琼脂平板,28℃培养24 h,挑取单菌落接种于TSB液体培养基,28℃培养24 h,计数,调整菌液浓度至5×108CFU/mL。健康凡纳滨对虾随机分成2个组(实验组、对照组),每组30尾,每组设3个平行。
实验组:将300 mL浓度为5×108CFU/mL的菌液离心沉淀,等体积灭菌海水重悬,加入盛有2 700 mL灭菌海水的养殖桶中,充气;将30尾健康实验凡纳滨对虾置于其中浸浴15 min。将100 mL浓度为5×108CFU/mL的菌液加入盛有15 L灭菌海水的养殖桶中,将浸浴后的实验凡纳滨对虾移入其中充气养殖持续感染,每6小时观察实验对虾变化。实验期间正常投喂和换水。
对照组:参照实验组处理方法,灭菌海水不加菌液处理。
3)菌株的生化鉴定
分离菌株划线接种于血琼脂平板,于28℃恒温倒置培养24 h,挑取单菌落,使用VITEK 2 Compact全自动细菌鉴定系统进行菌株的生化鉴定。
4)菌株的分子生物学鉴定
参考贾丹等[8]的方法,对菌株相关基因进行分子生物学鉴定。菌株核酸提取步骤参照Viral RNA/DNA Extraction Kit试剂盒说明书。取PCR管分别加入引物(10 mmol/L)1 μL,模板DNA 1 μL,Premix Taq预混试剂12.5 μL,DEPC水9.5 μL,混匀,瞬时离心。16s rRNA反应程序为:先94℃预变性3 min,然后94℃变性1 min,55℃退火1 min 20 s,72℃延伸2 min,以上作35个循环,最后72℃延伸5 min,4℃保温。其余基因反应程序参照各引物来源文献(表1)。用TAE缓冲液配制含GelRed染料的1.5%琼脂糖凝胶,PCR产物120 V恒压凝胶电泳,置于凝胶成像仪观察,拍照。产物送铂尚生物技术公司测序。测序结果提交BLAST进行序列比对分析。

表1 菌株分子生物学鉴定所用引物Tab.1 The primer sequences used in this study
5)菌株的MALDI-TOF质谱鉴定
分离菌株划线接种于血琼脂平板,于28℃恒温倒置培养24 h,挑取单菌落,均匀涂布靶板,待干燥后30 min内加基质液覆盖,使用MALDI-TOF MS质谱仪鉴定。
1.2.2 药物敏感性试验
分离菌株接种于TSB液体培养基中,置于28℃恒温摇床培养24 h。将供试药物配制成200 mg/L初始浓度,在96孔板按10倍倍比稀释成11个药物梯度,依次加入120 μL浓度为106CFU/mL的待测菌悬液;置于(28±2)℃恒温培养箱中培养24 h,观察各孔细菌生长情况,以抑制细菌生长的药物最高稀释度作为供试菌株该药物的最小抑菌浓度(MIC)。从肉眼判定无细菌生长的每孔中取100 μL待测菌液分别移种至琼脂平板上培养24 h后,观察能杀死99.9%接种的细菌(即每个平板不超过5个菌落)的最低抗菌药物浓度,即为供试药物的最低杀菌浓度(MBC)。
2 结果与分析
2.1 病原分离与鉴定
2.1.1 菌株分离情况及形态特征
从患病对虾肝胰腺组织中分离得到1株优势菌,命名为FJLV01。该菌在TCBS、TSA、弧菌显色培养基平板上均生长良好。如图1所示,在弧菌显色培养基平板上呈紫色,在TCBS平板上菌落呈蓝绿色,菌落圆形,边缘较整齐,半透明,直径约2~4 mm。菌株革兰氏染色呈阴性,显微镜下形态为稍弯曲的短杆状。
2.1.2 病原回归感染
疑似患急性肝胰腺坏死病的凡纳滨对虾活力减弱、摄食减少,样品体色发白,虾壳变软,肝胰腺明显萎缩苍白。回归感染后的凡纳滨对虾出现AHPND典型症状,即肝胰腺萎缩、颜色变浅、空肠空胃、活力变弱等(图2),与疑似患急性肝胰腺坏死病的对虾样品症状一致,实验组对虾在72 h内全部死亡,对照组无异常。取实验组对虾肝胰腺、肠道,使用AHPNDPirvpA&PirvpB分子生物学鉴定方法进行检测,结果呈阳性。对感染病虾进行细菌分离和生化鉴定,显示病虾的肝胰腺、肠道组织含副溶血弧菌。
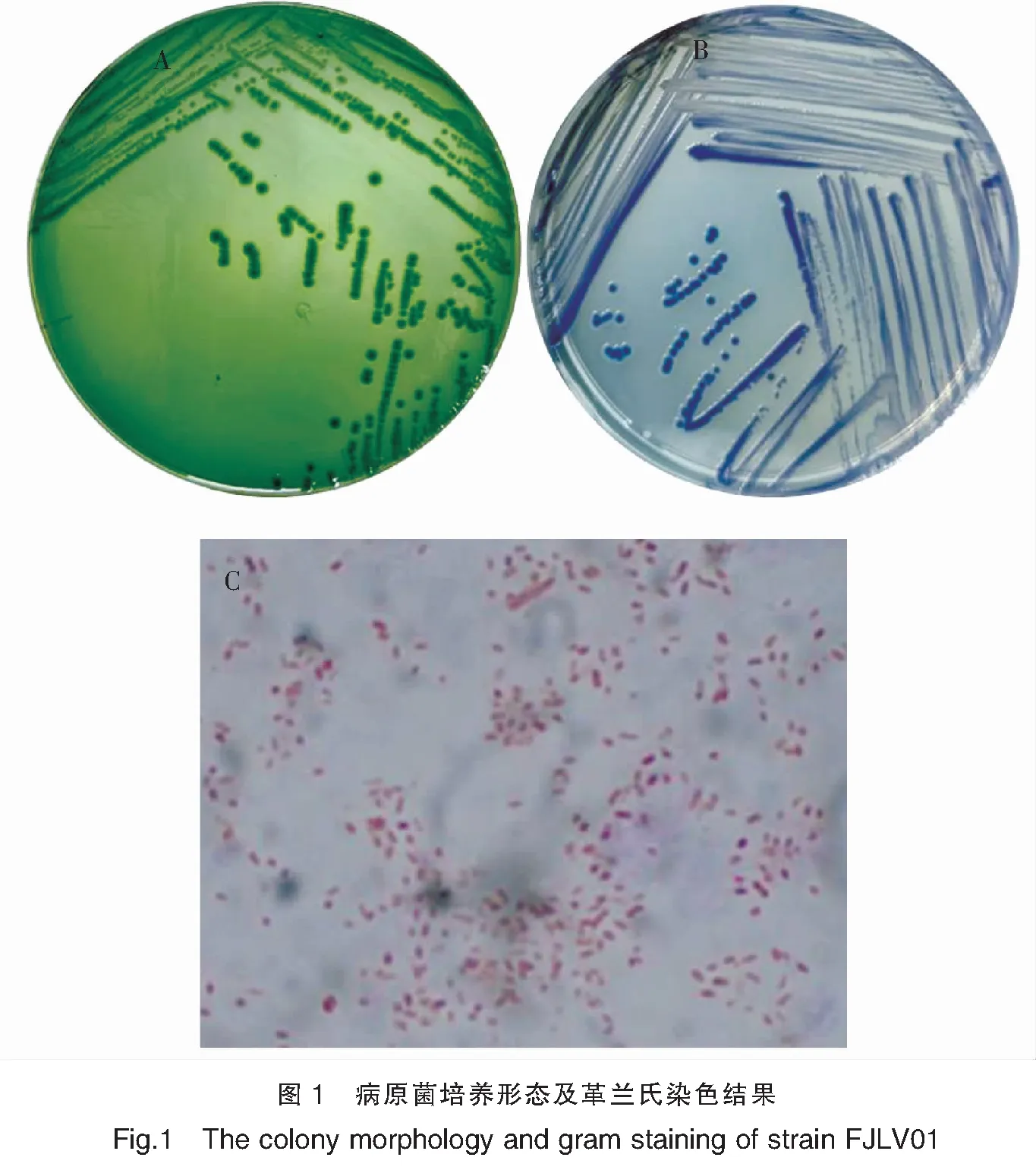
注:A为菌株在TCBS培养基上形态;B为菌株在弧菌显色培养基上形态;C为菌株革兰氏染色40×显微观察结果。
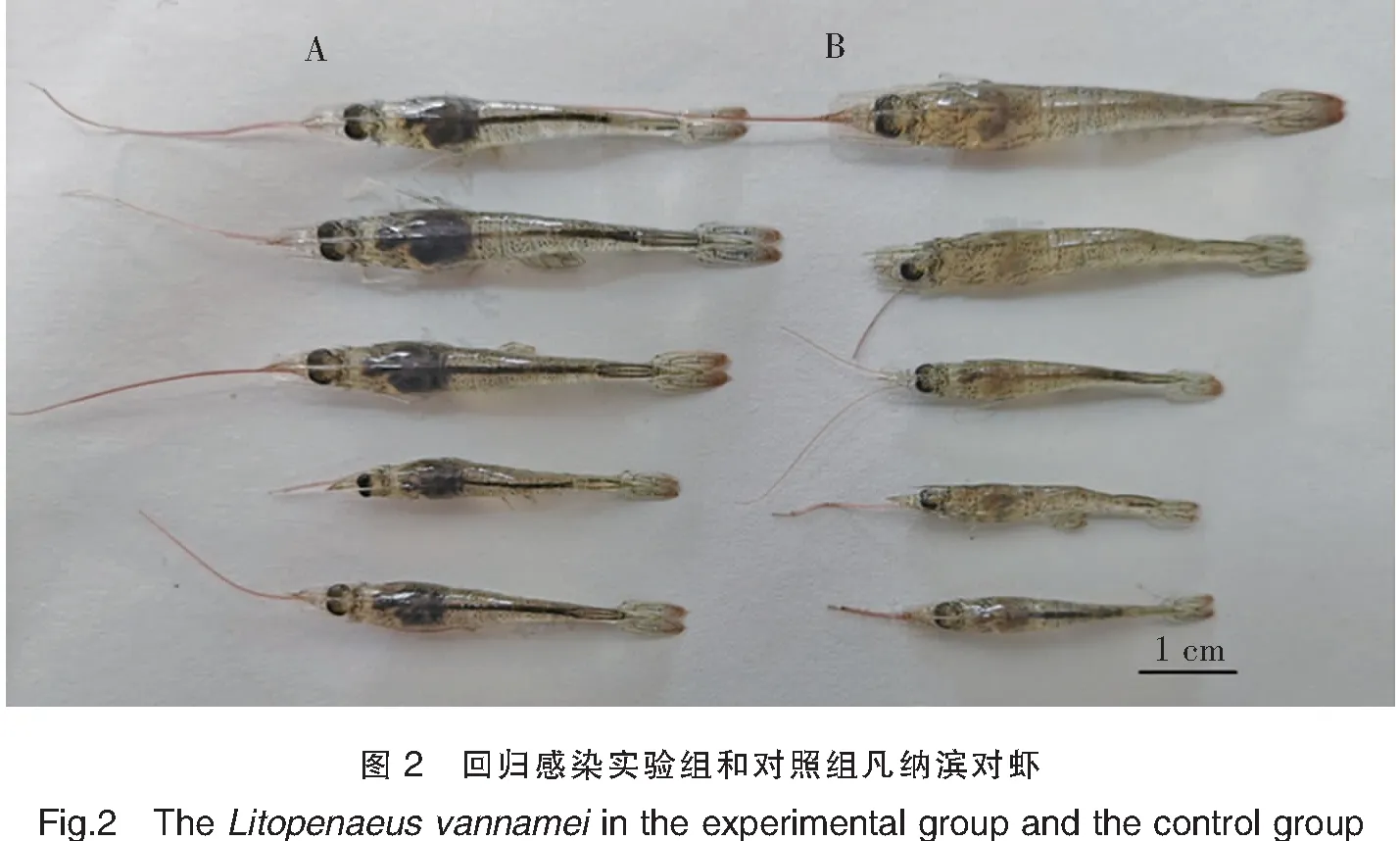
注:A为对照组对虾;B为实验组对虾。
2.1.3 16S rRNA扩增情况和系统发育分析
基于16S rRNA序列构建分离菌株的系统发育树,从构建的系统发育树(图3)可知,该分离菌株与副溶血弧菌、哈维氏弧菌等归属在同一分支里,即与弧菌聚为一类,这表明该分离菌株为弧菌属。

2.1.4 菌株的生化鉴定
VITEK 2全自动细菌鉴定系统对分离得到菌株的生化指标鉴定结果如表2所示。结果显示,分离得到的菌株为副溶血弧菌,与标准菌株的符合概率为93%。
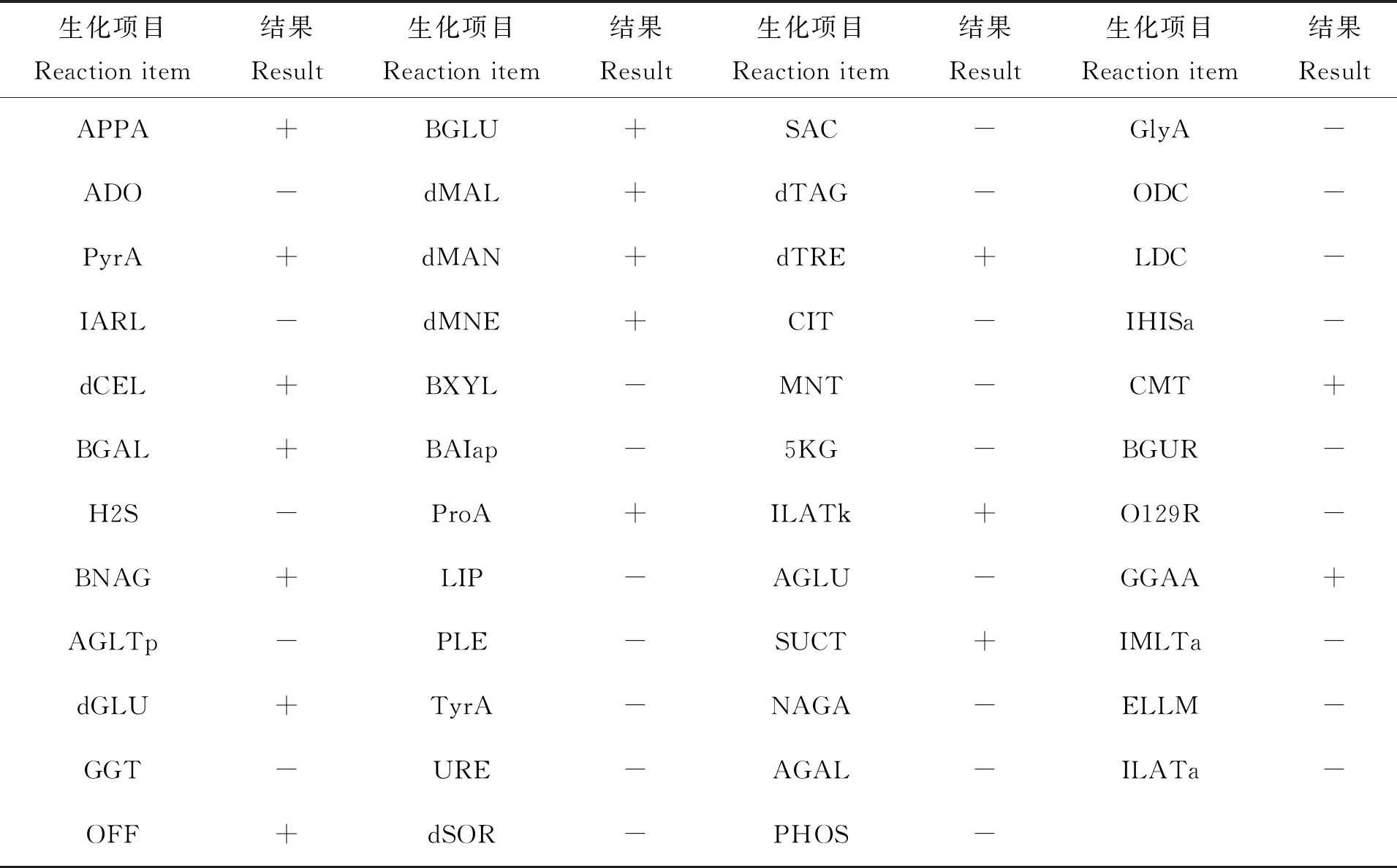
表2 菌株的生理生化特性Tab.2 Physiology and biochemistry characteristics of strain FJLV01
2.1.5 MALDI-TOF质谱快速鉴定
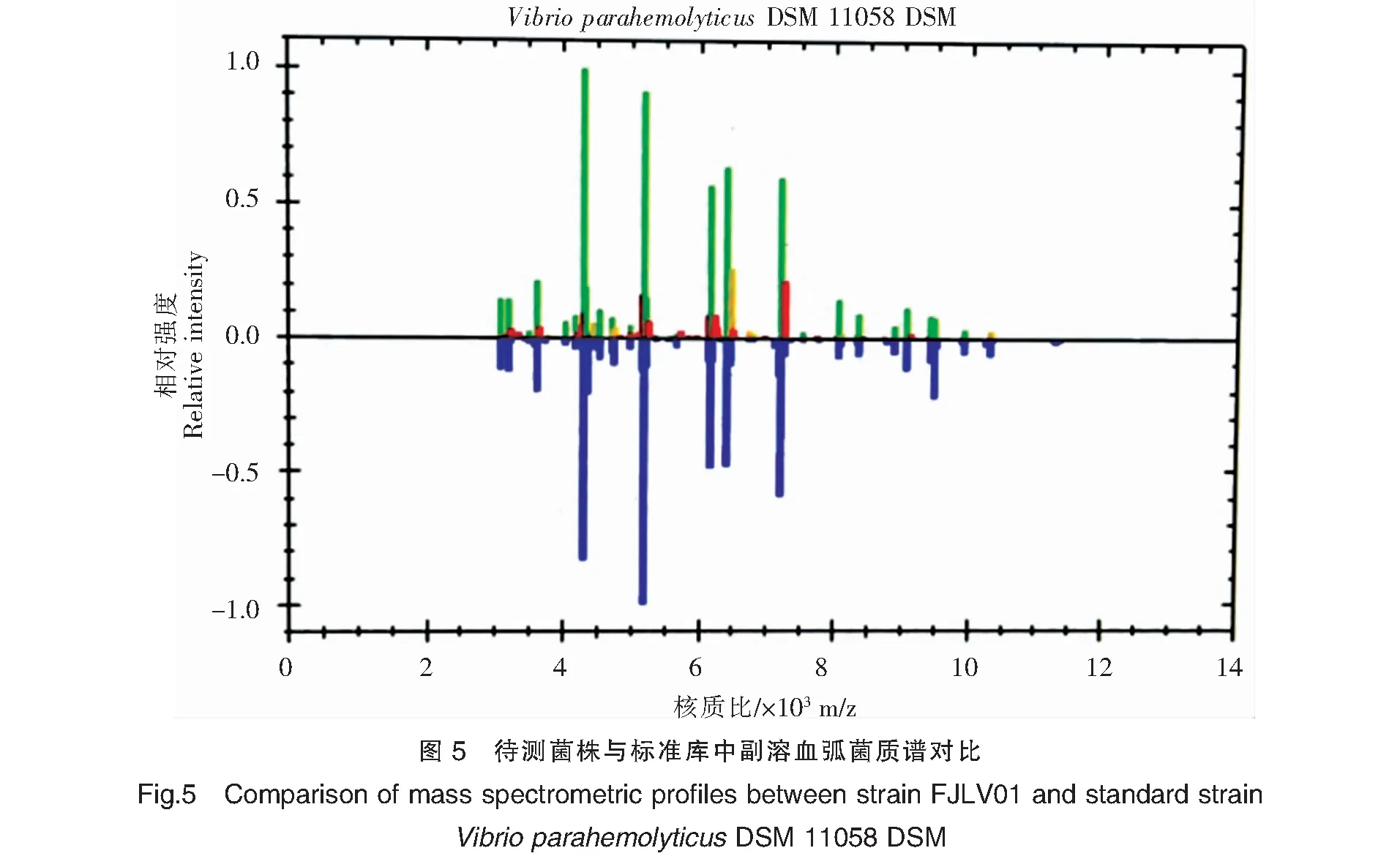
菌株的MALDI-TOF MS鉴定结果见图4、图5。菌株的两次检测均出现相同的特征峰,且与标准菌株库中副溶血弧菌 DSM 11058 DSM的特征峰基本一致,系统评分2.31(+++),表示可鉴定到种的水平,判定为副溶血弧菌。
2.1.6 菌株的毒力基因分析
毒力基因分析结果显示,菌株的PirvpA、PirvpB、PirvpA&PirvpB基因的PCR扩增结果均为阳性(图6),目的条带大小分别约为284、392、230 bp,扩增产物送测序,测序结果经BLAST序列比对分析,与已知的以上三种基因序列相似性均达99%以上。菌株的耐热溶血毒素基因Tdh和耐热溶血毒素相关基因Trh的扩增结果则均为阴性。
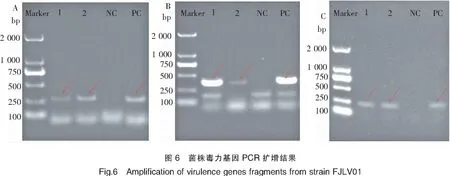
注:A为PirvpA基因扩增结果;B为PirvpB基因扩增结果;C为PirvpA & PirvpB基因扩增结果。泳道1、2以菌液为模板;泳道NC为阴性对照;泳道PC为阳性对照。
2.2 菌株的耐药性分析
参考CLSI,M45 3rd Edition,菌株的耐药性分析结果见表3,可看出分离得到的该病原菌对甲砜霉素、氟苯尼考、磺胺嘧啶、磺胺甲恶唑、磺胺二甲氧嘧啶、磺胺间甲氧嘧啶等6种药物敏感;对氨苄西林钠、盐酸土霉素、盐酸环丙沙星、强力霉素等4种药物耐药;对硫酸新霉素、恩诺沙星等2种药物则表现为中介。
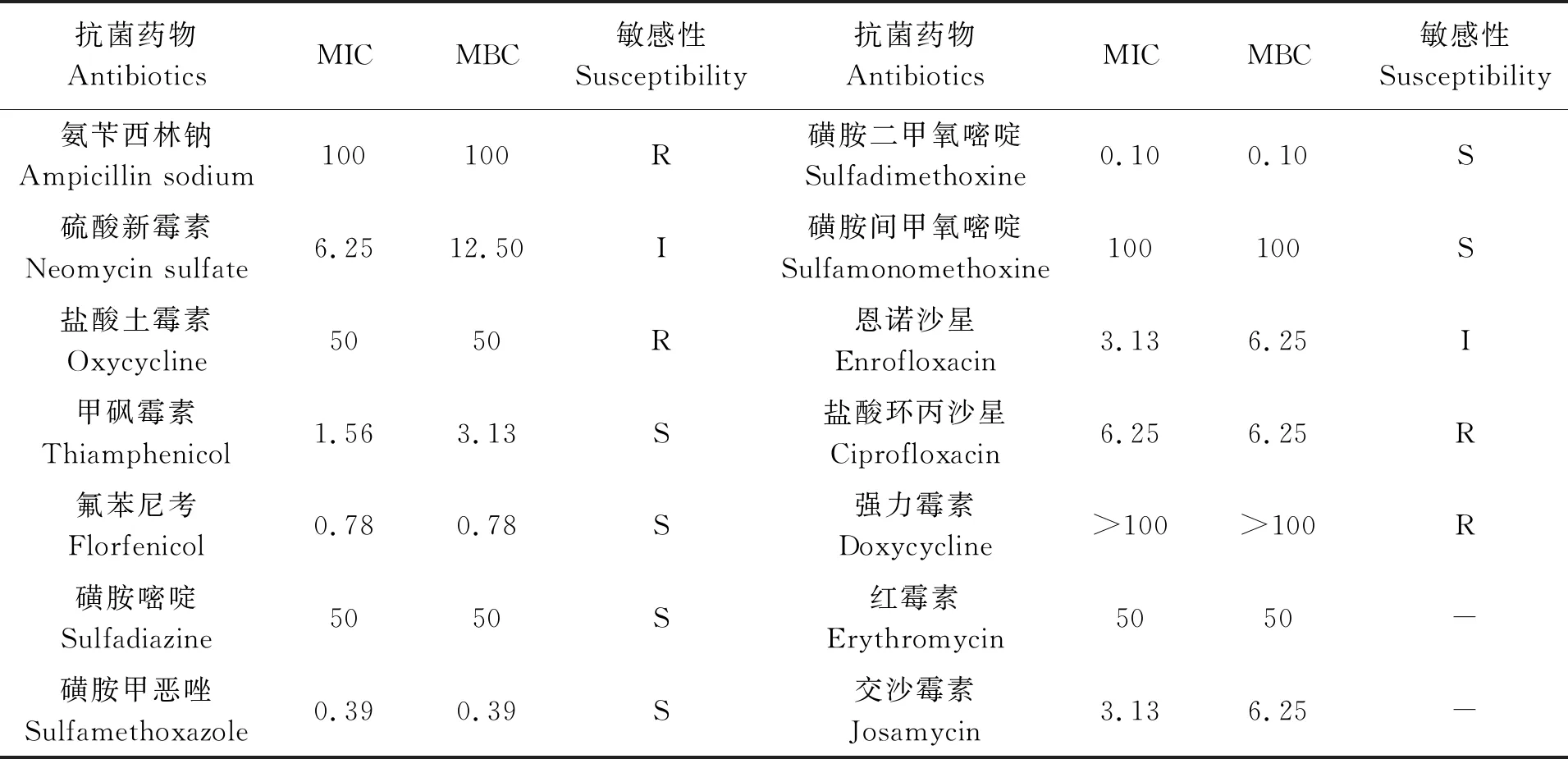
表3 菌株的药物敏感性分析结果Tab.3 Drug susceptibility of strain FJLV01 μg/mL
3 讨论
2009年中国首次报道了急性肝胰腺坏死病引起的对虾急性死亡[13],随后在越南、马来西亚、泰国、墨西哥等国家相继有该病发生[14]。2013年5月,国际水产联盟(GAA)和联合国粮食及农业组织(FAO)先后宣布AHPND病原为副溶血弧菌的特异变种。国内学者针对AHPND的致病机理、病原特性、防控方法等方面做了大量研究,也取得了一定的进展[15-17]。相关学者分离了副溶血弧菌、哈维氏弧菌(Vibrioharveyi)、溶藻弧菌(Vibrioalginolyticus)等急性肝胰腺坏死病致病菌[18],本研究从福州某养殖场患病凡纳滨对虾肝胰腺组织分离出一株携带毒力基因PirvpA和PirvpB的副溶血弧菌,这与相关研究结果相一致。
3.1 副溶血弧菌的毒力基因
副溶血弧菌广泛存在于海岸和海水中,作为人类食源性致病菌,能引起肠胃炎和败血症,目前其已成为许多沿海国家细菌性食物中毒的首位病原菌[19]。副溶血弧菌的致病机理目前仍未十分清楚,但有两个致病因子已明确,即由Tdh基因编码的耐热直接溶血毒素和由Trh基因编码的相对耐热溶血毒素[20-21]。本研究对分离的副溶血弧菌进行了以上两个毒力基因的检测,结果均为阴性。但pirAVP和pirBVP基因检测结果为阳性,这两种毒力基因可编码毒力蛋白PirABVP,该蛋白是AHPND的致病因子。这一结果与贾丹等[8]的研究结果相一致。
3.2 AHPND致病菌的分离鉴定方法
在GB/T 4789.7—2008中,TCBS和弧菌显色培养基都是副溶血弧菌检测推荐使用的培养基[22]。TCBS培养平板因其成本低、使用方便(仅需观察菌落为黄色或绿色),而被广泛应用于对虾养殖一线AHPND的初筛,但在准确性方面却有较大局限。不携带含毒力基因pirAVP和pirBVP的副溶血弧菌或不能利用蔗糖的非副溶血弧菌不会引起AHPND,但均可在TCBS培养基上形成绿色菌落。而携带pirAVP和pirBVP基因的能利用蔗糖的弧菌,如欧文氏弧菌、坎贝氏弧菌等,在TCBS培养基上为黄色菌落却能引起AHPND[23]。因此,诊断AHPND的检测方法应采用能更加准确地检测pirAVP和pirBVP毒力基因的分子生物学方法,如普通PCR、等温环介导扩增、实时荧光定量PCR等。在农业农村部组织的2020年水生动物防疫系统实验室检测能力验证中推荐用于检测致急性肝胰腺坏死病弧菌(VAHPND)的方法即为套式PCR和实时荧光定量PCR法。
目前,常用于水产病原微生物鉴定的方法为生理生化鉴定和分子生物学鉴定方法,由于MALDI-TOF MS设备费用较昂贵,该技术应用在水产病原菌的相关报道仍较少。MALDI-TOF MS技术是近几年兴起的用于微生物(细菌、酵母菌和真菌等)快速鉴定的新技术,其通过测定不同微生物独特的蛋白质组成,应用质谱技术将测定的蛋白质和多肽按分子量大小进行排列,形成蛋白质和多肽指纹图谱,通过不同微生物指纹图谱的特征模式峰进行菌株的鉴定。目前,该技术已经被广泛应用于常见的人和动物病原菌的快速检测鉴定,如沙门氏菌(Salmonellasp.)、肺炎链球菌(Streptococcuspneumoniae)、脑膜炎奈瑟球菌(Neisseriameningitidis)、单增李斯特菌(Listeriamonocytogenes)、脆弱拟杆菌(Bacteroidesfragilis)和阪崎肠杆菌(Bntorobatersakazakii)等[24-25]。相信随着技术的逐渐成熟和成本降低,MALDI-TOF MS技术能够在水产病原微生物鉴定方面发挥更大的作用。
3.3 AHPND的防控措施
本研究分离的副溶血弧菌菌株对甲砜霉素、氟苯尼考等6种药物敏感,而对氨苄西林钠、盐酸土霉素等4种药物耐药,该结果与国内外相关研究药敏分析结果不尽相同[8]。这与分离菌株来源地区的地理特点、用药习惯和养殖技术不同有关,长期大量使用抗菌药物会促使副溶血弧菌产生耐药性。目前,大多数养殖户在凡纳滨对虾养殖过程中均会对养殖水体“菌相”进行调控,盲目使用抗菌药物容易破坏水体“菌相”,且造成耐药致病菌的扩散,因此在对虾养殖过程中抗菌药物的使用更需慎重。
对凡纳滨对虾种虾和虾苗进行病原检测并选择不携带病原的种虾和健康虾苗,是目前对虾AHPND最有效的防控措施之一。郭书林等[26]对福建省9家规模化凡纳滨对虾苗种繁育场进行AHPND检测,在90份患病幼虾样本中检出VPAHPND阳性22份,显示对虾苗种具有较高的病原感染和病害暴发风险。因此,推动对虾苗种产地检疫工作,降低病原跨区域传播风险,对于防控包括AHPND在内的对虾主要传染病具有重大意义。
4 结论
本研究从患病凡纳滨对虾肝胰腺组织中分离到一株携带毒力基因PirvpA和PirvpB的副溶血弧菌,该菌株对甲砜霉素、氟苯尼考等6种药物敏感;对氨苄西林钠、盐酸土霉素等4种药物耐药。该研究为AHPND的流行病学研究和防控技术开发提供了基础资料。

