不同成熟度烟叶采后抗氧化能力和能量代谢研究
牛浩 徐辰生 王胜雷 王廷贤 杨占伟 李静超 宋朝鹏 宋江雨
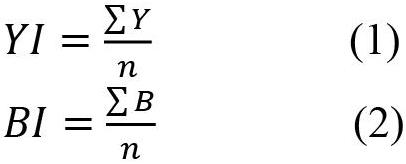


摘 要:为探究抗氧化能力和能量代谢在采后烟叶颜色变化中的作用,准确把握和理解采收成熟度,在自然条件下采用暗箱试验测定了不同成熟度采后烟叶的变黄程度、变褐程度、变黄指数、变褐指数、丙二醛(MDA)含量、浸出液电导率、抗氧化酶(SOD、POD、CAT)活性、能量相关物质(ATP、ADP和AMP)含量、能荷和呼吸代谢酶(CCO和SDH)活性。结果表明,随着采收成熟度的提高,采后烟叶变黄变褐发展更快,在试验期间的抗氧化酶(SOD、POD、CAT)和能量代谢酶(SDH、CCO)高活性时间持续更短。同时,高成熟度采后烟叶在试验中MDA含量和浸出液电导率更较高,且ATP含量高峰出现较早,ATP含量和能荷在试验期间保持高水平的持续时间更短。低成熟度采后烟叶变黄变褐发展更缓慢可能与其较高抗氧化能力和能量代谢有关。
关键词:成熟度;能量代谢;采后生理;膜脂过氧化;抗氧化能力
Abstract: for accurately grasping and understanding harvest maturity and explore the role of antioxidant capacity and energy metabolism in postharvest tobacco leaf discoloration, the harvested tobacco leaves were placed in a dark environment. The changes of yellowing, browning, MDA content, conductivity of leaching solution, adenosine triphosphate (ATP) content, adenosine diphosphate (ADP) content, adenosine triphosphate (AMP) content, energy charge (EG) and activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), succinate dehydrogenase (SDH) and cytochrome oxidase (CCO) of samples were determined during the experiment. With the increase of harvest maturity, the yellowing and browning of postharvest tobacco leaves started earlier and developed faster. During the test, the antioxidant enzymes (SOD, POD, CAT) and energy metabolism enzymes (SDH, CCO) were highly active. At the same time, the high-maturity postharvest tobacco leaves had higher MDA content and leachate conductivity in the experiment, and the ATP content peak appeared earlier, and the ATP content and energy charge remained high during the experiment for a shorter period of time. These results indicated that the slower development of yellowing and browning of tobacco leaves after harvest at low maturity may be related to higher antioxidant capacity and energy metabolism.
Keywords: maturity; energy metabolism; postharvest physiology; membrane lipid peroxidation; antioxidant capacity
采收成熟度是影響烟叶烘烤效果的关键因素。在生产实践中对烟叶成熟度把握不准确是造成烤坏烟现象的重要原因。因此,探讨采收成熟度对采后烟叶颜色变化的影响及其背后的生理机制可为准确理解采收成熟度,提高烟叶烘烤质量提供理论依据和参考。近年来,在园艺作物领域的研究指出果蔬的采后衰老褐变与能量代谢及膜脂过氧化作用关系密切[1-4]。在烟草领域的研究也指出膜脂过氧化作用是影响烘烤特性的关键[5],过早和过高的膜脂过氧化作用都会对烟叶造成不利影响[6]。韩锦峰等[7]研究发现,随成熟度的提高叶内抗氧化酶活性下降,细胞膜通透性变大。王传义等[8]认为成熟度适宜的烟叶烘烤过程中SOD和POD等保护酶活性较高,是其烘烤质量较高的重要原因。以往的研究主要集中在采收成熟度对烟叶烘烤特性及烤后品质的影响上,对于采后烟叶变黄变褐的生理机制知之甚少。基于此,本研究以烤烟品种豫烟13号为研究对象,采用暗箱试验的方式研究了不同成熟度采后烟叶黄化褐变的发展过程。通过测定试验期间烟叶的变黄变褐程度、丙二醛(MDA)含量、浸出液电导率、抗氧化酶活性[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)]、能量相关物质[腺嘌呤核苷三磷酸(ATP)、腺嘌呤核苷二磷酸(ADP)、腺嘌呤核糖核苷(AMP)]含量、能荷以及细胞色素氧化酶(CCO)、琥珀酸脱氢酶(SDH)等呼吸代谢相关酶的活性,探讨不同成熟度采后烟叶颜色变化差异及其生理机制,为准确把握采收成熟度,提高烟叶烘烤质量提供理论依据和参考。
1 材料与方法
1.1 材料
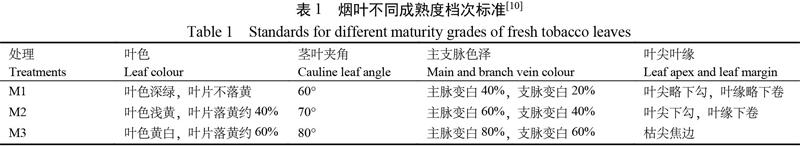
试验于2020年度于河南省洛阳市宜阳县石村(N112°3′25″,E34°30′24″)进行。供试品种为烤烟豫烟13号[9],试验田土壤肥力中等,田间管理均按照当地优质烟叶生产方法进行。选取中部叶(10~13叶位)作为试验材料,按成熟度由低到高设置M1、M2和M3三种成熟度处理(表1),每处理各200片进行暗箱试验。在暗箱试验期间,每隔24 h观察变黄变褐情况;每隔48 h随机选取3片烟叶,去除主脉后混合第6至第7支脉叶肉用于测定生理指标;各项生理指标均重复测定3次。试验当天记为第0天,进行至所有烟叶变褐程度达到三成及以上时结束。
1.2 方法
1.2.1 变黄变褐程度的测定 参考文献[11]的方法,在黑暗密闭环境中进行暗箱试验。每隔24 h观察并记录烟叶的变黄变褐程度直至所有烟叶的褐变程度均达到30%为止。变黄指数从采后第0天观测至试验第7天(共统计8次),变褐指数从采后第4天观测至采后第10天(共统计7次),按照公式(1)和公式(2)分别计算变黄指数(Yellowing Index,YI)和变褐指数(Browning Index,BI)。
其中n为统计次数,Y为各次观察时的烟叶变黄比例,B为各次观察时烟叶的变褐比例。
1.2.2 丙二醛含量及渗出液电导率的测定 参考文献[12]中的方法,采用硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)含量,结果以nmol/g表示。
浸出液电导率的测定参考文献[13]的方法略有修改。取0.1 g烟叶样品,用去离子水冲洗5次后吸干表面水分,放入洁净玻璃试管中加入10 mL蒸馏水浸泡3 h。使用DDS-11A型电导仪测定浸出液的电导率。
1.2.3 抗氧化酶活性的测定 SOD、POD、CAT活性均采用南京建成科技生产的试剂盒进行测定。定义l mL反应体系中NBT(氮蓝四唑)还原抑制百分率达到50%所对应的SOD酶活性为一个SOD活性单位U;定义1 g组织在1 mL反应体系中每分钟470 nm处吸光值变化0.01为一个POD活性单位U;定义1 g组织在1 mL反应体系中每分钟催化1 μmol H2O2降解为一个CAT活性单位U。
1.2.4 ATP、ADP、AMP含量和能荷的测定 采用高效液相色谱法测定ATP、ADP、AMP含量[14]。根据公式(3)计算能荷(EC):
1.2.5 烟草叶片线粒体的提取 使用差速离心法提取烟草叶片线粒体[15-16],有修改。获得的线粒体沉淀用1.5 mL 50 mmol/L Tris-HCl缓冲液(pH 7.5,内含0.3 mol/L甘露醇、1mmol/L EDTA-Na2、质量分数为0.1%的聚乙烯吡咯烷酮)溶解后用于后续指标的测定。
1.2.6 线粒体琥珀酸脱氢酶(SDH)活性测定 参考陈京京等[16]的方法测定,以1 g组织在1 mL反应液中600 nm处吸光值每分钟变化0.1为1个SDH的活性单位U。
1.2.7 线粒体细胞色素C氧化酶(CCO)活性测定 参考KAN等[17]方法测定,以1 g组织在1 mL反应体系中600 nm处吸光值每分钟变化0.1表示1个CCO的活性单位U。
1.3 数据分析
数据采用Excel进行数据整理分析和作图;采用SPSS 17.0进行方差分析和显著性检验。
2 结 果
2.1 不同成熟度采后烟叶黄化褐变的发展
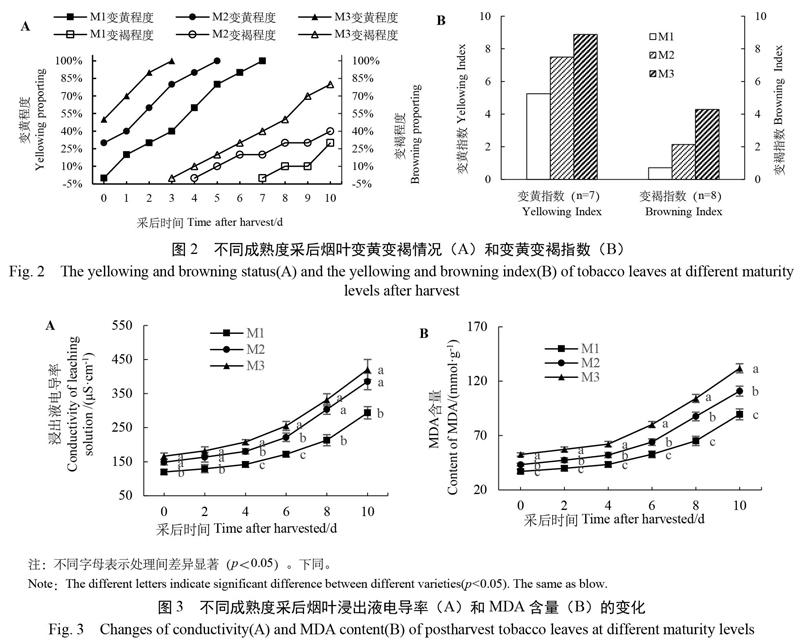
从图1和图2A中可以看出,随着采收成熟度的提高采后烟叶的变黄速度明显提高;M1,M2,M3处理分别在第7天,第5天和第3天达到了十成黄;在变黄指数方面M3处理分别比M2和M1高出18.33%和69.04%(图2B)。由图2A可知,采后烟叶的变褐速度也随着采收成熟度的增加有明显提高;M1,M2,M3处理分别在采后第10天、第8天和第6天達到了3成褐;在变褐指数上,M3处理分别比M2和M1处理高出100.00%和500.00%(图2B)。
2.2 不同成熟度采后烟叶浸出液电导率和MDA含量的变化
如图3A所示,不同成熟度采后烟叶的渗出液电导率随采后时间的延长均呈现上升趋势。在试验期间,M3处理烟叶的渗出液电导率较高,比M2和M3处理分别高出10.65%和45.15%。同时,M3处理烟叶渗出液电导率上升较快。在采后第4~10天,M1处理的采后烟叶与M2、M3处理烟叶浸出液电导率差异达到了显著水平(p<0.05)。由图3B可知,各成熟度处理采后烟叶MDA含量变化与浸出液电导率类似,均呈现上升趋势。M3处理烟叶的MDA含量始终处于较高水平,比M2处理和M1处理分别高出20.53%和48.98%。M3处理烟叶MDA含量增加较快,在整个试验期间M3处理烟叶的MDA含量显著高于M2、M1处理(p<0.05)。
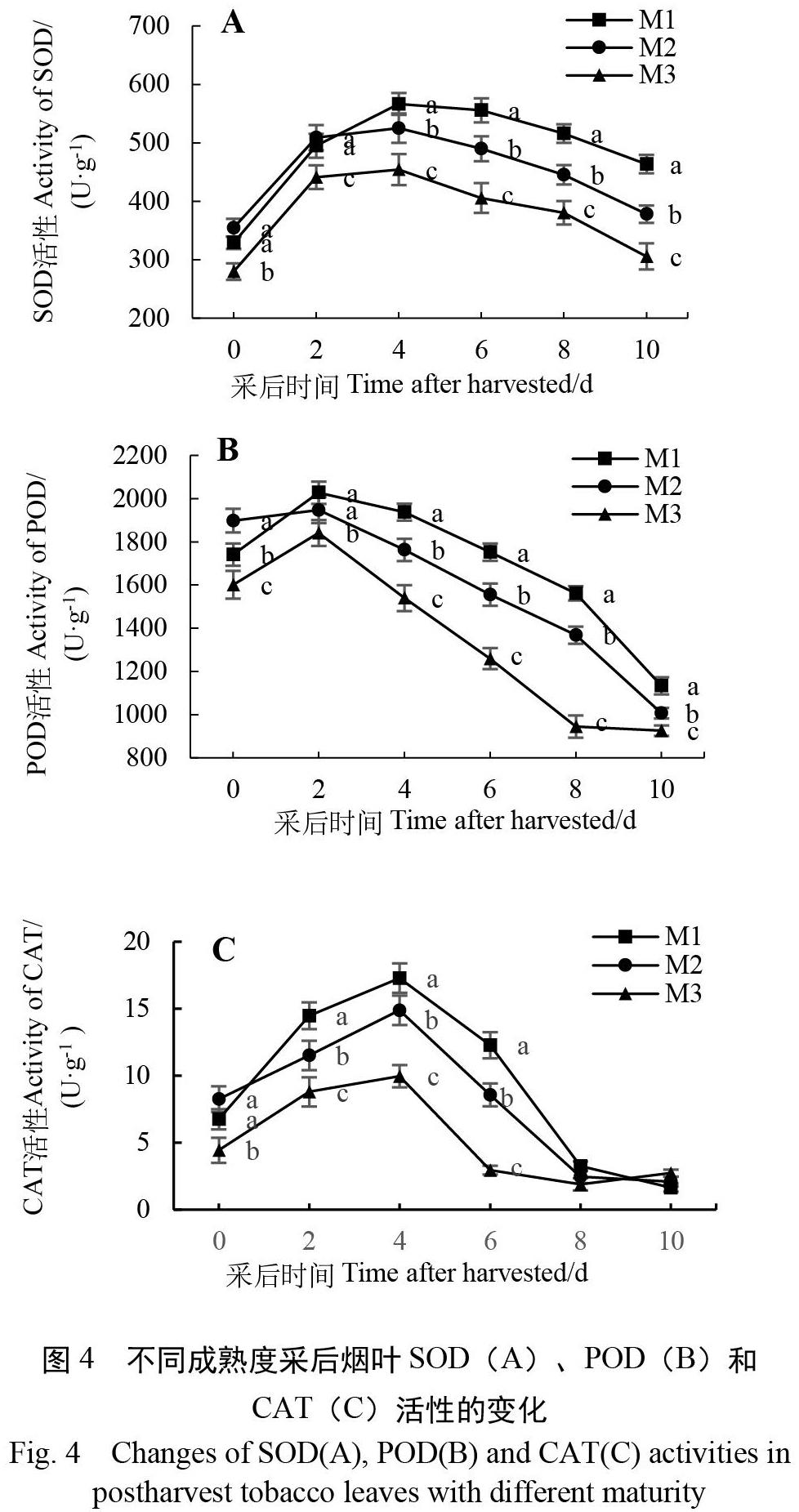
2.3 不同成熟度采后烟叶抗氧化酶活性的变化
如图4所示,各处理烟叶的SOD、POD和CAT活性表现出相似的变化,均在前期迅速升高,而后逐渐下降。随着采收成熟度的提高,烟叶的抗氧化酶活性有所下降。试验期间,M1和M2处理烟叶的SOD活性比M3处理分别高19.18%和29.04%;POD活性分别高17.59%和25.16%;CAT活性分别高55.30%和81.04%。各处理烟叶SOD、CAT活性均在采后第4天达到了高峰(图4A,图4C),POD(图4B)活性则在采后第2天达到了高峰。在采后第4~10天,M1处理烟叶的SOD和POD活性显著高于M2、M3处理(p<0.05)。CAT活性下降较快,在采后第2~6天表现为M1>M2>M3(p<0.05),其余时间各处理差异不明显。
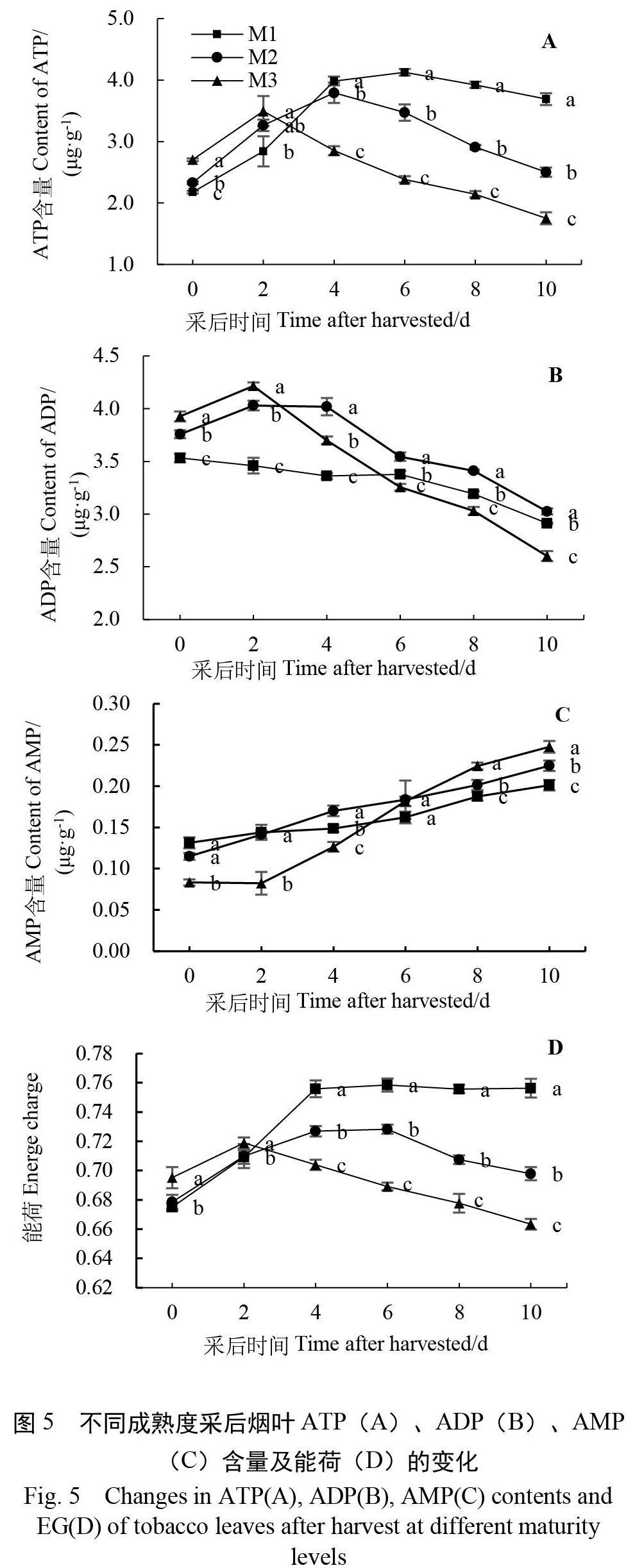
2.4 不同成熟度采后烟叶ATP、ADP、AMP含量及能荷的变化
由图5A可以看出,随着采后时间的延长,各成熟度烟叶的ATP含量均呈现先上升后下降的趋势。在刚采收时,M3处理显著高于M2、M1处理(p<0.05)。随后,各处理烟叶的ATP含量均出现明显升高。M1,M2和M3处理采后烟叶的ATP含量分别在采后第6天、第4天和第2天达到高峰。之后,各处理ATP含量均出现下降,但M2、M3处理下降得更为迅速。在采后第6~10天,M1处理采后烟叶的ATP含量显著高于M2和M3(p<0.05)。各处理采后烟叶ADP含量的变化与ATP类似,均呈现先上升后下降的趋势(图5B)。在刚采收时,M3处理烟叶的ADP含量显著高于M2、M3处理(p<0.05)。随后各处理烟叶的ADP含量开始下降,M3处理下降最为迅速,M2次之,M1处理曲线最为平缓。如图5C所示,随着采后时间的延长,各成熟度采后烟叶的AMP含量总体呈现增加的趋势。在刚采收时,M1、M2处理采后烟叶的AMP含量显著高于M3处理(p<0.05)。随后各处理AMP含量开始缓慢上升,M1、M2处理上升较缓,M3处理上升幅度较大。
由图5D可以看出,随采后时间的延长,各处理采后烟叶的能荷值呈现出先增加后下降的趋势。在刚采收时,M3处理的能荷值显著高于M2、M3(p<0.05)。M3处理采后烟叶的能荷值在采后第2天达到高峰,而M1和M2处理均在第6天达到高峰。与M2和M3相比,M1处理采后烟叶在试验中后期保持着相对较高能荷水平。
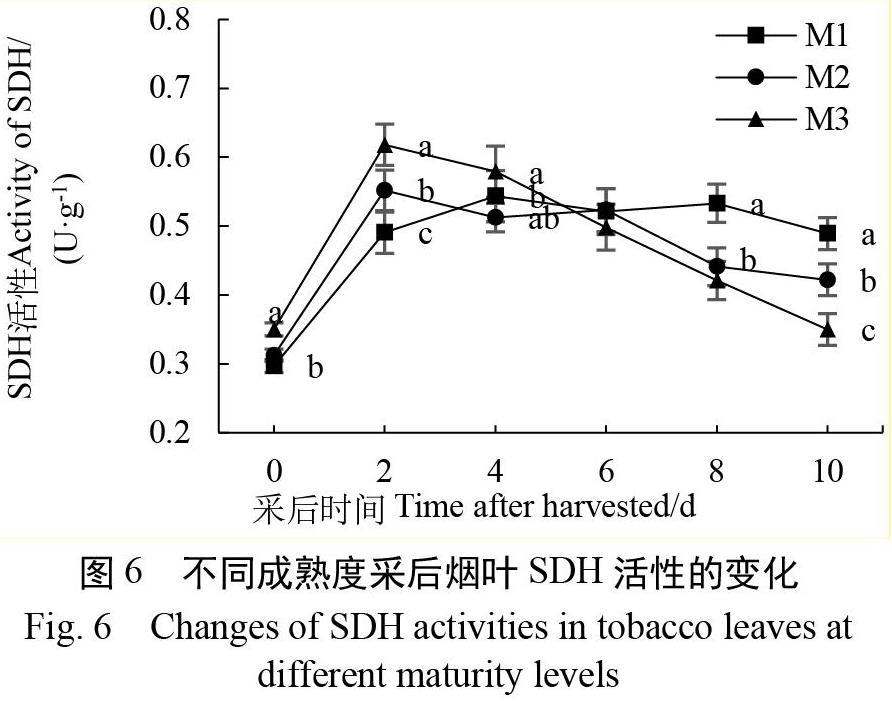
2.5 不同成熟度采后烟叶SDH活性的变化
由图6可以看出,采后烟叶的SDH活性基本呈现出先上升后下降的趋势。在刚采收时,M3处理烟叶的SDH活性最高,M2次之,M1最低。在采后2 d,各处理烟叶的SDH活性明显上升,此时M2,M3处理的烟叶SDH活性比M1分别高出12.41%和26.37%(p<0.05)。之后各处理采后烟叶SDH活性呈现出缓慢下降的趋势,且M2、M3处理下降得更为快速。在采后4~10 d,M1处理采后烟叶SDH活性分别比M2处理和M3处理高出10.18%和12.91%。各处理间烟叶SDH活性分别在采后第2天、第10天差异达到了极显著水平(p<0.01)
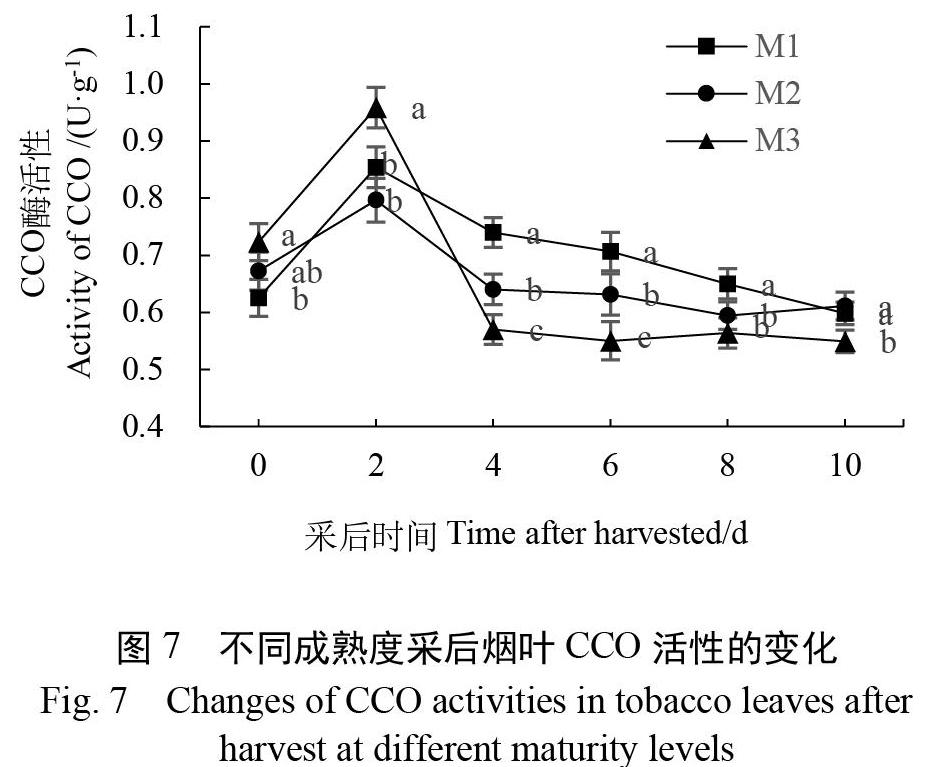
2.6 不同成熟度采后烟叶CCO活性的变化
由图7可以看出,各处理采后烟叶CCO活性均呈现出先上升后下降的趋势。在刚采收时,M3处理采后烟叶的CCO活性最高,M2次之,M1最低。在采后第2天,3个处理烟叶的CCO活性均达到了峰值,此时M3处理烟叶的CCO活性最高,分别比M2和M1高出20.35%和12.22%(p<0.05)。随后各处理CCO活性呈现出下降的趋势,在采后4~10 d表现为M1>M2>M3。各处理间CCO活性分别在采后第2、4、6天差异达到了显著水平(p<0.05)。
3 讨 论
采后烟叶的变黄变褐过程涉及一系列复杂的生理生化机制[18-21]。由于断绝了外界的水分和营养供给,采收后烟叶处于一个多重的逆境环境之中,极易引起活性氧的积累[22]。活性氧的积累可以启动并加速膜脂过氧化链式反应,破坏细胞膜完整性,最终导致烟叶黄化褐变的发生[23]。然而,烟叶可以自然产生抗氧化酶以对抗氧化损伤[24]。在本研究中随着采收成熟度的增加,采后烟叶的SOD、POD和CAT在试验期间的活性有所降低,导致其MDA含量和渗出液电导率较高,加速了烟叶的变黄变褐过程,这与前人的研究结果相一致[25]。
在果蔬储藏领域越来越多的研究指出膜脂过氧化程度的发展与能量代谢密切相关[26],认为能量亏缺是引起果蔬腐烂变质的重要原因[27]。在本研究中,采后烟叶的ATP和ADP含量首先呈现出上升的趋势,可能是因为在采收初期需要更多的能量来应对离体的不利环境[28]。随着逆境的不断加深和烟叶内部呼吸底物的不断减少,新产生的ATP已经不能满足机体对于ATP需求,因而ATP含量和ADP含量开始下降,AMP含量开始上升。与M3处理相比,M1和M2处理能够维持较长时间的高能荷水平,同时抗氧化酶的活性更高,膜脂过氧化发展得更慢,这说明较高的能量水平可能强化了机体抗氧化酶系统。同时随着采收成熟度的提高,ATP高峰出现时间被提前,几乎是同时烟叶也达到了十成黄,提示变黄的发生可能与能量代谢高峰出现有关,其原因可能是较早出现的能量高峰过多地消耗了烟叶中的能源物質[29],导致后续能量的相对缺乏,加速了采后烟叶变黄的过程。在库尔勒香梨中的研究也出现了类似的结果[30]。而ATP含量和能荷水平在褐变发生之前就已经出现了下降,说明ATP含量和能荷水平低于一定的阈值时可能引起褐变的发生;反过来,褐变的发生又促进了ATP含量和能荷水平的下降。这种现象在芒果[31]和番木瓜[32]中也有类似报道。有趣的是,尽管M1、M2处理烟叶ATP和ADP含量在试验末期有所下降,但在试验结束时的能荷水平仍然高于刚采收时,但此时烟叶均已发生褐变,这似乎与果蔬储藏中“能量缺乏引起腐烂”的观点相矛盾。其原因可能是尽管烟叶的能荷水平被提升了,但由于逆境环境所带来的负担(如强化抗氧化酶系统),烟叶组织对于能量的需求提升得更多,这造成了在烟叶组织中能量的相对缺乏,造成了烟叶褐变的发生。
已有研究报道,采后果实储藏过程中腐烂褐变的发生与能量代谢相关酶活性的下降有关[33-34]。琥珀酸脱氢酶(SDH)是参与三羧酸循环的关键酶类,可为真核细胞线粒体和多种原核细胞需氧和产能的呼吸链传递和提供电子,在氧化磷酸化活动中扮演着重要的角色[35]。细胞色素C氧化酶(CCO)是位于线粒体内膜上的末端氧化酶类,其主要功能室将来自于呼吸底物的电子传递给分子态氧,是维持氧化磷酸化作用的关键酶类[36]。在本研究中,各处理采后烟叶的SDH和CCO活性均出现先上升后下降的趋势,与ATP含量的变化相一致。与M1,M2处理相比,M3处理采后烟叶的SDH和CCO活性在刚采收时上升得更高,这表明高成熟度烟叶对于采摘做出的响应更为强烈。但相较于M3处理,M1和M2处理采后烟叶SDH和CCO活性在整个试验期间维持得更高,导致了其高ATP、ADP含量和高能荷水平状态能够维持较长时间,同时褐变发生得也更晚。在果实储藏研究中也报道了施用茉莉酸甲酯提高果实能量代谢酶活性来抑制果实褐变的类似效果[37-38]。究其原因,可能是未熟烟叶中的内含物质积累更丰富[39],为长时间的高能量代谢活动提供了物质保障。
4 结 论
试验结果表明,随着采收成熟度的增加,采后烟叶的变黄变褐过程明显加快。较低成熟度的采后烟叶在试验期间抗氧化酶和能量代谢酶活性较高,膜脂过氧化发展较慢,ATP含量和能荷能够维持较长时间高水平状态,表明采后烟叶的变黄变褐过程与抗氧化能力和能量代谢活动存在着一定的关联。本研究可为准确理解和把握采收成熟度提供理论依据和参考。
参考文献
[1]JIANG Y, JIANG Y, QU H, et al. Energy aspects in ripening and senescence of harvested horticultural crops[J]. Stewart Postharvest Review, 2007, 3(2): 1-5.
[2]LIU H, SONG L, YOU Y, et al. Cold storage duration affects litchi fruit quality, membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology & Technology, 2011, 60(1): 24-30.
[3]刘海. 高氧对香蕉采后呼吸代谢的影响[D]. 广州:华南师范大学,2003.
LIU H. Effects of hyperoxia on postharvest respiration metabolism of bananas[D]. Guangzhou: South China Normal University, 2003.
[4]陈莲,陈梦茵,林河通,等. 解偶联剂DNP处理对采后龙眼果实果皮褐变和活性氧代谢的影响[J]. 中国农业科学,2009,42(11):4019-4026.
CHEN L, CHEN M Y, LIN H T, et al. Effects of uncoupling agent DNP treatment on postharvest longan fruit peel browning and active oxygen metabolism[J]. China Agricultural Sciences, 2009, 42(11): 4019-4026.
[5]宫长荣,李艳梅,李常军. 烘烤过程中烟叶脂氧合酶活性与膜脂过氧化的关系[J]. 中国烟草学报,2000(1):40-42.
GONG C R, LI Y M, LI C J. The relationship between lipoxygenase activity and membrane lipid peroxidation in tobacco leaves during curing[J]. Acta Tobacco Sinica, 2000(1): 40-42.
[6]黃山,杨虹琦,张发明,等. 烘烤温湿度变化对不同烤烟品种烟叶膜脂过氧化作用的影响[J]. 湖南农业大学学报(自然科学版),2009,35(5):485-492.
HUANG S, YANG H G, ZHANG F M, et al. Effects of curing temperature and humidity changes on the membrane lipid peroxidation of different flue-cured tobacco varieties[J]. Journal of Hunan Agricultural University (Natural Science Edition), 2009, 35(5): 485-492.
[7]韩锦峰,汪耀富,林学梧,等. 烤烟叶片成熟度与细胞膜脂过氧化及体内保护酶活性关系的研究[J]. 中国烟草学报,1994(1):20-24.
HAN J F, WANG Y F, LIN X W, et al. Study on the relationship between flue-cured tobacco leaf maturity and cell membrane lipid peroxidation and protective enzyme activities in vivo[J]. Acta Tobacco Sinica, 1994(1): 20-24.
[8]王传义,孙福山,王廷晓,等. 不同成熟度烟叶烘烤过程中生理生化变化研究[J]. 中国烟草科学,2009,30(3):49-53.
WANG C Y, SUN F S, WANG T X, et al. Study on the physiological and biochemical changes of tobacco leaves with different maturity during the curing process[J]. China Tobacco Science, 2009, 30(3): 49-53.
[9]李雪君,孙计平,丁燕芳,等. 烤烟新品种豫烟13号的选育及特征特性[J]. 中国烟草科学,2017,38(4):17-22.
LI X J, SUN J P, DING Y F, et al. Breeding and characteristics of a new flue-cured tobacco variety "Yuyan 13[J]. China Tobacco Science, 2017, 38(4): 17-22.
[10]陈颐,郑竹山,王建兵,等. 不同成熟度烤烟烘烤过程中游离氨基酸及转氨酶活性变化[J]. 中国烟草科学,2019,40(3):75-83.
CHEN Y, ZHENG Z S, WANG J B, et al. Changes in free amino acids and transaminase activities of flue-cured tobacco with different maturity levels during curing[J]. China Tobacco Science, 2019, 40(3): 75-83.
[11]国家烟草专卖局. 烤烟品种烘烤特性评价:YC/T 311—2009 [S].
State Tobacco Monopoly Administration. Evaluation of curing characteristics of flue-cured tobacco varieties: YC/T 311—2009 [S].
[12]肖家欣,刘志文,罗充,等. 植物生理学实验[M]:合肥:安徽人民出版社,2010.
XIAO J X, LIU Z W, LUO C, et al. Plant Physiology Experiment[M]: Hefei: Anhui Renmin Press, 2010.
[13]YANG Q, ZHANG X, WANG F, et al. Effect of pressurized argon combined with controlled atmosphere on the postharvest quality and browning of sweet cherries[J]. Postharvest Biology and Technology, 2019, 147: 59-67.
[14]LIU H, JIANG Y, LUO Y, et al. A simple and rapid determination of ATP, ADP and AMP concentrations in pericarp tissue of litchi fruit by high performance liquid chromatography[J]. Food Technology and Biotechnology, 2006, 44(4): 531-534.
[15]IKUMA H, WALTER D. BONNER. Properties of higher plant mitochondria. I. Isolation and some characteristics of tightly-coupled mitochondria from dark-grown mung bean hypocotyls[J]. Plant Physiology, 1967, 42(1): 67-75.
[16]陈京京,金鹏,李会会,等. 低温贮藏对桃果实冷害和能量水平的影響[J]. 农业工程学报,2012,28(4):275-281.
CHEN J J, JIN P, LI H H, et al. Effects of low temperature storage on chilling injury and energy levels of peach fruits[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(4): 275-281.
[17]KAN J, WANG H M, JIN C, et al. Changes of reactive oxygen species and related enzymes in mitochondrial respiration during storage of harvested peach fruits[J]. Agricultural Sciences in China, 2011, 10(1): 149-158.
[18]王传义,张忠锋,徐秀红,等. 烟叶烘烤特性研究进展[J]. 中国烟草科学,2009,30(1):38-41.
WANG C Y, ZHANG Z F, XU X H, et al. Research progress on curing characteristics of tobacco leaves[J]. China Tobacco Science, 2009, 30(1): 38-41.
[19]张玉琴,李青山,王传义,等. 烤烟烟叶成熟过程中的颜色参数与烘烤特性研究[J]. 西南农业学报,2018,31(1):62-67.
ZHANG Y Q, LI Q S, WANG C Y, et al. Study on color parameters and curing characteristics of flue-cured tobacco leaves during maturation[J]. Journal of Southwest Agriculture, 2018, 31(1): 62-67.
[20]戴勋,王毅,刘彦中,等. 不同施氮量下云烟85不同成熟度烟叶的烘烤特性[J]. 湖北农业科学,2007,391(4):552-555.
DAI X, WANG Y, LIU Y Z, et al. The curing characteristics of Yunyan 85 tobacco leaves with different maturity levels under different nitrogen application rates[J]. Hubei Agricultural Sciences, 2007, 391(4): 552-555.
[21]武圣江,莫靜静,娄元菲,等. 不同烤烟品种不同成熟度上部叶烘烤特性研究[J]. 核农学报,2020,34(6):1337-1349.
WU S J, MO J J, LOU Y F, et al. Study on curing characteristics of upper leaves of different flue-cured tobacco varieties with different maturity[J]. Journal of Nuclear Agriculture, 2020, 34(6): 1337-1349.
[22]王娟,李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J]. 植物学通报,2001(4):459-465.
WANG J, LI D Q. Accumulation of osmotic adjustment substances and active oxygen metabolism in plants under adversity conditions[J]. Bulletin of Botany, 2001(4): 459-465.
[23]肖茜,冯超,刘保华,等. 荔枝果皮褐变过程中膜脂过氧化及相关酶活性变化的比较研究[J]. 热带作物学报,2011,32(9):1653-1657.
XIAO Q, FENG C, LIU B, et al. Study on the changes of membrane lipid peroxidation and related enzyme activities during the browning process of litchi pericarp [J]. Journal of Tropical Crops, 2011, 32(9): 1653-1657.
[24]赵松超,李一凡,刘博远,等. 晾制密度对雪茄烟叶膜脂过氧化作用及品质的影响[J]. 作物学报,2019,45(7):1090-1098.
ZHAO S C, LI Y F, LIU B Y, et al. Effects of drying density on membrane lipid peroxidation and quality of cigar tobacco leaves[J]. Acta Agronomica Sinica, 2019, 45(7): 1090-1098.
[25]柳强. 红花大金元不同烟叶成熟度主要生化指标变化规律研究[D]. 贵阳:贵州大学,2010.
LIU Q. Study on the change law of main biochemical indexes of different tobacco leaf maturity in “Honghuadayinyuan”[D], Guiyang: Guizhou University, 2010.
[26]WANG F, YANG Q, ZHAO Q, et al. Roles of antioxidant capacity and energy metabolism in the maturity-dependent chilling tolerance of postharvest kiwifruit[J]. Postharvest Biology and Technology, 2020, 168: 111281.
[27]YI C, QU HX, JIANG Y, et al. ATP-induced changes in energy status and membrane integrity of harvested litchi fruit and its relation to pathogen resistance[J]. Journal of Phytopathology, 2008, 156(6): 365-371.
[28]徐云岭,余叔文,植物适应盐逆境过程中的能量消耗[J]. 植物生理学通讯,1990(6):70-73.
XU Y L, YU S W. Energy consumption in the process of plants adapting to salt stress[J]. Bulletin of Plant Physiology, 1990(6): 70-73.
[29]赵云罡,徐建兴. 线粒体,活性氧和细胞凋亡[J]. 生物化学与生物物理进展,2001(2):168-171.
ZHAO Y G, XU J X. Mitochondria, reactive oxygen species and apoptosis[J]. Progress in Biochemistry and Biophysics, 2001(2): 168-171.
[30]潘俨. 库尔勒香梨果实发育及采后糖代谢与呼吸代谢关系的研究[D]. 乌鲁木齐:新疆农业大学,2016.
PAN Y. The relationship between sugar metabolism and respiratory metabolism throughout fruit development and postharvest of Korla fragrant pear (Pyrus sinkiangensis Yu)[D]. Urumqi: Xinjiang Agricultural University, 2016.
[31]ZHAO Z, CAO J, JIANG W, et al. Maturity-related chilling tolerance in mango fruit and the antioxidant capacity involved[J]. Journal of the Science of Food & Agriculture, 2010, 89(2): 304-309.
[32]PAN Y G, YUAN M Q, ZHANG W M, et al. Effect of low temperatures on chilling injury in relation to energy status in papaya fruit during storage[J]. Postharvest Biology and Technology, 2017, 125: 181-187.
[33]PENG J, HONG Z, LEI W, et al. Oxalic acid alleviates chilling injury in peach fruit by regulating energy metabolism and fatty acid contents[J]. Food Chemistry, 2014, 161: 87-93.
[34]CHENG S, WEI B, ZHOU Q, et al. 1-methylcyclopropene alleviates chilling injury by regulating energy metabolism and fatty acid content in 'nanguo' pears[J]. Postharvest Biology & Technology, 2015, 109: 130-136.
[35]孙聪,白杨,李连国,等. 草莓果实线粒体呼吸代谢与超微弱发光的关系[J]. 西北植物学报,2019,39(10):1805-1811.
SUN C, BAI Y, LI L G, et al. The relationship between mitochondrial respiration metabolism and ultra-weak luminescence in strawberry fruit[J]. Journal of Northwest Botany, 2019, 39(10): 1805-1811
[36]林安贵,杨灵灵. 植物提取物槲皮素调节小鼠的能量代谢和氧化应激[J]. 基因组学与应用生物学,2020,39(1):320-325.
LIN A G, YANG L L. Plant extract quercetin regulates energy metabolism and oxidative stress in mice[J]. Genomics and Applied Biology, 2020, 39(1): 320-325.
[37]JIN P, ZHU H, WANG J, et al. Effect of methyl jasmonate on energy metabolism in peach fruit during chilling stress[J]. Journal of the Science of Food and Agriculture, 2013, 93(8): 1827-1832.
[38]LI C, CHENG Y, HOU J, et al. Application of methyl jasmonate postharvest maintains the quality of Nanguo pears by regulating mitochondrial energy metabolism[J]. Journal of Integrative Agriculture, 2021, 120(11): 3075-3083.
[39]邓云龙,崔国民,孔光辉,等. 品种、部位和成熟度對烟叶淀粉含量及评吸质量的影响[J]. 中国烟草科学,2006(4):18-23.
DENG Y, CUI G M, KONG G H, et al. Effects of variety, location and maturity on starch content and smoking quality of tobacco leaves[J]. China Tobacco Science, 2006(4): 18-23

