房间隔造口术联合体外膜肺治疗急性呼吸窘迫综合征合并左心功能不全的大动物实验研究
刁力为 李温斌 师启众 张保全 樊宏哲 刘 诫 李阳阳 杨英杰 吴本清吴一彬
2019 新型冠状病毒(novel coronavirus,2019-nCoV)引起的新型冠状病毒肺炎(2019 novel coronavirus,COVID-19)在短短几个月内肆虐全球,轻型及普通型患者可以通过对症治疗自愈,重症及危重症患者需要呼吸机甚至体外肺膜(extracorporeal membrane oxygenation,ECMO)支持,但重症患者死亡率仍高达61.5%[1],死亡的主要原因是急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)基础上合并肺部感染和循环衰竭。 因此,提高ARDS的抢救成功率是降低COVID-19 患者以及各种非心源性原因引起的ARDS 患者病死率的关键。 VAECMO 是抢救左心功能衰竭患者的有效手段之一,但是ARDS 合并左心功能衰竭患者同时合并严重的低氧血症,常规VA-ECMO 无法缓解上半身尤其冠状动脉乏氧的问题,VAV-ECMO 又难以控制各个管路的流量,同时左心减压的问题也得不到很好的解决,是VA-ECMO 治疗ARDS 合并循环衰竭患者的主要死亡原因[2]。 房间隔造口术通过在房间隔卵圆孔位置人造一个房间隔缺损,形成了一个左心到右心的通道,相当于心脏术后常规应用的左心引流,是促进心脏复跳、改善左心功能的有效手段,也有用于VA-ECMO 支持等待心脏移植患者的成功报道[3],然而尚未见到这种方法治疗ARDS 合并左心衰竭患者的临床或者实验研究。 我们分析房间隔造口加VA-ECMO 能够通过左向右分流,达到:①减压左心(左心引流的另外一种形式,避免了开胸左心引流导致的出血、感染等并发症),使其充分得到休息;②改善肺循环、减轻肺水肿,增加氧供尤其冠状动脉及脑部的氧供;③实时、动态调节左、右心房压力,平衡体肺循环血流量,从而提高ARDS 合并左心衰竭甚至全心衰竭患者的抢救成功率,因此设计本研究,用于检验VA-ECMO 加房间隔造口术对ARDS合并左心功能不全患者的疗效。
材料与方法
1.实验动物 通过中国科学院大学深圳医院动物伦理委员会审查后,取健康成年绵羊5 只,为大动物实验动物,雄性,体质量(55±3.2)kg。 在领先动物实验中心(深圳)完成实验,该中心具有大动物实验资质。
2.实验方法 (1)建立急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)动物模型:应用脂多糖(lipopolysacchatide,LPS)静脉泵入全麻插管状态下的绵羊,制作急性肺损伤(acute lung injury,ALI)性急性肺水肿或ARDS 模型。 该方法制作的肺损伤动物模型已得到国际公认[4]。 LPS 用量为3 μg/kg,1 h 左右即可产生严重的肺损伤,3 h 达到ARDS 标准:PaO2/FiO2<300。 LPS 制作的绵羊ARDS 模型非常稳定,是研究重症感染导致的ARDS最理想的动物模型。 由于无法应用2019-nCoV 建立动物模型,因此该模型是最接近2019-nCoV 感染导致的ARDS 的大动物模型。
(2)左心功能不全动物模型的建立:在ARDS模型建立后,在明显的低氧血症状态下,右侧开胸,经上下腔静脉和升主动脉插管建立体循环,经右上肺静脉置入左心房测压管,体外循环开始前,诱导心室颤动,依赖低氧血症造成心肌损伤!
(3)ASD 的制作方法:心室颤动20 min 后开始体外循环,切开右心房,在房间隔卵圆窝处切除部分膜状间隔组织,大小约1.5CM,在新建的ASD 边缘上应用2/0 滑线褥式缝合一针,用于开闭ASD 使用,以便对比分析房间隔开放前后各项指标的变化,判断ASD 在应用体外循环模拟VA-ECMO 的情况下对机体心肺循环的影响。 之后,缝合右心房切口,完成手术。
(4)观察指标:①动物血液动力学一般指标;②动脉血气指标及混合静脉血气指标;③漂浮导管和PICCO 监测体肺循环血流动力学指标和肺水变化情况;④食道和心外膜UCG
3.统计学方法 选用SPSS 19 软件处理数据。计量资料采用均数±标准差表示,采用t 检验。 计数资料以频数(率)表示。 以P<0.05 为差异有统计学意义。
结 果
在体外循环开始前,实验动物羊在呼吸机100%氧浓度模式下,外周动脉血气显示PaO2:(198.3±37.2)mmHg(1 mmHg =0.133 kPa),SaO2:(93.1±1.3)%,PaO2/FiO2:(198.3±37.2),HR:(87±17)次/min,MAP:(61.5±13.2)mmHg。 体外循下完成的房间隔造口(ASD)直径为(术中测量):(11.3±2.2)mm; ASD 手术完成后,心脏除颤复跳,在关闭ASD 情况下并行循环30 min,见心脏跳动无力,处于蠕动状态,说明心肌严重受损,难以停机,血流动力学参数、血气指标等均显示ARDS 及左心功能不全动物模型建立成功。 开始继续体外循环辅助模拟VA-ECMO,上下腔的血液经重力引流到人工膜肺氧合后被ECMO 经头臂干的动脉插管射入头臂干动脉,经此动脉进入主动脉弓部,如此可以模拟VA-ECMO。 30 min 后心脏仍收缩乏力,不能停用体外循环,之后打开ASD,继续模拟VA-ECMO 支持心脏工作,15 min 后心肌收缩增强、循环稳定,心脏功能明显改善,顺利停机。 之后保留上下腔静脉管和头臂干动脉插管,继续模似VA-ECMO 工作,在各项实验条件不变的情况下,仅开放和关闭ASD 对比观察房水平分流方向及血液动力学指标(体外循环及ECMO 过程中由于PICCO 数值受到影响因此不再采集PICCO 的相关参数),以及血气检查,结果如下:应用食道和心外膜UCG 的全程监测,在闭合ASD 的情况下,未见房水平分流(图1),仅应用VAECMO 辅助下可见动物在吸入40%氧的情况下,HR:(108±17)次/min,MAP:(49.3±13.5)mmHg,PAP:(28.9±12.7)mmHg,PVRI:(45.2±9.2)N·S·M-2·L-1,CO:(2.4±1.4),外周动脉PaO2为(141.2±21.4)mmHg,SaO2:(96.1±1.3)%,PaO2/FiO2:(353.0±53.5),心脏饱胀,运动幅度较小,显得无力;在其他实验条件不变的情况下,仅打开ASD 后房水平出现左向右分流,MAP:(68.2±16.1)mmHg,PAP:(18.1±7.8)mmHg,PVRI:(33.4±7.2)N·S·M-2·L-1,CO:(3.1±1.3)L/min,外周动脉PaO2明显上升至(169.3±18.9)mmHg,SaO2:(98.2±1.1)%,,PaO2/FiO2:(423.3±47.3),HR:(98±18)次/分,心脏运动幅度明显加大,心脏跳动显得轻松,体循环状态明显好转。 与ASD 关闭时比较,在ASD开放后MAP, PaO2, SaO2, PaO2/FiO2明显上升;PAP,PVRI 明显下降,二者间差异有统计学意义(P<0.01)。 CO 变化不大(P>0.05)。 其他更多指标的变化详见表1~3。
表1 ASD 开及闭前后血流动力学一般参数变化
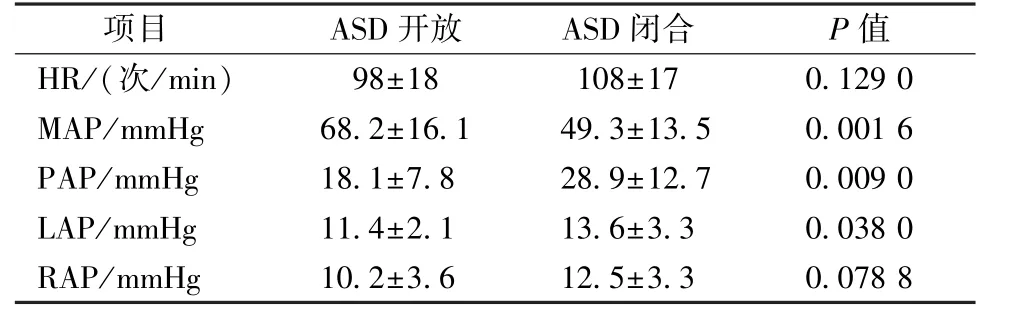
表1 ASD 开及闭前后血流动力学一般参数变化
项目 ASD 开放 ASD 闭合 P 值HR/(次/min) 98±18 108±17 0.129 0 MAP/mmHg 68.2±16.1 49.3±13.5 0.001 6 PAP/mmHg 18.1±7.8 28.9±12.7 0.009 0 LAP/mmHg 11.4±2.1 13.6±3.3 0.038 0 RAP/mmHg 10.2±3.6 12.5±3.3 0.078 8
表2 ASD 开及闭前后血流动力学参数变化

表2 ASD 开及闭前后血流动力学参数变化
注: PAWP:肺动脉楔压;SVRI:体循环阻力指数;PVRI:肺血管阻力指数;ELWI:血管外肺水指数
项目 ASD 开放 ASD 闭合 P 值CO/(L/min) 3.1±1.3 2.4±1.4 0.166 9 PAWP /mmHg 11.8±2.1 13.5±3.2 0.096 4 SVRI/(N·s·m-2·L-1) 270.1±113.6 268.3±107.9 0.964 8 PVRI /(N·s·m-2·L-1) 33.4±7.2 45.2±9.2 0.000 5 ELWI/(mL/kg) 16.6±6.2 18.2±6.1 0.482 1
表3 ASD 开及闭前后肺气体交换和氧代谢指标参数变化

表3 ASD 开及闭前后肺气体交换和氧代谢指标参数变化
注: DO2:氧输送,VO2:氧耗,O2ext:氧摄取率
项目 ASD 开放 ASD 闭合 P 值PaO2/mmHg 169.3±18.9 141.2±21.4 0.000 7 PaCO2/mmHg 38.2±4.2 40.1±3.4 0.184 1 SaO2/% 98.2±1.1 96.1±1.3 0.000 1 PaO2/FiO2 423.3±47.3 353.0±53.5 0.000 7 DO2/(mL·min-1·m-2) 411.2±166.8 398.5±108.3 0.786 4 VO2/(mL·min-1·m-2) 47.1±30.1 48.6±30.5 0.971 0 O2ext/% 13.1±4.6 12.9±4.4 0.698 7
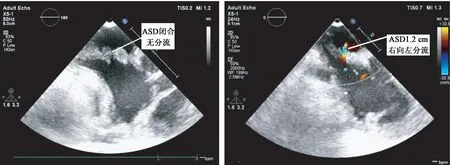
图1 ASD 闭合状态下,无房水平分流;图2 ASD 开放后出现左向右分流,缺损1.3 cm
讨 论
LPS 是革兰氏阴性菌内毒素的主要成分,静脉或吸入该药物均可制作出急性ARDS 的动物模型,是目前常用的动物模型[5]。 ARDS 动物模型对研究类似于COVID-19 的肺损伤的发病机制、病理生理改变、诊断和治疗等方面具有重要意义。 COVID-19引起的肺损伤的病理改变主要为肺间质和肺泡损伤后出现肺水肿、肺泡水肿,严重者可以发展为肺泡透明膜形成,出现为ARDS 的病理和临床表现。 患者因严重通气/血流比例失调、肺内分流和弥散障碍,造成顽固性低氧血症和呼吸窘迫。 为缓解低氧血症,氧疗是必需的措施,但危重症患者,呼吸机给氧都难以纠正低氧血症! 我们在该实验中应用LPS静脉泵入的方法成功地制作出了ARDS 的动物模型,并进行了体外循环实验。 从病理和病理生理方面分析,该模型的病理改变可以模拟COVID-19 的肺部及全身病变,与吸入LPS 所致的动物模型相比,能够更很好地模拟COVID-19 病理和病理生理改变。
对于ARDS 合并LVF 患者,VA-ECMO 不失为一种有效改善氧合的治疗方案,但临床资料显示目前安装ECMO 患者死亡率很高,目前尚没有文献报道的详细数据,并且在终末期大部分患者会出现左心脏功能不全,对于这类危重症患者安装VA-ECMO或VAV-ECMO 治疗,但状态并不乐观,甚至加重,逐渐发生多脏器衰竭(MODS)致死! 我们分析原因认为是VA-ECMO 工作模式下,氧合的静脉血不能到达主动脉根部,心脑的供血还是从肺循环过来的低氧血液,所以,患者的症状难以缓解,甚至加重! 为解决该问题,可以应用VAV-ECMO 模式,但向动脉和静脉分流量难以控制,也不能很好地解决心脏供血问题,对心肺功能的支持有限,临床很少使用。 针对以上分析,我们在VA-ECMO 基础上设计了一种房间隔开孔术,就像心脏术后常规应用左心引流以改善左心功能一样,ASD 的存在可以允许左心房血液分流入右心房经ECMO 进入主动脉,同时还能明显减轻左心室前负荷,保证左心室处于低负荷状态,甚至是空跳,主动脉瓣不开放,经ECMO 氧合的血液也可以到达主动脉根部,同时左心房压力下降、肺水肿减轻,肺循环得到改善,保证心脑的氧供,从而改善心脏功能和全身脏器和组织的血供[6]。 本实验结果证实了我们分析内容是正确的。
房间隔穿刺打孔术是心脏介入科的常规技术,可以在X-线和/或血管内或食道或体表UCG 的辅助下安全实施[7]! 1 ~2 cm 大小的人造房间隔缺损不会对患者后期的心脏功能产生影响[8],因此多数情况下,这些患者恢复后无需再行房间隔闭合手术,如果在后期的随访过程中发现患者有因为房间隔缺损导致的体肺分流过多、右心负荷过重、肺动脉压力增高,也可以择期行经皮房间隔缺损封堵手术[9]。
本实验的局限性:虽然LPS 静脉泵入的全麻状态的绵羊是目前重症感染所致ARDS 的最佳模型,但是其病理生理变化可能还是与2019-nCoV 导致的危重症患者有一定的不同之处; 另外,本实验中应用体外循环虽不能完全等同于ECMO,但二者工作原理相同。 ECMO 是在体外循环的基础上发展而来的,二者的主要是区别是前者是开放性的,而后者是闭合性的,该方面的区别主要影响长期使用效果,对这次急性动物实验结果不会造成影响;还有静脉回流的方式不同,ECMO 是主动抽吸式,体外循环是依靠重力引流式,虽然回流方式不同,但二者均为负压吸引作用以达到充分静脉引流的效果并都能很好地控制静脉回流量,其效果相当;关于主动脉插管的位置,本实验中采用头臂干动脉插主动脉灌注管的方法,其效果等同于ECMO 中的锁骨下动脉插管法。综合分析,在动物实验中应用体外循环模拟ECMO是合理可行的,这些方面的差异均对实验结果影响不大,因此,ASD 合并VA-ECMO 治疗ARDS 合并左心功能不全动物模型所得到的实验结果对COVID-19 引起的ARDS 合并左心功能不全患者的治疗有较好的借鉴作用,但需要进一步的临床验证。
——体外循环质量控制的基石

