牙龈卟啉单胞菌致病岛Rag 基因对青少年牙龈炎影响的研究
张玉杰,柏祥娥,肖水清,杨世茂(通讯作者)
(1.济南市口腔医院,山东 济南;2.山东医学高等专科学校,山东 济南)
0 引言
牙龈卟啉单胞菌(Porphyromonas gingivalis,P.gingivalis)是牙周炎,尤其是慢性牙周炎病变区或活动部位最主要的优势菌[1],含有多种毒力因子,具有显著的毒力和致病性。细菌的致病性是某一个或几个致病因子发挥决定作用的结果。致病岛(Pathogen icity island)的发现和研究对了解细菌致病性具有重要的意义[2],目前,Rag 位点被确定为P.gingivalis 致病岛基因之一,该位点主要含有RagA、RagB,分别编码RagA和RagB 蛋白。rag 蛋白构成膜转运系统,协助细菌从外部环境获取转运大分子,有助于细菌的存活和散播;同时Rag 蛋白还能够激活宿主的免疫及炎症反应[3]。研究表明,Rag 位点在临床菌株中有4 种不同的基因型[4-5],分别命名为Rag-1、Rag-2、Rag-3 和Rag-4,不同rag 基因型P.gingivalis 致病能力亦不同。本研究采用多重PCR 技术检测不同Rag 基因型P.gingivalis 在青少年牙龈炎患者中的分布,探讨致病岛Rag基因对青少年牙龈炎发生发展的影响。
1 资料与方法
1.1 材料
P.gingivalis ATCC33277 菌株、具核梭杆菌F.nucleatum ATCC25586 菌株和伴放线放线杆菌A.actinomycetemcomitans ATCC29522 菌株购于四川大学华西医学中心;牛心脑浸液(brain heart infusion,BHI)血琼脂培养基购于青岛日水生物技术有限公司;DNA 提取试剂盒购于北京天根生化科技有限公司。
1.2 临床资料
选择济南市口腔医院牙周科就诊的青少年牙龈炎初诊患者89 例,其中男47 例,女38 例,年龄12~16 岁,平均年龄14.3 岁;选择42 例牙周健康者组成对照组,男19 例,女23 例,年龄12-16 岁,平均14.6 岁;均为山东地区常住居民。要求患者无全身系统性疾病,3 个月内未接受过系统的牙周治疗,未曾服用抗生素和引起牙龈增生的药物。且知情同意。
1.3 实验方法
1.3.1 临床指标的测定
牙龈指数(Gingivitis index, GI)[6]
按照LOe 和Silness1967 年修定的标准,吹干牙龈,观察牙龈色、形、质的改变程度,用牙周探针放入龈缘下0.5-1mm,并轻轻滑动后观察有无出血。将每个牙的牙龈分为4 个区域:颊侧近中龈乳头,颊侧边缘龈,颊侧远中龈乳头及舌侧边缘龈,分别记录以上四个区域的炎症情况,将每个牙的4 个记分相加除以4,即为该牙的分值。
分级标准为:
0=牙龈正常
1=牙龈轻度炎症,轻度颜色改变、轻度水肿、探针不出血;
2=牙龈中度炎症,颜色发红,水肿光亮、探诊出血;
3=牙龈重度炎症;明显发红和水肿、或有溃疡、有自发出血倾向。
1.3.2 标本采集
由同一位医师对患者进行临床检查和标本收集,牙周检查指标包括牙龈指数(Gingivitis index, GI)、龈沟出血指数(sulus bleeding index,SBI)、菌斑指数(plaque index,PLI)和探针深度(probing depth,PD)。采用无菌纸尖法采集患者龈沟液,具体采集方法如下:常规清水漱口,生理盐水冲洗,去除食物残渣,棉球隔湿,吹干,将无菌纸尖插入龈沟内,当有阻力时停止插入,停留30s 后取出,放入1mL PBS 的EP 管内,-20℃保存待测[7]。
1.3.3 标准菌株及龈沟液DNA 提取
(1)标准菌株DNA 提取:采用DNA 提取试剂盒提取标准菌株DNA。用紫外分光光度计测量所提取DNA 在260 nm 和280 nm 处的吸光度值(OD 值),计算二者比值(比值为1.7~2.0 表示DNA 纯度良好)。将各种细菌DNA 稀释至相同浓度,用于PCR 反应。
(2)龈沟液DNA 提取:将标本离心(12000 r/min,2min,最大离心半径为6cm),弃上清,于沉淀中加入Triton 抽提液,100℃水浴10min,再离心(12000 r/min,2min),取上清作为模板,于-20℃保存[8]。
1.3.4 P.gingivalis 和4 种rag 基因型引物设计及合成
参考文献[4,9]设计P.gingivalis16S rDNA 和4 种rag 基因型特异性引物序列(表1),引物均由上海博尚生物技术有限公司合成。

表1 P.gingivalis16S rDNA 和4 种rag 基因型的引物序列
1.3.5 PCR 扩增16S rDNA PCR 反应体系
采 用2×EasyTaq PCR SuperMix PCR 试剂盒(北京全式金生物技术有限公司),PCR 混合液12.5μL,引物各1.0μL(10uM),模板DNA:标准株1.0μL(100ng/μL),临床标本5.0uL,用无菌双蒸水补充至总体积25μL。多重PCR 反应体系:采用TransStart Taq DNA PolymerasePCR 试剂盒(北京全式金生物技术有限公司),10 倍反应缓冲液2.5μL,引物2.0μL(将未经稀释的4 对rag 基因引物的原始液混合后按1 对引物稀释的量进行稀释,稀释后的引物作为应用液,计作引物A),TaqDNA 聚合酶0.5μL,dNTPs0.5μL,模板DNA5.0μL,用无菌双蒸水补充至总体积25μL。PCR 循环条件:94℃预变性5min,94℃变性30s,退火30s(16SrDNAPCR为57℃,多重PCR 为55℃),72℃延伸1min(33 个循环);最后72℃延伸10min;4℃保存。
1.3.6 16S rDNA PCR 及多重PCR 对临床标本的检测
以16S rDNA 为引物,以临床标本DNA 为模板,用于临床标本检测,确定P.gingivalis 阳性患者;以P.gingivalis 阳性患者DNA 为模板,以引物A 为引物进行多重PCR 扩增,确定致病岛rag 基因的分布情况。
1.3.7 PCR 扩增产物检测取扩增产物,用TAE 电泳缓冲液,1.5%琼脂糖凝胶电泳[含0.5mg/L 溴化乙锭(EB)],泳动90V 20min。用Ladder DNA Marker(100 bp)确定产物的相对分子质量,以凝胶成像系统进行成像分析。
1.4 统计学分析
用χ2检验比较组间P.gingivalis 及致病岛rag 基因检出率的差异;Spearman 等级相关分析P.gingivalis 及致病岛rag基因检出率与牙龈指数GI 之间的关系:采用SPSS 13.0 统计软件包分析处理,P<0.05 具有统计学意义。
2 结果
2.1 PCR 产物的电泳结果
2.1.1 P.gingivalis16S rDNA PCR 产物的电泳结果
阳性对照a 和临床标本c ~ e,g~i,k~l 均扩增出404 bp目的条带,空白对照b 和临床标本f,j 及阴性对照m,n 未见目的条带。见图1。
2.1.2 多重PCR 产物的电泳结果
标准菌株b 和临床标本e,i 均扩增出628bp(rag-1)目的条带,临床标本h 扩增出979bp(rag-2)目的条带,临床标本c,d,f,g,j 扩增出423bp(rag-3)目的条带, 标准菌株a 和临床标本f,j,l 均扩增出739bp(rag-4)目的条带,临床标本k未见目的条带。见图2。
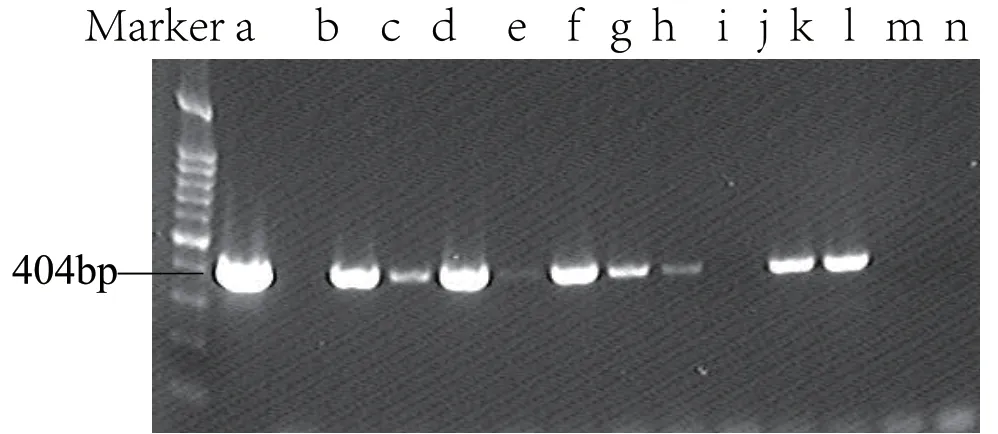
图1 P.gingivalis16S rDNA PCR 产物电泳图
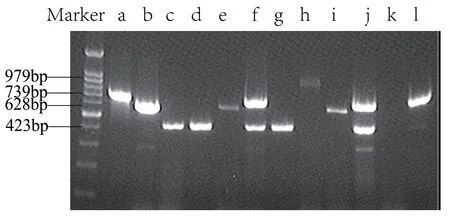
图2 4 种rag 基因型特异性引物PCR 产物电泳图
2.2 PCR 检测结果
以16S rDNA 引物PCR 扩增131 例患者临床标本,其中牙龈炎组扩增出63 例,阳性率70.79%;对照组扩增出15 例,阳性率35.71%。牙龈炎组明显高于对照组,两者之间有显著性差异(P<0.01)。
以引物A 为引物PCR 扩增78 例P.gingivalis 阳性患者临床标本,扩增出rag 基因的有61 例,阳性率78.21%,其中牙龈炎组54 例,阳性率85.71%;对照组7 例,阳性率46.67%。牙龈炎组明显高于对照组,两者之间有显著性差异(P<0.01)。(见表1)。
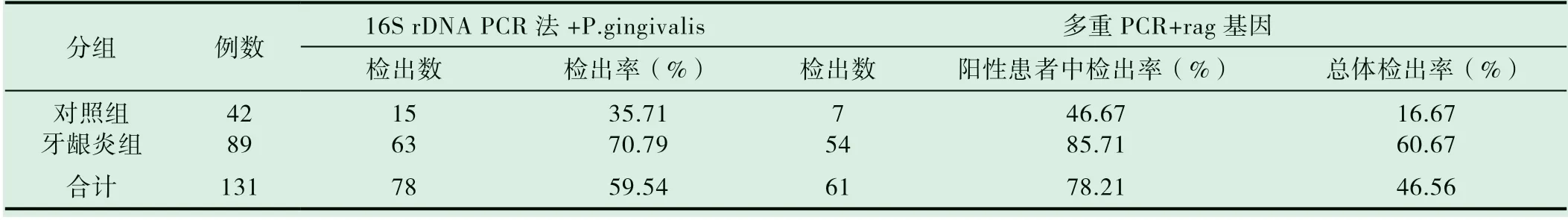
表1 普通PCR 及多重PCR 对临床标本的检测结果
2.3 P.gingivalis 及致病岛rag 基因检出率与临床指标之间的关系(表2)。
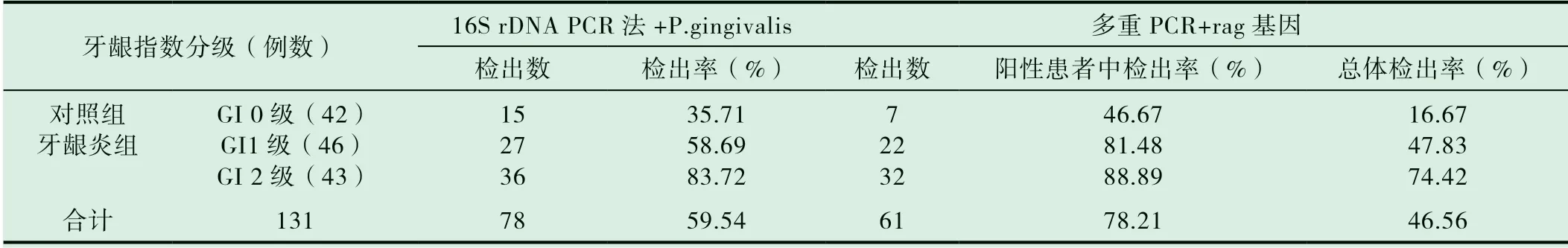
表2 P.gingivalis 及致病岛rag 基因检出率与牙龈指数之间的关系
用Spearman 等级相关分析P.gingivalis 及致病岛rag基因检出率均与牙龈指数GI 之间存在明显的正相关关系(P<0.01)。
牙龈炎组各项牙周检查指标(PLI、SBI 和PD)均显著高于对照组(P<0.05)。
3 讨论
牙周致病菌的存在是牙周病发生的必要条件(始动因子),牙龈卟啉单胞菌是目前公认的慢性牙周炎的主要致病菌之一,在口腔乃至全身感染性疾病中检出率极高,与临床厌氧菌感染的关系十分密切。它具有显著的毒力或致病性,能通过多种机制干扰宿主防御能力,具有引发牙周破坏的潜能。致病岛(Pa thogen icity island)的发现使人们对细菌致病性有了进一步的认识。致病岛又称毒力岛,是伴随肠道致病菌基因组结构和致病性研究逐步被揭示的。致病岛是指编码细菌毒力基因簇的一个相对分子质量较大的片段,是整合于细菌基因DNA 组的外源性成分,推测其来自于细菌进化过程中DNA 的基因水平转移事件。通过这一过程,细菌获得编码毒力因子的大片段的致病岛基因。大片段DNA 的致病岛基因的转移对宿主菌的致病能力或性状改变显著,且与细菌进化和新病原菌出现有关。一种病原菌往往具有1 个或几个致病岛,致病岛存在于强毒株中,一般弱毒株或无毒株中缺失[10-11]。目前,rag 位点被确定是P.gingivalis 的致病岛基因之一[4,12]。Rag 由RagA、RagB 两个基因编码组成,其中RagA基因的DNA 序列分析显示由氨基酸的前肽区(当蛋白酶激活时该区被切断)、蛋白酶区及羟基端的粘附区构成;而RagB无粘附区,其蛋白酶区、前肽区与RagA 基因的相应段紧密相关[13]RagA、RagB 基因分别编码RagA 和RagB 蛋白。RagA是TonB 类受体外膜蛋白;而RagB 是一种表面抗原,rag 蛋白构成膜转运系统,协助细菌从外部环境获取转运大分子,有助于细菌的存活和散播;同时Rag 蛋白还能够激活宿主的免疫及炎症反应[4]。Curtis 等[14]用PCR 技术分析ragB 在龈下菌斑的分布,发现rag+的牙龈卟啉单胞菌在深牙周袋比在浅牙周袋位点更易检测到。研究说明rag 基因可能影响牙龈卟啉单胞菌的潜在毒力。rag 位点在临床菌株中有4 种基因型,分别命名为rag-1、rag-2、rag-3 和rag-4[4,12]。
近年来,随着分子生物学发展,基因检测技术得以应用,多重PCR 技术(multiplex -polymerase chain reaction)直接检测未培养临床标本中的致病菌,为在基因水平上P.gingivalis的快速、敏感、特异的诊断提供了可靠手段。该检测技术是在一次反应中同时加入多对引物,对同一份模板DNA 样品中不同序列同时扩增,由于每对引物对所扩增的产物片段长短不同,因而通过电泳系统易区分,所以PCR 可以同时检测多个病原菌或一种病原菌中的多个致病基因型[15]。但由于多重PCR 要求在同一反应体系中进行多个位点的特异性扩增,因而技术难度增大,一个理想的多重PCR 反应体系,并非单一PCR 的简单混合,需要针对目标产物,进行全面分析、反复试验,建立适宜的反应体系和反应条件。该技术在检测口腔病原菌方面已有较多应用。García 等[16]应用多重PCR 成功地对伴放线放线杆菌、牙龈卟啉单胞菌、中间普氏菌进行了检测。占定凤等[17]建立了多重16S rDNA PCR 可同时检测慢性牙周炎标本中牙龈卟啉单胞菌、伴放线放线杆菌和齿垢密螺旋体,并证明所建立的多重16S rDNA PCR 有较高的敏感性和特异性。本研究采用改良聚合酶链反应-多重PCR 检测技术,通过优化多重PCR 反应条件可以直接检测临床标本中牙龈卟啉单胞菌不同Rag 基因型的分布,具有简单快速的特点,并且具有较高的敏感性和特异性。本研究中131 例患者临床标本,共扩增出P.gingivalis78 例,其中牙龈炎组扩增出63 例,阳性率70.79%;对照组扩增出15 例,阳性率35.71%。牙龈炎组明显高于对照组,两者之间有显著性差异(P<0.01)。78例P.gingivalis 阳性患者临床标本,扩增出rag 基因的有61 例,阳性率78.21%, 其中牙龈炎组54 例,阳性率85.71%;对照组7 例,阳性率46.67%。牙龈炎组明显高于对照组,两者之间有显著性差异(P<0.01)。用Spearman 等级相关分析P.gingivalis致病岛rag 基因检出率与牙龈指数GI 之间存在明显的正相关关系(P<0.01)。研究结果表明P.gingivalis 致病岛rag 基因与细菌致病性密切相关,在青少年牙龈炎的发生发展中起重要作用。

