淡水贝类观察*
——生物阐释水污染和毒理的创新手段
陈修报,杨 健 ,刘洪波,姜 涛
(中国水产科学研究院淡水渔业研究中心,长江中下游渔业生态环境评价和资源养护重点实验室,无锡 214081)
淡水渔业是国民经济的重要产业,是农业农村经济的重要组成部分,在保障粮食安全和优质蛋白质供给、增加农民收入和农村就业、加强生态文明建设等方面发挥了重要作用. 《2019中国渔业统计年鉴》显示我国淡水产品产量为3.156×107t,淡水养殖和捕捞产值为6350.04亿元,淡水养殖面积为5.146×106hm2[1]. 与此同时,淡水渔业生态环境(包括内陆重要渔业水域如江河、湖泊、水库,国家级水产种质资源保护区和重要人工养殖水域等)[2]也面临着较大的污染压力. 《2018中国渔业生态环境状况公报》指出,我国江河重要渔业水域总氮(TN)、总磷(TP)和重金属(如Cu)的超标面积分别为96.0%、36.0%和8.7%,湖泊、水库重要渔业水域TN、TP和Cu的超标面积分别为96.2%、87.4%和14.9%,国家级水产种质资源保护区(内陆)TN、TP、Cu的超标面积分别为89.5%、3.7%和9.8%[2];此外,有机污染物如滴滴涕(DDTs)、六六六(HCHs)也时常被检出,甚至一些水域污染严重[3-4]. 因此,迫切需要建立灵敏、有效、长期的污染监测、评价及预警研究体系. 同时,这也非常符合《关于加快推进水产养殖业绿色发展的若干意见》提出构建“优美水域生态环境”及《中共中央国务院关于全面加强生态环境保护坚决打好污染防治攻坚战的意见》部署“着力打好碧水保卫战”的战略要求.
水域生态环境的污染监测根据测试手段可分为理化监测和生物监测两大类[5-6]. 理化监测作为环境污染监测的一个重要手段,具有快速、简便等优点,但也存在着检测结果的“瞬时性”、无法反映污染综合效应及生物可利用性、一旦检出水体受到污染则损失往往难以挽回等局限性[3,5]. 与理化监测相比,生物监测具有以下优点:1)连续监测的功能,是对污染状况长期的、历史的反映;2)是对各种污染因子之间的协同、拮抗等作用做出的综合诊断;3)敏感性高,即使污染物在水环境中稀释了,也能对其产生积累作用,可对污染进行早期预警;4)长期监测的人力和物力成本比较低等[3,5-6].
贝类因具有营底栖生活、对污染物的高积累性和低代谢性等特征,被证实为水域生态环境污染生物监测的理想指示生物[7-8]. 基于贝类对水环境特别是海洋环境污染物的生物监测,在国际上(如美国、欧洲和亚太地区)非常活跃[9]. 其中最著名的莫过于美国国家海洋和大气管理局(NOAA)自1970s开始并迄今一直在延续的以紫贻贝(Mytilusedulis)等作为指示生物的“贝类观察”计划(Mussel Watch). 其监测的污染物种类包括持久性有机污染物、重金属、石油烃、放射性元素及新兴污染物等,监测范围已覆盖南美洲、中美洲、墨西哥、加勒比海、亚太地区、黑海和地中海地区[9]. 中国水产科学研究院南海水产研究所自1980s开始,以近江牡蛎(Crassostrearivularis)等作为指示生物的“南海贻贝观察”,监测和评价了广东沿海生态环境的污染动态[10]. 而在淡水领域,杨健等[11]于2003年创新性地提出了利用背角无齿蚌(Anodontawoodiana)(ND1和ITS1序列分析结果支持将传统上依据形态划分的背角无齿蚌(A.woodianawoodiana)、圆背角无齿蚌(A.woodianapacifica)和椭圆背角无齿蚌(A.woodianaelliptica)归为同一物种,即背角无齿蚌(A.woodiana)[12])作为指示生物来系统开展“淡水贝类观察”(Freshwater Mussel Watch)的设想[3,13],并成功应用于淡水渔业生态环境污染评价和毒理学研究[11,13-20]. 本文综述了“淡水贝类观察”研究体系在被动监测、主动监测及渔业环境研究用模式动物开发等方面的研究进展,以期为渔业生态环境污染的监测、评价、早期预警,阐释污染毒性机制以及渔业绿色发展提供参考.
1 背角无齿蚌被筛选为“淡水贝类观察”研究体系的专用指示生物
背角无齿蚌作为指示生物具有许多独特的优点:1)广泛分布于我国各地 (图1A),目前在世界(图1B)其他地区也广泛分布[21-40],如它是我国太湖蚌类的优势种之一,密度为0.026 ind./m2,生物量为0.82 g/m2,相对丰度达到12.42%[26];在波兰Vistula河谷的鱼塘综合体中,其密度可高达9 ind./m2,生物量达到3000 g/m2[35],因此能够在全球范围内采集到标本进行比较分析,研究结果的可比性较强;2)营底栖生活,活动范围狭窄,较鱼虾类等游动性生物更能反映出特定水域的污染情况[3];3)对污染物的耐受能力强[41],且对污染物具有高积累性和低代谢性,能够有效监测污染动态[3];4)体内积累的污染物含量与水环境中污染物含量呈简单相关关系,是对水环境污染动态的“连续性”监测[16];5)反映污染物的生物可利用性,而非单纯地测定水环境污染物的绝对含量[3];6)对污染物的积累能力较其他贝类(如褶纹冠蚌(Cristariaplicata)、圆顶珠蚌(Uniodouglasiae)、斑马贻贝(Dreissenapolymorpha)、三角帆蚌(Hypriosiscumingii))更强[42-44],能够起到污染灵敏监测和早期预警作用;7) 生命周期长,寿命可长达10年,能够对污染物进行长期的监测,即使死亡之后贝壳仍能记录历史环境污染状况[45-46];8)规格适宜,既容易采集,又能够力保每个个体独立成为实验分析样本[3];9)人工繁养技术已经完全突破[47-50],满足主动监测的要求;10)在食用、培育珍珠、净化水质等方面具有较高的经济价值和生态价值[50-54],对它们体内污染物的测定备受公众的关心和重视. 综合上述,背角无齿蚌被选定为“淡水贝类观察”研究体系的专用指示生物.
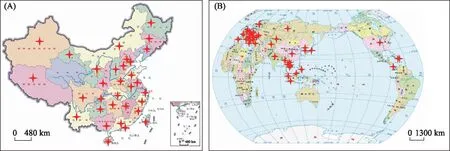
图1 背角无齿蚌在中国(A)及世界(B)的分布(标记分布区域)Fig.1 Distribution of Anodonta woodiana in China (A) and the world (B)(marks distribution areas)
2 被动监测
被动监测是指采集并分析特定水域野生贝类体内的污染物含量,从而评价水环境污染状况的方法[55]. 目前,基于“淡水贝类观察”理念的被动监测已较为广泛地应用于国内、外(如日本[56]、波兰[43]、塞尔维亚[57-58])的江河、湖泊和池塘等淡水渔业生态环境中有机污染物(表1)和重金属(表2)等的监测、评价和预警.
背角无齿蚌软组织对水体中HCHs、DDTs、多氯联苯(PCBs)、丁基锡(BTs)、苯基锡(PTs)、多环芳烃(PAHs)、农药(如草达灭(MOL)、禾草丹(THI)、草枯醚(CNP))(表1)以及微囊藻毒素(MC-RR、MC-LR)会产生明显的积累. 虽然其中一些有机污染物(如HCHs和DDTs)在中国已禁用近20年,但是蚌软组织仍能监测出这些污染物的环境残留. 此外,背角无齿蚌中MC-RR、MC-LR的积累量与蓝藻生物量之间呈现出正相关的趋势,如太湖中较易暴发蓝藻水华的华庄和犊山水厂水域蚌样中MC-RR和MC-LR干重含量分别可高达11.2和0.47 μg/g[59]. 与中国和国际的水产(制)品的相关限量相比较(表1),蚌软组织中积累的HCHs、DDTs和PCBs等有机污染物尚未超标,也反映出这些水域没有受到相关污染物的明显污染.
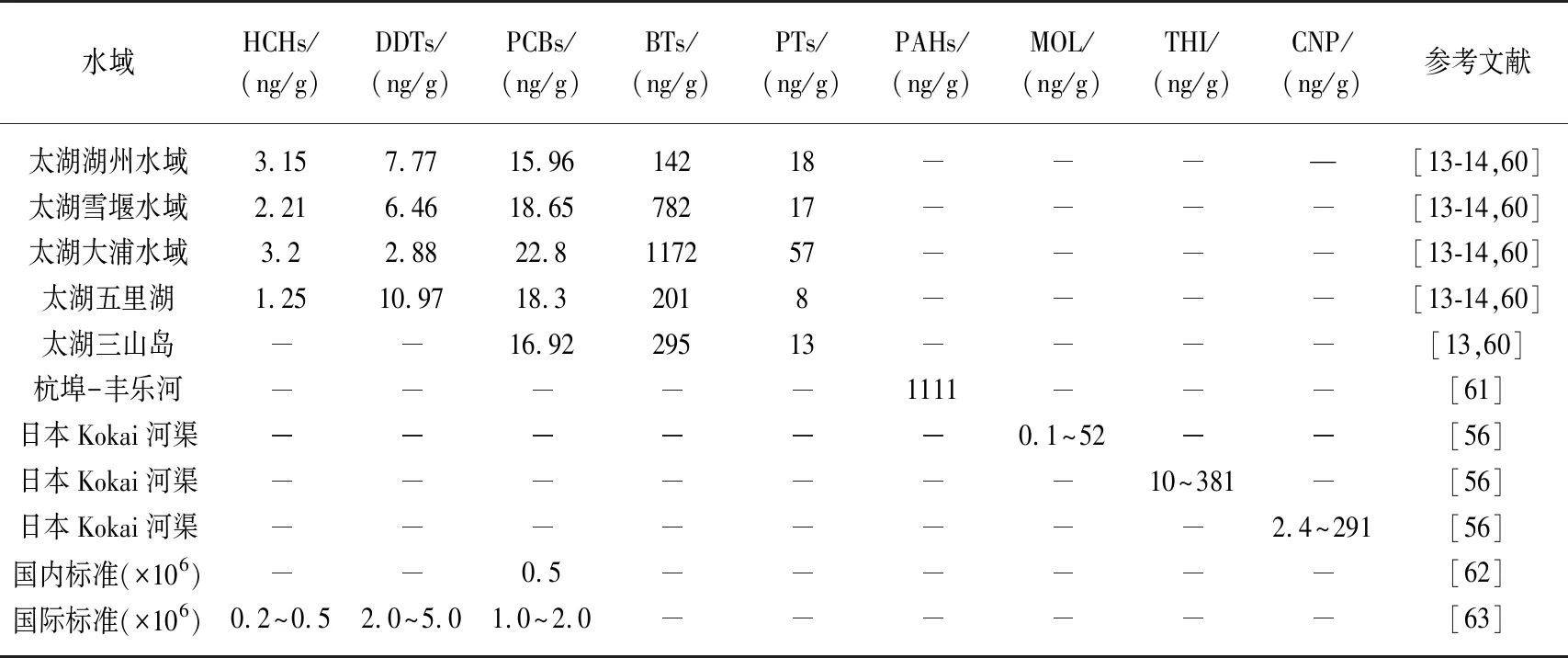
表1 基于背角无齿蚌作为指示生物的“淡水贝类观察”对不同水域有机污染物的被动监测*

重金属作为全球重点防控的污染物,对生物和人类的危害性极强[64-65],也是“淡水贝类观察”的研究热点. 从背角无齿蚌软组织中重金属的积累量可知:淡水环境中Co、Ni、Mo、Ag、Tl和Hg的含量普遍较低,而Mn、Fe、Zn、Ba、Al、Cr、Cu、Cd、Pb和As的含量相对较高(表2). 特别需要重视的是,杭埠-丰乐河中的Cr、太湖三山岛水域和漫山水域中的Cd以及嫩江中的Pb在背角无齿蚌中的积累量已超过我国相关标准(表2),波兰Licheński河中的Cu在背角无齿蚌中的积累量也已达到国际标准的限量(表2),提示这些水域可能受到相关重金属的污染.
除了软组织外,背角无齿蚌的贝壳也有应用于水环境污染的监测和评价的潜力. 研究表明幼蚌贝壳中Na和Cu的背景含量高于成蚌,后者Mn含量显著高于前者,而Ca、Na、Mn、Fe、Co、Cu、Mo、Ag和Tl在幼蚌和成蚌贝壳中的含量较为稳定[66]. 从重金属在贝壳中的分布来看,珍珠层比棱柱层更为灵敏地反映了重金属(如Mn)的变化动态,更适宜作为水环境重金属污染监测和评价的指示物[46].
值得注意的是,被动监测也会面临一定的局限性[3,9,16,67],主要有:1)采集的野生贝类的规格、年龄、种质质量、污染物暴露史等生物因子很难保证一致,这可能会影响到监测结果的阐释;2)某些水域可能根本就没有样本可采,造成监测“盲区”. 因此,突破这些限制将对“淡水贝类观察”应用的深度和广度具有重要意义.
3 主动监测
主动监测是指将洁净水体中的贝类移殖至待测水域,然后定期回捕,并进行污染物分析测定,以监测环境污染动态的方法[16,55]. 它具有传统采集水样分析等理化监测所不能替代的功效和所不具备的优势,主要体现在其可连续监测自移殖开始至回捕结束整个时间段的污染水平变化动态,真实反映污染物的生物可利用性,并可实现对污染的早期预警[3,5-6];此外,该法也可有效克服上述被动监测在标本的可采性、规格、种质质量、污染背景可控性等方面的局限[55,76]. 笔者实验室通过人工繁养技术,在洁净的中国水产科学研究院淡水渔业研究中心南泉科研基地,开发出了生物因子相同、遗传质量稳定、污染本底值较低、可向待测水域移殖和回收(由于背角无齿蚌在我国广泛分布,故不存在外来种入侵的问题),即“标准化”了的研究专用背角无齿蚌(简称“标准化”背角无齿蚌)[47-48,50],并发明了移殖贝类的专用网箱(图2)[77],进而建立了较为成熟的“淡水贝类观察”主动监测技术(图3).

图2 主动监测专用网箱Fig.2 The unique cage for mussel transplantation of active biomonitoring
目前,该技术已成功应用于湖泊、河道等水域重金属污染的监测、评价和预警(表3). 研究结果显示,虽然水体中重金属的含量均未超标[16,78],“标准化”背角无齿蚌软组织积累的重金属含量亦未超过我国及国际相关标准的限量(表3),但是更为灵敏的污染因子(contamination factor,CF;CF=移殖组蚌样中重金属含量/对照组中相应重金属含量,CF=0表示无污染,CF<1表示轻度污染,1≤CF<3表示中度污染,3≤CF<6表示重度污染,CF≥6表示严重污染[79-80])揭示了太湖五里湖和东湖可能受到Cu的污染,太湖锡东水厂水域可能受到Al、Cu和Cd的污染(表3),对相关污染起到了灵敏的早期预警作用.
4 渔业环境研究用模式动物开发
背角无齿蚌非常有潜力开发为渔业环境研究用模式动物:一是其生活史明确(图4)、人工繁养技术成熟[47-50]、繁殖能力强(每次产卵量为数万枚,且可分批产卵、分批排放),能够为研究提供充足的不同生活史阶段的样本;二是内部结构(图5)及功能清晰,且作为具有重要经济和生态价值的水产生物,其生理(如滤水率、心率)、生化(如抗氧化酶、非酶蛋白)特征已经被广泛深入地研究[3],作为模式动物的生物学理论背景清楚明确;三是随着基因家族分析及组学(如转录组)测序的深入推进[83-84],其遗传背景愈发清晰,这为深入研究环境毒理学效应提供了极为重要的生物信息资源. 目前,基于背角无齿蚌已开展了毒理学、污染物积累动力学及水质净化等方面的模式动物探究,并正在尝试建立标准化的背角无齿蚌“活体资源库”和标本“银行”[3].
在毒理学方面,已开展了个体、组织、生化、细胞和分子水平的探索. 通过个体水平的暴露研究,发现不同生活史阶段背角无齿蚌对污染物毒性的敏感性差异明显,总体表现为早期生活史阶段(如钩介幼虫、稚蚌)的敏感性远超过幼蚌和成蚌[17-18]. 例如, Cd2+对钩介幼虫24 h半致死浓度(24 h-LC50)为0.0018 mg/L[18],对稚蚌和幼蚌96 h半致死浓度(96 h-LC50)分别为0.0047和4.5 mg/L[18],对成蚌96 h-LC50高达134.9 mg/L[85],其中Cd2+对钩介幼虫24 h-LC50和稚蚌96 h-LC50甚至低于我国《渔业水质标准》(GB 11607-1989)规定的Cd限量(0.005 mg/L)[18];Cu2+对钩介幼虫24 h-LC50为0.082 mg/L[17],对稚蚌、幼蚌和成蚌96 h-LC50分别为0.012、3.4和22.1 mg/L[17,86],其中Cu2+对稚蚌96 h-LC50非常接近我国《渔业水质标准》(GB 11607-1989)规定的Cu限量(0.01 mg/L). 受到Cu2+致毒后,背角无齿蚌会表现出闭壳肌收缩频率降低及贝壳张开幅度变小等行为变化趋势[19,87],贝壳中蛋白质含量则呈现出先增加再降低的变化趋势[88]. 重金属(如Cu、Cd)对背角无齿蚌的毒性效应,往往是由于重金属在有机体内的高度积累从而诱导产生过量的活性氧(ROS)[89],当ROS无法被及时清除时就会造成氧化损伤[89],主要表现为DNA损伤[18,57,90]、DNA甲基化错位[91],钙调节蛋白(CaM)基因表达量增加[92],诱导(或先诱导再抑制)抗氧化酶(如SOD、CAT、GPx)的合成[85-86,93-103],导致膜脂质过氧化[18,85-86,93-94,104],诱导金属硫蛋白(MT)合成[105],甚至导致组织结构病变[106]和蚌死亡[18]. 然而,重金属对背角无齿蚌致毒的分子机制研究仍显不足,今后需要多加关注. 与之相反,有机污染物(如多溴联苯醚-47、多溴联苯醚-209、2,4-二氯苯酚、2,4,6-三氯苯酚、五氯苯酚、全氟辛烷磺酸、全氟辛酸)对背角无齿蚌的毒性效应研究集中于分子水平. 例如,多溴联苯醚-47和多溴联苯醚-209会导致Cu/Zn-SOD、CAT、HSP60和HSP70基因表达量增加[83,107-109];2,4-二氯苯酚和2,4,6-三氯苯酚会导致Se-GPx基因表达量增加[110];五氯苯酚会导致GST基因表达量增加[111-113];全氟辛烷磺酸和全氟辛酸会导致Prx基因表达量增加[114]. 鉴于此,有机污染物对背角无齿蚌的分子间相互作用机制以及其他水平的响应特征可能是下一步研究的重点. 值得注意的是,生命系统在不同水平对污染物毒性的应答顺序大不相同,个体和组织的应答效应可能要数天才能反映出来,而生化、细胞和分子的应答时间可以短至数小时甚至数秒[115]. 因此,有必要在上述主、被动监测的基础上,开发出对相关污染物具有特异性的生物标志物,从而更加快速、灵敏地进行污染物毒性评价及其污染早期预警.
在背角无齿蚌对污染物的积累动力学方面,目前的研究还较少且仅局限于水相. 利用水相Cd2+(0.168和0.675 mg/L)对背角无齿蚌开展28 d暴露及28 d释放研究,发现随着Cd2+浓度的增加和暴露时间的延长,蚌各组织(包括肾脏、鳃、消化腺、外套膜、内脏团、斧足、闭壳肌、血淋巴)中Cd2+积累量均显著增加,其中肾脏、鳃、消化腺的生物积累因子(BCF)较高(约为102)且排出率较低(总体在40%左右),被认为是Cd2+积累的“靶组织/器官”[116]. 此外,李威等[117]还证实了背角无齿蚌鳃、内脏团和外套膜是重金属(如Cu、Zn、As、
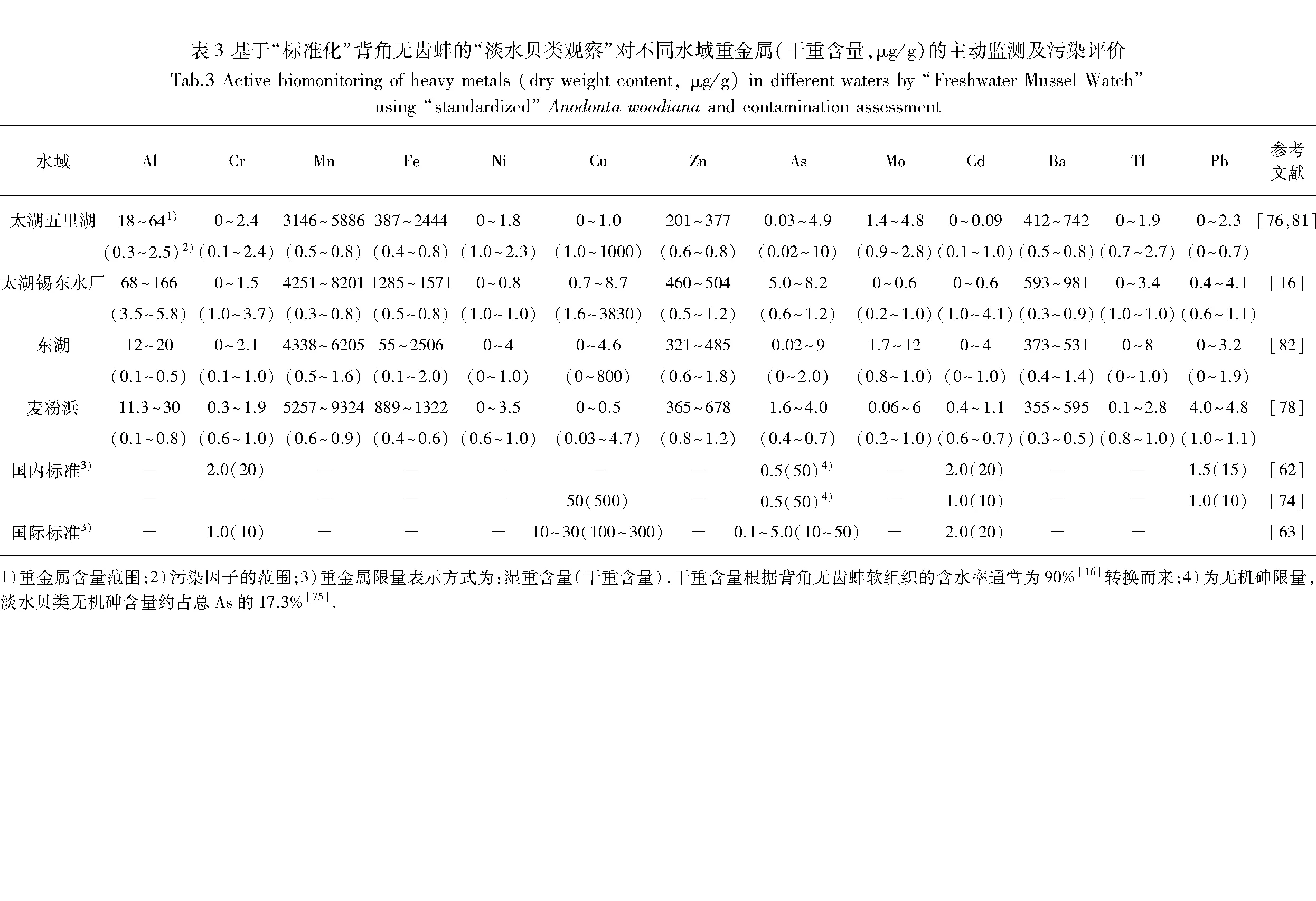
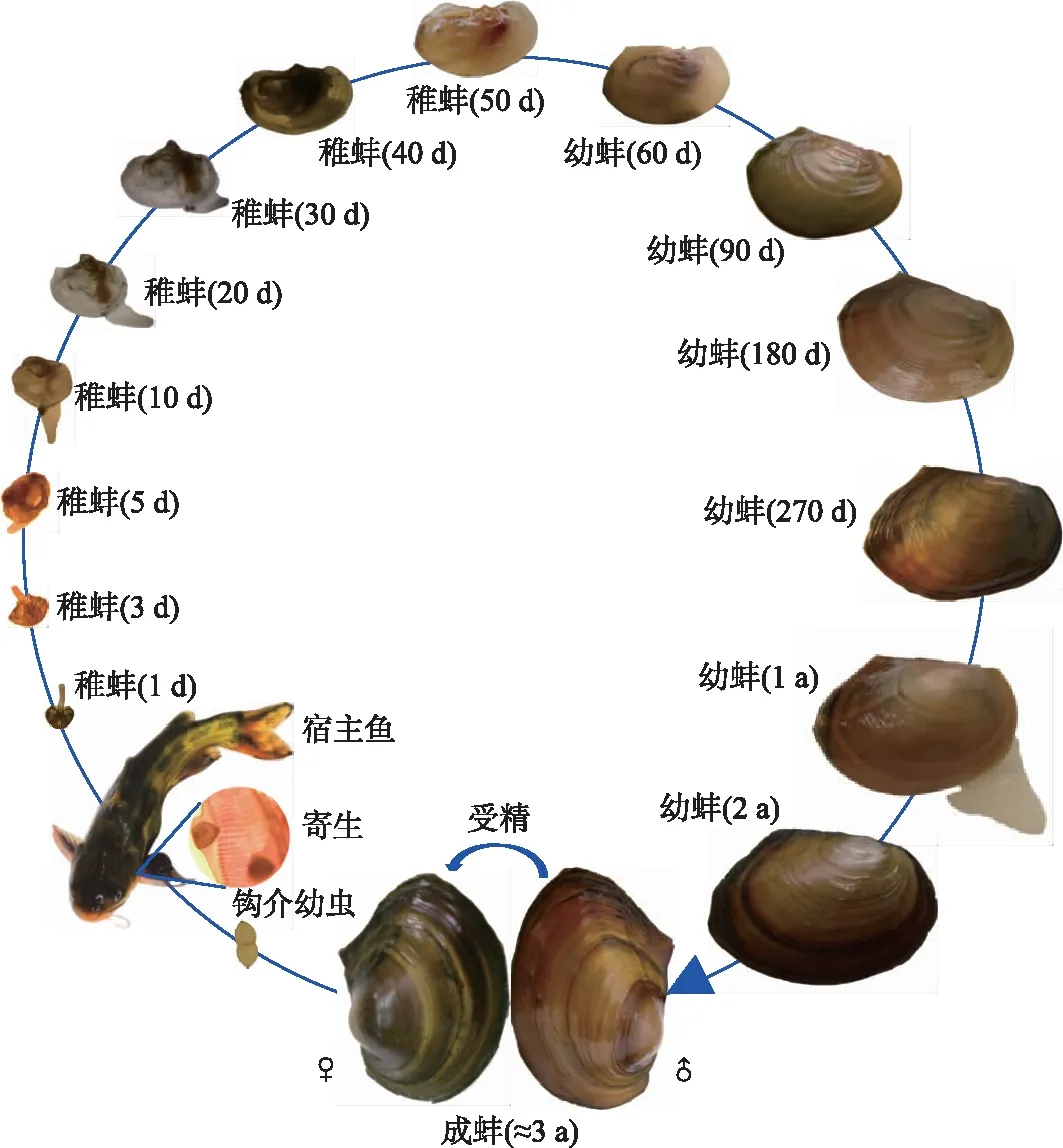
图4 背角无齿蚌生活史Fig.4 Life cycle of Anodonta woodiana
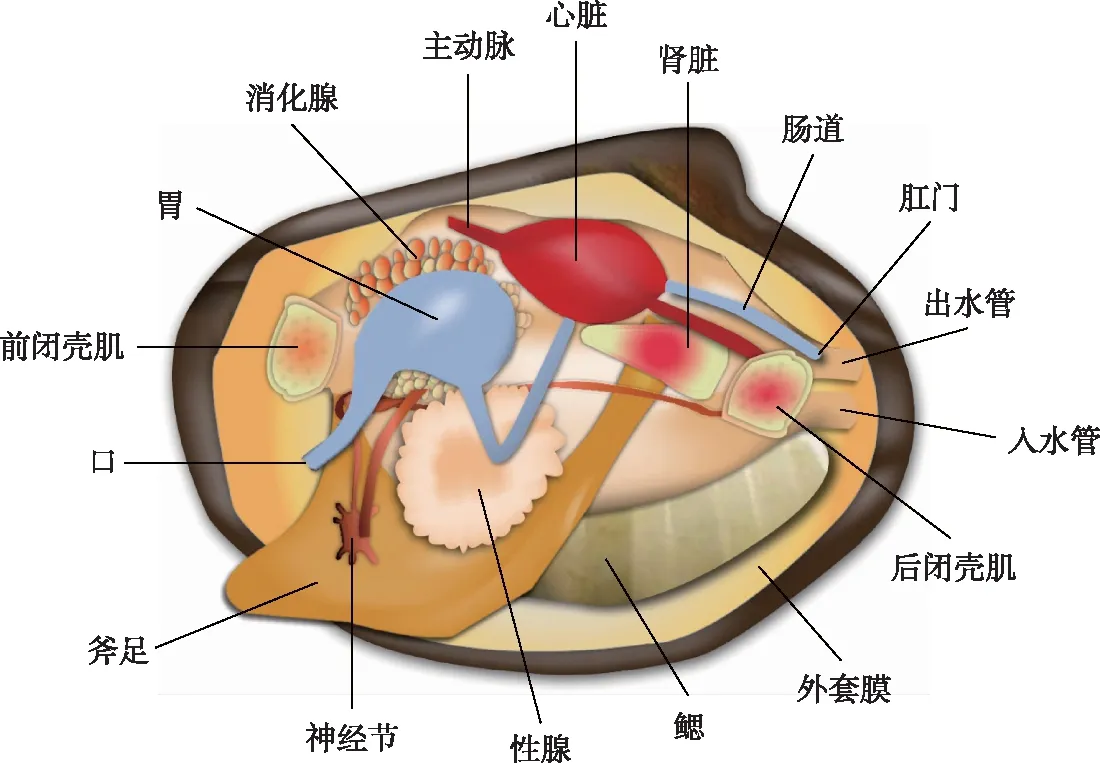
图5 背角无齿蚌内部构造示意图Fig.5 The schematic diagram of internal structure of Anodonta woodiana
Ni)积累的“靶组织/器官”. 基于水相4,4′-二氯二苯硫醚(1、10和100 μg/L)对背角无齿蚌开展28 d暴露及14 d 释放研究,发现蚌(鳃、肝脏和肌肉)对其吸收率为0.509~21.734 L/(d·g),排出率为0.083~0.221 d-1,生物半衰期为3.14~8.35 d,BCF为3.662×103~124.979×103[118]. 这些研究均表明背角无齿蚌对水相污染物具有高积累性和低代谢性,然而在渔业生态环境中以食物相存在的污染物[119]的积累动力学尚未知. 因此,在今后的研究中有必要同步探究水相和食物相污染物的积累特征.
利用背角无齿蚌开展水质净化方面的研究近年来备受关注,已成为“以渔净水”领域的研究热点. 背角无齿蚌作为“不投饵滤食性”代表性水产生物之一,具有强大的不间断滤水功能(滤水率可高达60 L/(kg·h))[120],以水环境中的藻类、细菌、浮游动物、有机残渣及底泥为食[121-124],在生态系统的物质循环和能量流动中发挥重要作用,也被誉为“淡水生态系统工程师”[121]. 毋庸置疑,背角无齿蚌通过强大的滤食作用能够显著、快速提升水体的透明度[121,125-126],例如,净化20 d后水体中浊度和Chl.a浓度的下降幅度可高达90.9%和90.8%[121]. 此外,由于对重金属的高积累性和低代谢性,背角无齿蚌很有潜力用于渔业生态环境重金属污染的防控[44,124,127]. 其对水体中Al、Cr、Fe、Ni、Zn和Mo的去除率可分别达到63.0%、80.3%、12.7%、100%、81.8%和4.8%[127];对底泥释放的Al、Cr、Mn、Co、Cu、Zn、As和Mo的去除率可分别达到93.8%、98.0%、33.3%、14.3%、23.5%、69.4%、60.5%和13.0%[124]. 然而,在背角无齿蚌能否降低水体富营养化水平方面尚存在一定争议. 一些学者研究表明背角无齿蚌能够显著降低富营养化水体中Chl.a浓度,并改变了浮游藻类的群落结构(使优势种由蓝藻转变成硅藻),还能显著降低水体总悬浮物浓度,通过提高水体透明度和沉积物表面光照条件,显著提高底栖藻类的生物量,从而改变富营养水体中底栖藻类和浮游藻类的竞争关系,促进水生态系统从混水态向清水态转变[125,128-129]. 此外,对降低水体中TN、氨氮、硝态氮、TP、磷酸盐和CODMn浓度同样具有较好的效果,对它们的去除率分别可达到24.1%、90.9%、42.6%、70.0%、58.1%和50.0%[124,127-128]. 鉴于此,认为利用背角无齿蚌能够有效防治水体富营养化[124-125,127-129]. 另有一些学者则认为虽然背角无齿蚌能够显著降低微囊藻等蓝藻的数量及其所占的相对百分比,但是迅速增加绿藻所占比例[130-131];可快速降低TN、TP和总溶解磷浓度,然而会升高总溶解氮浓度[132],特别是在高水温期间还可能导致TN和TP浓度增加[131],或者在高密度养殖情况下虽可降低微型生态系统中悬浮态氮浓度,但会明显增加水中的溶解性氮、磷浓度[130],因此可能难以改善水体富营养化[130-132]. 笔者研究发现背角无齿蚌净化水质效果(包括重金属和营养盐)受到养殖密度和处理时间的共同影响[121,124,127,133]. 根据不同水体污染的实际情况,建立水质净化模型(如响应面优化分析)来确定蚌养殖密度和处理时间的最佳配比[121,124,127,133],应该能够提升背角无齿蚌对水质(包括理化指标、重金属和营养盐)的净化效果,达到改善水质的目的.
5 结论与展望
综上所述,“淡水贝类观察”可能是世界上首个较为系统地应用指示生物阐释淡水渔业生态系统污染状况和毒理机制的研究体系[3],目前已成功应用于国内外的江河、湖泊和池塘等淡水水域无机(特别是重金属)、有机污染物和藻毒素污染的监测、评价、预警和保护,并在毒理学、污染物积累动力学及水质净化等方面进行模式动物开发研究,展现出广泛的应用前景. 为了更好地服务渔业绿色高质量发展、贯彻碧水保卫战的战略要求,亟需开展以下工作:
1) 背角无齿蚌在全国乃至全球广泛分布,且人工繁养技术成熟,建议在更广泛的淡水水域中开展基于该蚌的被、主动监测(包括个体和生物标志物监测),并建成标准化的背角无齿蚌“活体资源库”和标本“银行”,以摸清各水域的污染背景、把握污染趋势,从而更有针对性地提出水生态环境保护措施.
2) 背角无齿蚌被越来越多地作为模式动物来开发,然而还有一些深层次的机制需要破解. 例如,污染物(有机污染物、重金属、营养盐等)对背角无齿蚌的毒性机制及其积累动力学尚不完全清楚. 只有从个体、组织、生化、细胞和分子等不同层次全面掌握污染物的积累规律和毒性效应特征,才能更精准地阐释水生态污染状况,更科学地应用生物操控技术改善水质.

