夏季东太湖光合有效辐射衰减特征及其对沉水植物恢复的指示*
徐德瑞,周 杰,2,吴时强,2,戴江玉,吴修锋,2
(1:南京水利科学研究院,南京 210029) (2:水文水资源与水利工程科学国家重点实验室,南京 210098)
湖泊水体的透光强度决定了水中生物的生长状态,透光深度直接影响了沉水植物的定植深度. 沉水植物恢复是生态修复的关键,也是水体生物多样性赖以维持的基础. 研究表明,水下光照强度对沉水植物生长起着主要限制作用,是影响沉水植物生长的主要环境因子[1-2],研究水下光照衰减可为沉水植物生长提供一定理论依据. 光照进入水体中会受到纯水、悬浮颗粒、浮游植物的吸收和散射以及有色可溶性有机物的吸收作用,从而引起光照的衰减[3]. 早在1970s,国外学者就研究了悬浮颗粒、叶绿素a对水下光照衰减的影响[4],到了1990s,我国开始研究太湖悬浮质、可溶性有机质和藻类色素对可见光的吸收和散射作用[5]. 随后杨顶田等[6]、张运林等[7]继续在太湖开展相关研究工作.
东太湖是太湖东部的一个湖湾,水质曾是整个太湖最好的区域,2002年以前沉水植物分布广泛,之后开始减少,近几年沉水植物生物量和分布面积都有所下降[8-10]. 因此,了解水体光衰减特性与主导因子,有助于探索改善光照环境的有效措施,恢复沉水植物,促进水生态系统的良性循环. 虽然东太湖的光学特性方面已开展了相关研究[7,11],但针对不同区域光衰减特性的详细研究未见报道. 不同水体环境中,影响光衰减的主要因素有所区别. 太湖是一个常年受风浪影响的浅水湖泊,悬浮颗粒浓度较高. 相关研究表明,一般情况下风浪扰动引起水中悬浮物增加是改变水下光照分布的主要原因,但东太湖水生植物分布广泛,湖湾较多,波浪影响小,影响水下光照衰减的主导因素较为复杂. 另外,以往大多只是关注如何恢复沉水植物,而在草藻共生区域保护现存沉水植物不受破坏更为重要. 因此,本文基于2019年8月份的采样数据,根据沉水植物生物量划分区域,旨在分析东太湖夏季不同区域的水体光学特征以及影响光照衰减的主导因素,以期为保护和恢复东太湖沉水植物以及类似湖泊研究提供基础资料.
1 研究区域与方法
1.1 研究区域
东太湖(30°58′~31°07′N,120°25′~120°35′E)是太湖东南部东山半岛东侧的一个湖湾,与西太湖之间以狭窄的湖面相通,其末梢一直延伸到瓜泾口,总长度27.5 km,最大宽度9.0 km,总面积131.25 km2,平均水深不超过1.2 m[12].
本次研究共设置10个采样点,如图1所示,其中1#、6#、7#采样点位于东山沿岸区域,2#、5#、8#、10#采样点位于围网拆除区域,3#、4#、9#采样点位于行洪通道区域.
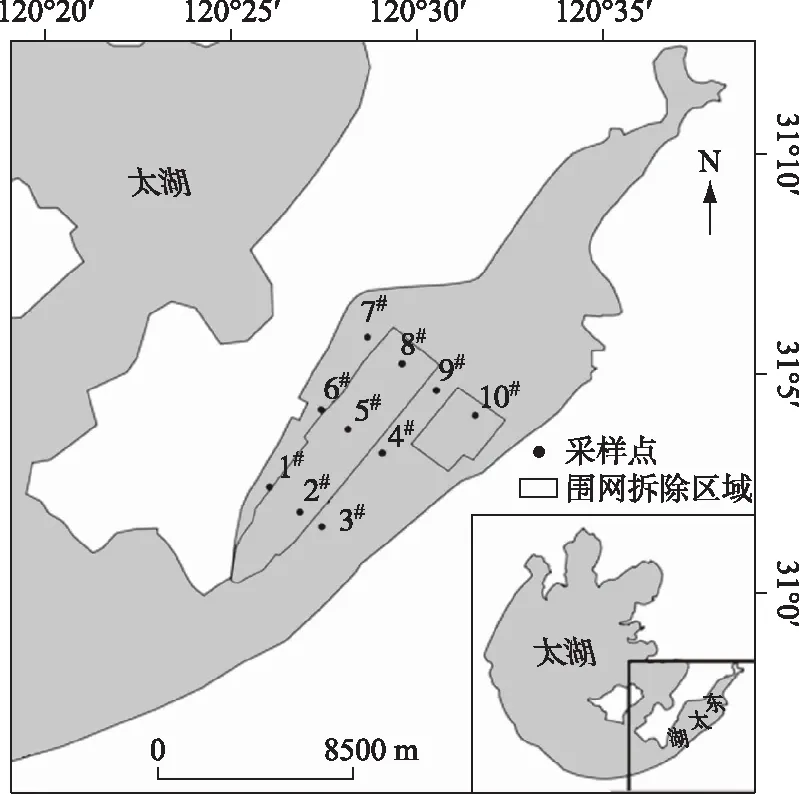
图1 东太湖采样点分布Fig.1 Location of sample sites in eastern Lake Taihu
1.2 样品采集与测定
2019年夏季8月份共16次对东太湖水深(H)、透明度(SD)、水下光合有效辐射(PAR)、无机悬浮物(ISS)、有机悬浮物(OSS)、叶绿素a(Chl.a)和CDOM吸收系数等指标进行了调查,采样期间无风或微风,采样时间控制在9:00-12:00.
1.2.1 现场指标测定 水深使用测深杆进行测量,透明度使用塞氏盘测量. 采用美国Apogee公司生产的MQ-510 全光谱水下光量子测量仪(光谱响应范围为389~692 nm±5 nm,测量范围为0~4000 μmol/(m2·s)),测量水体表面以下0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4 m处的光照强度,每层记录3个数据,3个数据的平均值作为该层的PAR光照强度.
1.2.2 实验室测定 在现场用1 L聚乙烯塑料瓶取0.5 m处表层水装满,带回实验室储存在4℃冰箱中,并在48 h内完成进行实验室分析测试. ISS、OSS、Chl.a、总氮(TN)和总磷(TP)浓度等按照《湖泊富营养化调查规范》[13]进行测定.
有色可溶性有机物(CDOM)吸收系数测定时先用滤膜过滤水样,将滤液再用0.22 μm的Millipore膜过滤,最后得到的滤液在UV-2401分光光度计下测定其吸光度,然后根据式(1)计算出各波长的吸收系数,并用式(2)进行散射校正[14].
αCDOM(λ′)=2.303D(λ)/r
(1)
αCDOM(λ)=αCDOM(λ′)-αCDOM(750)·λ/750
(2)
式中,αCDOM(λ′)为未校正的吸收系数,m-1;D(λ)为吸光度;r为光程路径,m;λ为波长,nm;αCDOM(λ)为经过散射校正的吸收系数,m-1;αCDOM(750)为750 nm处测定的吸收系数,m-1. 由于CDOM 物质组成极为复杂,本次研究用440 nm吸收系数来表示其浓度.
1.2.3 沉水植物生物量 使用水草采集镰刀(用长为0.12 m的刀头绑在3 m竹竿上)靠近底泥旋转一周, 采集0.045 m2的沉水植物地上部分. 同一采样点采集2次以保证样品采集完全. 采集后用湖水清洗,去除泥、枯枝败叶和其他杂质,称其鲜重. 所有称量操作均进行两次,取其平均值记录.
1.3 东太湖区域划分方法
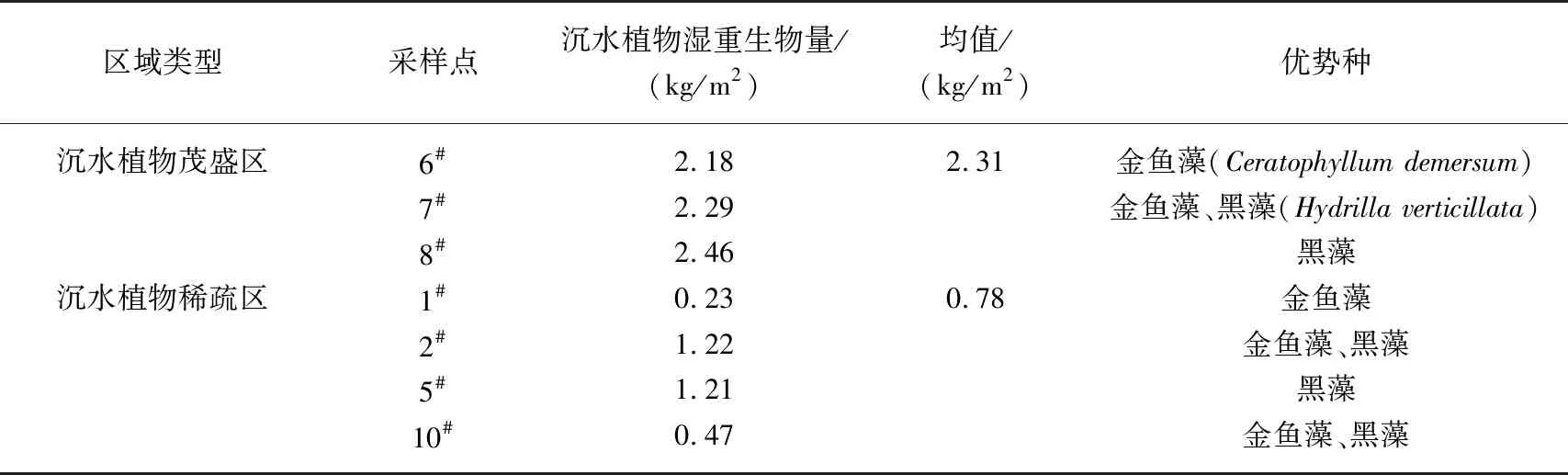
采样期间调查了各采样点沉水植物生物量和优势种. 根据生物量的大小初步将东太湖划分为3种区域:沉水植物茂盛区、沉水植物稀疏区和无植物区.
1.4 光衰减系数和真光层深度计算
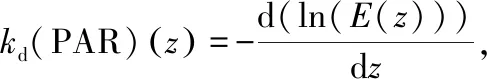
(3)
式中,z为水面到测量处的深度,E(z)为深度z处的辐照度,E(0)为表面辐照度. 真光层深度为辐照度为水体表面辐照度1%的深度,常作为恢复沉水植物的临界深度[11],计算公式为:
(4)
式中,Deu为真光层深度,m;kd(PAR)为光合有效辐射衰减系数.
1.5 草型、藻型湖泊划分依据和富营养化评价方法
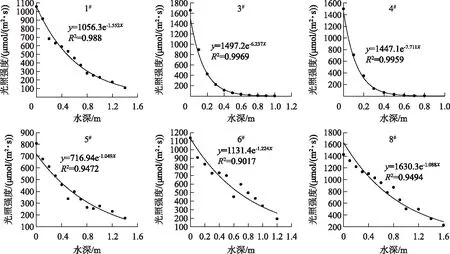
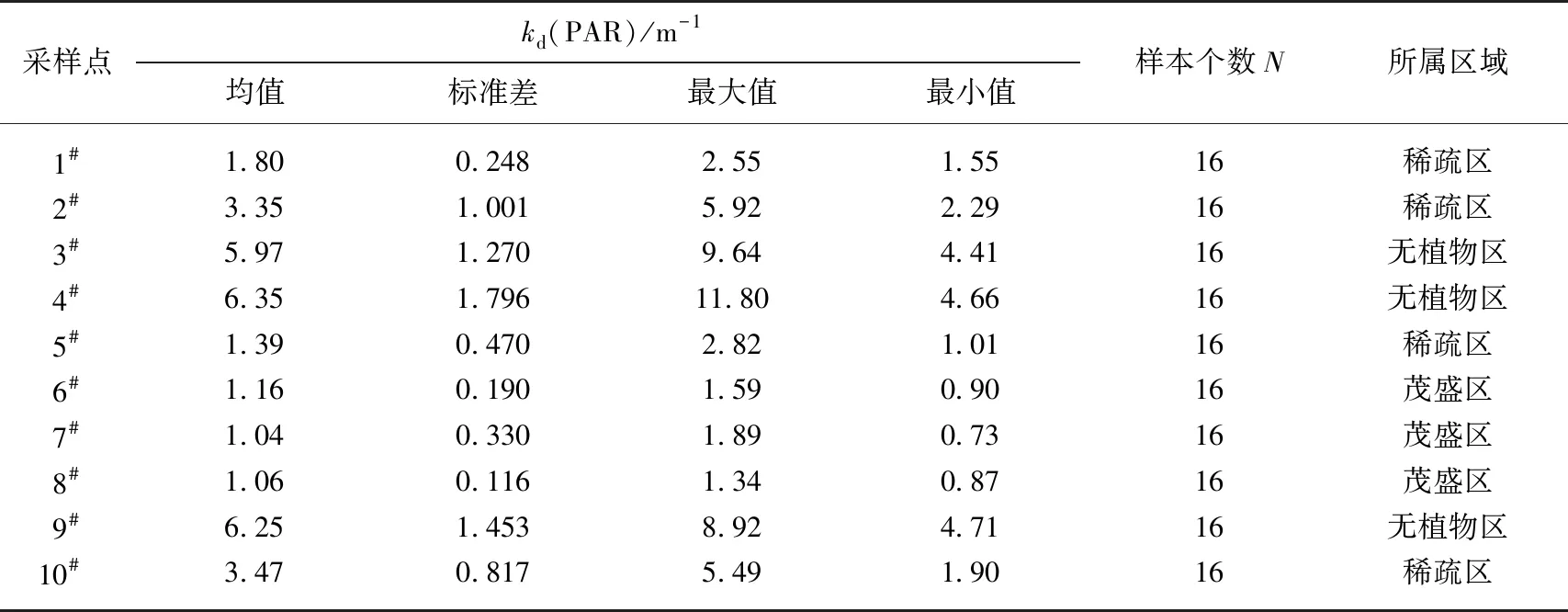
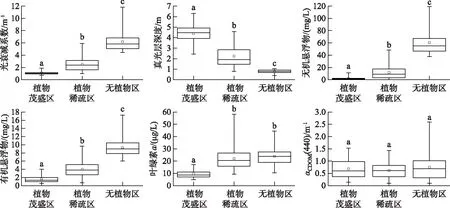
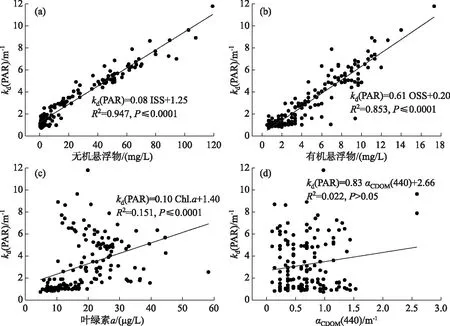
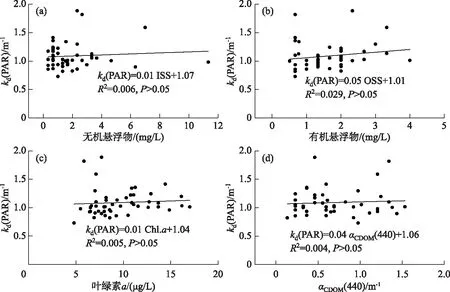
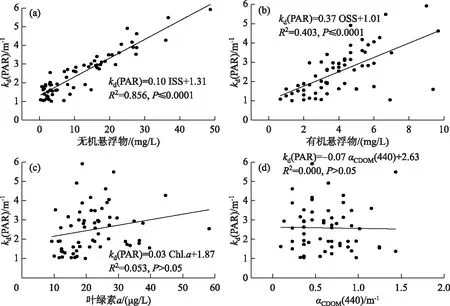
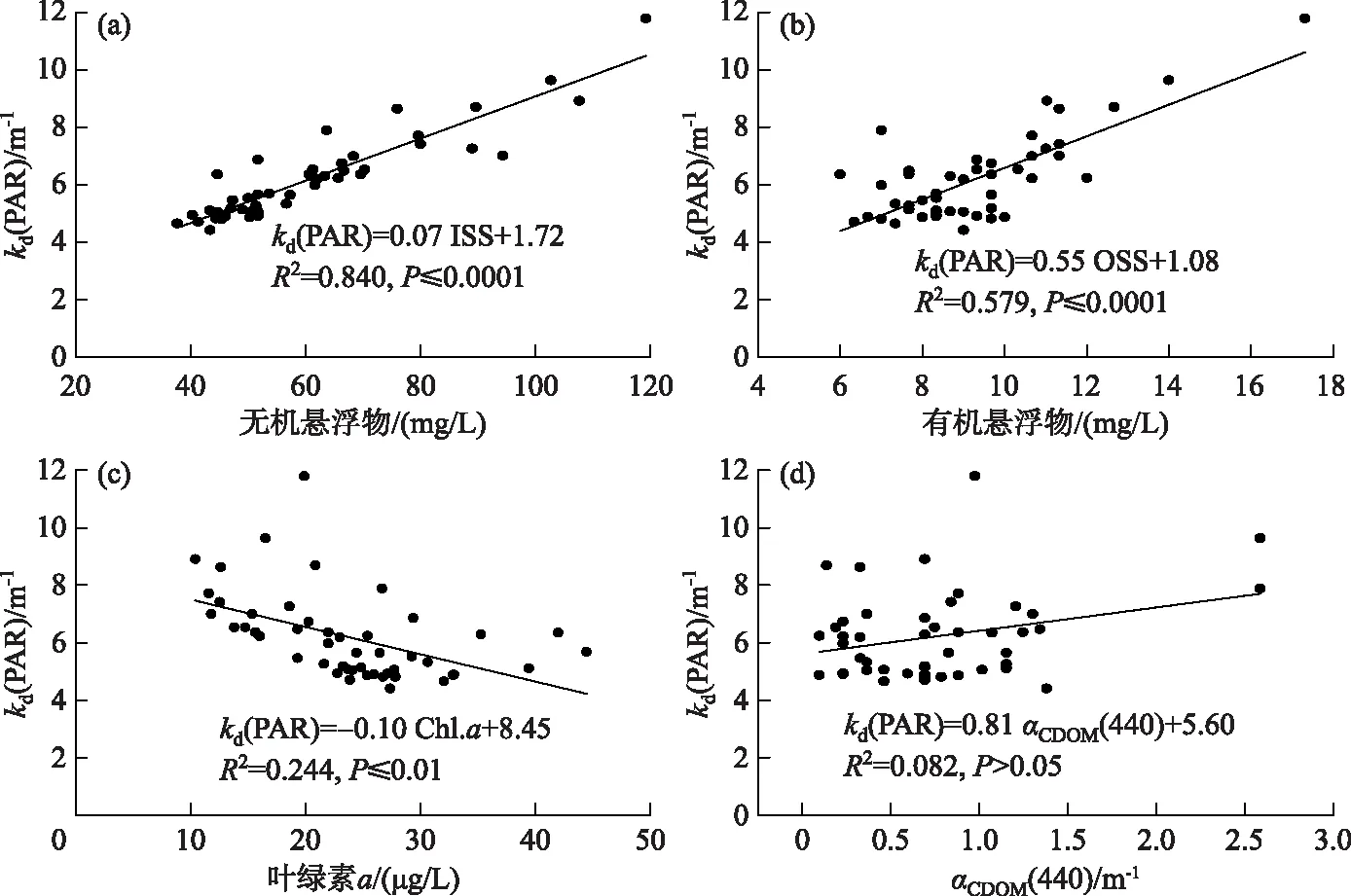
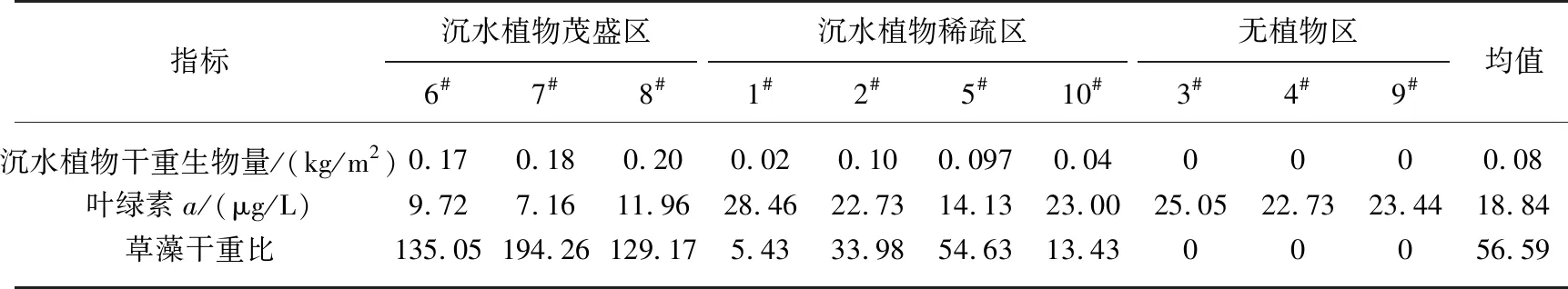
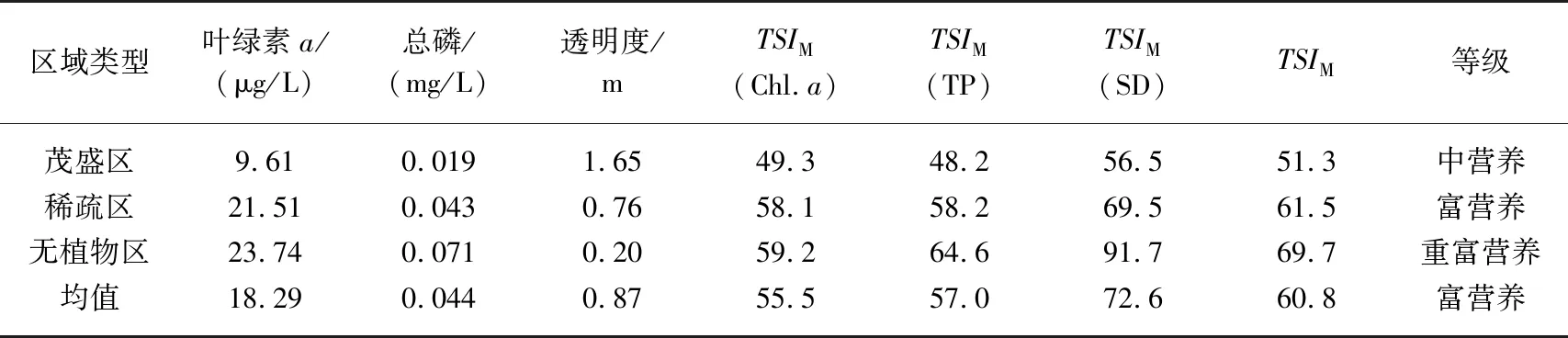
根据Bachmann等方法对藻型稳态和草型稳态进行划分[16]:草藻干重比a=沉水植物干重/浮游藻类干重;a≥100为草型稳态,a≤1为藻型稳态,1 其中,沉水植物干重生物量用沉水植物湿重生物量乘0.08表示[17],藻类干重生物量通过Chl.a浓度乘70再乘湖泊平均水深得到[18]. 根据Aizaki修正的营养状态指数(trophic state index,TSIM)来评价研究水域的富营养化状态,并用加权平均计算处理,其中Chl.a、TP和透明度的比重分别为54%、29.7%和16.3%,评价标准为:TSIM<37为贫营养,37≤TSIM<53为中营养,53≤TSIM<65为富营养,TSIM≥65为重富营养[19-21]. 采用One-way ANOVA 对不同区域光学特性和衰减因子的差异性进行分析. 线性回归运用SPSS 20.0进行分析,采用向后多元回归方法筛选不同区域内的主导衰减因子. 采用平均相对误差(MAPE)和均方根误差(RMSE)两个指标对多元回归模型精度验证结果进行评价,计算公式为: (5) (6) 式中,n为样点数目,Esi和Oi分别为第i个样点的模型估算值和实测值. 由于PAR测量数据较多,因此在3种区域选择了6个采样点(1#、3#、4#、5#、6#、8#)的PAR垂向分布特征及指数回归结果进行展示(图2). 在现场测量过程中,明显的异常值被舍弃,重新进行测量. 各采样点的指数拟合决定系数(R2)都达到了0.9以上,其中,无植物区域拟合效果较好,沉水植物分布区域内拟合效果较差,测量时水下植物的遮挡是影响拟合效果的主要原因,天气状况、波浪也可能对结果产生一定影响. 图2 6个代表点位PAR强度垂直分布特征Fig.2 Vertical distribution characteristics of PAR intensity of six typical sampling sites 尽管东太湖面积很小,但不同区域kd(PAR)的差异比较大(表1). 8月份各采样点的kd(PAR)均值在1.04~6.35 m-1之间变化,极差为5.31 m-1,其中6#、7#、8#点位kd(PAR)均值较小,范围为1.04~1.16 m-1,该区域为沉水植物茂盛区;1#、2#、5#、10#点位kd(PAR)均值较大,范围为1.39~3.47 m-1,该区域为沉水植物稀疏区;3#、4#、9#点位kd(PAR)均值最大,范围为5.97~6.35 m-1,该区域为无植物区. 表1 东太湖kd(PAR)的计算结果 如图3所示,东太湖kd(PAR)的空间变化规律为:植物茂盛区(1.09 m-1)<植物稀疏区(2.50 m-1)<无植物区(6.19 m-1).kd(PAR)在植物茂盛区最小,变化范围为0.73~1.89 m-1,平均值仅为1.09 m-1,显著低于植物稀疏区和无植物区(P<0.05);kd(PAR)在无植物区最大,变化范围为4.41~11.80 m-1,平均值为6.19 m-1,显著高于植物茂盛区和植物稀疏区(P<0.05). 真光层深度与kd(PAR)相反,空间变化规律为无植物区(0.78 m)<植物稀疏区(2.25 m)<植物茂盛区(4.38 m),变化范围为0.39~6.31 m,3种区域间存在显著性差异(P<0.05). 图3 东太湖水体kd(PAR)、真光层深度、ISS、OSS、叶绿素a和CDOM吸收系数箱线图(实线上、下端代表最大值和最小值;矩形的上、下端代表上四分位数和下四分位数;中间横线为中位线;小正方形为均值;图中字母表示Tamhane’s T2多重比较检验结果,字母不同表示差异显著(P<0.05))Fig.3 Box plot of kd(PAR), euphotic depth, suspended particulate inorganic matter, suspended particulate organic matter, chlorophyll-a and CDOM absorption coefficient in eastern Lake Taihu ISS和OSS浓度的变化规律一致:植物茂盛区(ISS:1.95 mg/L,OSS:1.63 mg/L)<植物稀疏区(ISS:11.91 mg/L,OSS:4.00 mg/L)<无植物区(ISS:60.85 mg/L,OSS:9.29 mg/L),二者浓度范围分别为0.33~119.27 mg/L、0.51~17.31 mg/L,3种区域间存在显著性差异(P<0.05);Chl.a浓度变化规律为植物茂盛区(9.61 μg/L)<植物稀疏区(22.08 μg/L)<无植物区(23.74 μg/L),范围在4.79~58.21 μg/L之间,植物稀疏区与植物茂盛区差异显著(P<0.05),而与无植物区没有显著差异(P>0.05);αCDOM(440)变化规律为植物稀疏区(0.63 m-1)<植物茂盛区(0.69 m-1)<无植物区(0.76 m-1),变化范围为0.10~2.59 m-1,且3种区域无显著性差异(P>0.05). 与无植物区相比,沉水植物茂盛区kd(PAR)减少了83.4%,光衰减因子中,ISS、OSS、Chl.a浓度和αCDOM(440)分别减少了96.8%、82.5%、59.5%和9.2%. 分别将整个东太湖和3种区域的kd(PAR)与ISS、OSS、Chl.a浓度和CDOM进行线性拟合,结果发现东太湖kd(PAR)与ISS浓度有很好的线性关系,R2为0.947(图4a),与OSS浓度的线性关系也比较好,R2为0.853(图4b),但与Chl.a浓度的线性关系较差,R2为0.151(图4c),与CDOM吸收系数无显著线性关系,R2为0.022(图4d). 茂盛区kd(PAR)与各影响因子均没有显著线性关系(图5);稀疏区kd(PAR)与ISS、OSS浓度呈显著正线性关系,与Chl.a浓度、CDOM吸收系数无显著线性关系(图6);无植物区kd(PAR)与ISS、OSS浓度呈显著正线性关系,与Chl.a浓度呈显著负线性关系,与CDOM吸收系数无显著线性关系(图7). 图4 东太湖kd(PAR)与无机悬浮物(a)、有机悬浮物(b)、叶绿素a(c)和CDOM吸收系数(d)的线性拟合Fig.4 Linear fitting between kd(PAR) and suspended particulate inorganic matter (a), suspended particulate organic matter (b), chlorophyll-a (c) and CDOM absorption coefficient (d) in eastern Lake Taihu 上节分析表明,东太湖不同区域的kd(PAR)差异显著,衰减因子也有较大的区别. 通过向后法进行多元线性回归,对每种区域光衰减的主导因子进行分析. 沉水植物茂盛区回归模型先后剔除了αCDOM(440)、Chl.a、ISS和OSS浓度,表明影响该区域水下光衰减的因素主要是水体本身的吸收和散射;沉水植物稀疏区的kd(PAR)与衰减因子的表达式见表2模型1,模型先后剔除了OSS浓度和αCDOM(440),保留了ISS和Chl.a浓度,说明该区域水下光照衰减由ISS和Chl.a浓度共同主导,模型精度较高,拟合结果R2为0.883,验证结果MAPE和RMSE分别为15.8%和0.412;表2中模型2为无植物区域的kd(PAR)回归方程,模型先后剔除了OSS浓度、αCDOM(440)和Chl.a浓度,仅保留了ISS浓度,因此,该区域的ISS浓度是水下光照衰减的主导因子,模型精度也比较高,拟合结果R2为0.840,验证结果MAPE和RMSE分别为6.3%和0.636. 图5 植物茂盛区kd(PAR)与无机悬浮物(a)、有机悬浮物(b)、叶绿素a(c)和CDOM吸收系数(d)的线性拟合Fig.5 Linear fitting between kd(PAR)and suspended particulate inorganic matter (a), suspended particulate organic matter (b), chlorophyll-a (c) and CDOM absorption coefficient (d) in submerged plants sparse region 图6 植物稀疏区kd(PAR)与无机悬浮物(a)、有机悬浮物(b)、叶绿素a(c)和CDOM吸收系数(d)的线性拟合Fig.6 Linear fitting between kd(PAR) and suspended particulate inorganic matter (a), suspended particulate organic matter (b), chlorophyll-a (c) and CDOM absorption coefficient (d) in submerged plants lush region 图7 无植物区kd(PAR)与无机悬浮物(a)、有机悬浮物(b)、叶绿素a(c)和CDOM吸收系数(d)的线性拟合Fig.7 Linear fitting between kd(PAR) and suspended particulate inorganic matter (a), suspended particulate organic matter (b), chlorophyll-a (c) and CDOM absorption coefficient (d) in no-plant region 表2 多元线性回归模型验证结果的误差统计 表3记录了采样期间各采样点沉水植物生物量和优势种,根据沉水植物生物量和叶绿素a浓度数据,计算出各采样点草藻干重比,见表4. 采用TSIM方法评价区域富营养化状态,见表5. 总体上讲,东太湖目前处于由草型湖泊向藻型湖泊过渡的阶段,并且湖泊处于富营养水平,相比以前的草型稳态[22],东太湖面临着向藻型稳态转变的趋势. 其中,沉水植物茂盛区草藻干重比大于100,属于草型稳态,区域处于中营养水平;稀疏区草藻干重比在1~100之间,属于草藻共生状态,区域处于富营养水平;无植物区位于行洪通道区域,没有沉水植物分布,属于藻型稳态,处于重富营养水平. 表3 沉水植物生物量和优势种 表4 东太湖各采样点草藻干重比 表5 3种区域富营养化指标值及评价结果 东太湖面积虽小,但本研究发现,不同区域的kd(PAR)存在显著性差异,各采样点均值在1.04~6.35 m-1之间变化. 其中沉水植物分布茂盛的区域kd(PAR)最小,主要是因为沉水植物一方面可以减小波浪的冲刷作用、防止底泥悬浮、降低水体中的悬浮物浓度,另一方面沉水植物能够分泌化感物质抑制藻类的生长,降低Chl.a浓度[23-24]. 采样期间台风对该区域基本没有影响,kd(PAR)变化不明显. 行洪通道区域kd(PAR)最大,区域内没有沉水植物,流速和波浪比较大,水体浑浊. 该区域承接大太湖的流水,水体悬浮物浓度比较高,再加上风浪的扰动,悬浮物沉降较慢,风浪较大时底泥还会悬浮,因此悬浮物浓度最高. 沉水植物相对稀疏的区域基本位于围网拆除区域内部,其中1#点在东山沿岸附近,该区域的kd(PAR)较大. 围网拆除区域的点位会受行洪通道区域的影响,中心区域波浪较大时会向两边传播,虽然沉水植物可以固着底泥,但波浪引起的切应力大于底泥起动应力时就会造成底泥的再悬浮,台风过后可以观察到水体悬浮物浓度明显增加. 虽然kd(PAR)属于表观光学特性,但是主要由固有光学特性决定,尽管它受到入射光场变化的影响,但并不十分敏感[25]. 张运林等[26]通过在不同表面光强下得出的光学衰减系数分析发现,其基本上与表面光强无关,不随光场条件的改变而改变,主要受制于水中的组成物质. 不同湖泊光衰减的主要因素也有区别. van Duin等估算了荷兰20个浅水湖泊中各成分对衰减系数的贡献,发现在大多数湖泊,光衰减主要是由藻类生物量引起的[27]. 美国佛罗里达洲的一个大型富营养化浅水湖泊Apopka湖中,Chl.a对光衰减的贡献率甚至超过50%. Erikson等研究发现Xolotlán湖的水下光照深度主要受Chl.a浓度的调节[28]. 还有一些研究认为悬浮物浓度是影响光衰减的重要因素[29-30]. 然而我们的研究发现,东太湖不同区域的主导衰减因子有所不同. 在沉水植物分布茂盛的区域,光合有效辐射衰减系数模型剔除了所有变量,区域内光衰减系数较小,主要是水体本身对光的吸收和散射. 在沉水植物分布稀疏的区域,ISS和Chl.a浓度较高,二者共同主导了光照的衰减,该区域属于草藻共生状态. 虽然也有沉水植物分布,但是生物量比较小,对底泥和藻类的抑制作用相对减弱,在外力的扰动下容易发生底泥悬浮,释放营养盐,为藻类生长提供营养物质. 以往对太湖的研究表明,水下光照衰减主要由悬浮物引起[11,30],但我们对东太湖沉水植物稀疏区域的研究发现,Chl.a也是影响水下光照衰减的重要因素之一,在生态修复实践中不容忽视. 近几年沉水植物的逐渐减少表明东太湖目前可能接近稳定转变的关键阶段,从大型水生植物主导的清澈状态向浮游植物主导的浑浊状态转变将导致许多浅水湖泊水质持续不良,然而,一旦转变后再恢复大型水生植物主导的清澈状态往往更加困难[9]. 因此需要重点关注此区域,减小波浪对底泥扰动造成的底泥悬浮和营养盐释放,降低湖水中悬浮物和Chl.a浓度. 在无植物区域,ISS浓度要比Chl.a浓度大得多,是影响光衰减的主要因素. 该区域底泥容易再悬浮,在水流的输移作用下泥沙会向植物区输送,进而影响到两侧沉水植物的生长. 3个区域的OSS和CDOM影响都比较小,一方面是因为东太湖OSS和CDOM浓度比较低,悬浮物主要由ISS构成,OSS仅占到总悬浮物的17%,导致引起水下光照衰减的影响无法显现,另一方面CDOM对光的吸收在400 nm以下的紫外短波部分贡献比较高,500 nm以上的光衰减主要来源于悬浮物和Chl.a. 真光层深度是湖泊物理、化学、生物综合作用的关键指标,在湖泊生态修复和水质改善方面发挥着重要作用[31]. 真光层深度与水深的比值可以作为划分是否可恢复沉水植物的标准,比值大于1时,表明水下光照环境可满足沉水植物的生长需求. 根据真光层深度与透明度的关系,在实际测量中可以通过测量湖水透明度来判断区域内沉水植物能否生存. 本文根据计算的真光层深度和测量的透明度数据,建立了回归方程,结果表明在置信区间为95%的水平下,真光层深度和水体透明度呈显著的正线性关系:Deu=2.70SD(R2=0.969,P≤0.0001,n=160). 真光层深度大约是透明度的2.7倍,在实际应用中,可通过测量透明度反算出真光层深度,然后比较真光层深度与水深的大小,当真光层深度≥水深时,表明可以恢复沉水植物. 采样期间东太湖平均水深1.85 m,即将透明度提高到0.7 m以上,就有可能恢复沉水植物,因此当地生态修复工程中可借鉴此数据. 总的来说,东太湖光照衰减的主要因素是ISS和Chl.a,水下光照的分布决定了沉水植物的分布情况. 目前,东太湖正处于从草型湖区到藻型湖区过渡的阶段,尤其在沉水植物稀疏区域,围网拆除后增加的水动力对沉水植物生长造成了不利影响. 另外,该区域长有许多浮叶植物,阻碍了光照在水下的传播,进一步影响了沉水植物的光照需求. 因此,建议可采取围隔等消浪措施减小水动力,防止底泥悬浮,提高水体透明度,同时加强水生植物管理,适度收割浮叶植物,改善水下光照环境,保证沉水植物生长良好,促进湖水水体的良性循环. 鉴于大太湖藻类输入的影响,有关部门需要及时关注和监测东太湖入口处——东茭嘴附近的水质情况,采取相关措施阻止外源性藻类入侵东太湖,削弱藻类与沉水植物的竞争力. 1)东太湖kd(PAR)范围为0.73~11.8 m-1,空间变化规律为:植物茂盛区(1.09 m-1)<植物稀疏区(2.50 m-1)<无植物区(6.19 m-1),对应的真光层深度范围为0.39~6.31 m. 东太湖光学特性空间差异显著. 衰减因子中,ISS和OSS浓度空间差异显著(P<0.05),CDOM吸收系数无显著性差异(P>0.05),沉水植物稀疏区叶绿素a浓度显著高于植物茂盛区(P<0.05),但与无植物区没有显著差异(P>0.05). 沉水植物的分布影响着区域内的水质因子变化. 2)kd(PAR)与ISS、OSS浓度的线性拟合较好,与Chl.a、CDOM拟合较差;沉水植物茂盛区衰减主要是水体本身对光的吸收和散射作用,稀疏区属于草藻共生状态,由Chl.a和ISS共同主导,无植物区域主导衰减因子为ISS,整个区域的OSS和CDOM对光照衰减基本无影响. ISS和Chl.a浓度是影响该区域光照衰减的主要因子. 3)东太湖正处于由草型稳态向藻型稳态过渡的阶段,整个湖泊属于富营养水平,其中沉水植物茂盛区属于草型稳态,处于中营养水平;稀疏区属于草藻共生状态,处于富营养水平;无植物区属于藻型稳态,处于重富营养水平. 4)东太湖真光层深度大约是透明度的2.7倍.1.6 统计分析
2 结果与分析
2.1 光合有效辐射垂向特征
2.2 光学特性与影响因子的空间差异及线性拟合
2.3 不同区域的主导影响因子

2.4 东太湖草藻干重比和区域富营养化评价
3 讨论
4 结论
——以武汉紫阳湖为例

