液态发酵饲料连续发酵工艺
官小凤,刘志云,2,肖 融,2,刘作华,2
液态发酵饲料连续发酵工艺
官小凤1,刘志云1,2,肖 融1,2,刘作华1,2※
(1. 重庆市畜牧科学院,重庆 402460; 2. 农业农村部养猪科学重点实验室,重庆 402460)
为建立一套液态发酵饲料的连续生产工艺,该研究以玉米-豆粕-麦麸混合物为发酵基质进行液态发酵菌株的筛选,通过监测发酵过程中液态饲料的pH值、乳酸菌数量、大肠杆菌数量、霉菌数量、酵母菌数量、酸溶蛋白质含量、可溶性糖含量等指标变化规律探究发酵菌株、连续发酵过程中保留比例、发酵温度、外源苯甲酸和外源酶制剂对发酵进程的调控及饲料营养价值的影响。结果表明:1)筛选出的乳酸菌菌株28-7具有较强的大肠杆菌抑制能力和产乳酸能力,发酵6 h时饲料pH值下降到4.45,发酵饲料中未检出大肠杆菌;2)接种乳酸菌28-7的连续发酵过程中,20%、30%、50%的保留比例对发酵饲料的pH值、乳酸菌数量、霉菌数量的影响差异不大,大肠杆菌均无检出,20%的保留比例可使连续发酵正向进行;3)外源非淀粉多糖酶的加入可显著提高发酵饲料中酸溶蛋白含量、酸溶蛋白/粗蛋白质比值和可溶性糖含量(<0.05),外源苯甲酸的加入可有效抑制发酵过程中霉菌的增殖。4)37 ℃条件下发酵可显著提高饲料中酸溶蛋白含量、酸溶蛋白/粗蛋白质比值(<0.05),3~12 、20 、37 ℃条件下获得的饲料的pH值<4.0、乳酸菌数量大于1010CFU/mL,大肠杆菌、酵母、霉菌未检测出。综上,本研究建立的液态发酵生产工艺为:将乳酸菌28-7(接种量1.0×108CFU/mL)、非淀粉多糖酶(250 g/kg)、苯甲酸(0.1 g/kg)于发酵起始时同时加入,以24 h为发酵周期、20%的保留比例在3~12 (冬季室温)、20 (春秋平均室温)、37 ℃(夏季平均室温)条件下进行生产。该工艺生产所得的液态发酵饲料色泽淡黄,富有温和的酸香味,饲料pH值<4.0,乳酸菌数量>1010CFU/mL,酸溶蛋白含量、酸溶蛋白/粗蛋白质比值均显著提升(<0.05),霉菌、酵母、大肠杆菌无检出,相比春、秋、冬3季,夏季生产更有利于饲料酸溶蛋白含量的提升(<0.05)。
饲料;发酵;工艺优化
0 引 言
中华人民共和国农业农村部公告第194号规定自2020年7月1日起,饲料生产企业将停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料[1]。液态发酵饲料可抑制病原菌增殖、改善畜禽胃肠道健康[2-9],对提高动物生产性能、实现无抗养殖具有重要意义。液态发酵饲料的饲喂效果取决于发酵饲料的pH值、有机酸组成、微生物组成、营养价值、适口性等方面,国外对液态发酵饲料的研究与应用较成熟,Adams等[10]提出监测发酵生产过程中微生物的变化对评价发酵食品的品质具有重要意义。Plumed等[11]发现随着自然发酵时间的延长,酵母易成为优势菌群而影响饲料适口性和干物质含量,自然发酵不是生产优质液态发酵饲料的可靠的方式。添加外源乳酸菌[11]或已发酵成熟产物[5]、弱酸[12]可抑制发酵过程中大肠杆菌、酵母等杂菌的增殖,是引导发酵进程正向进行、提高发酵饲料品质的有效策略。中国对液态发酵饲料的研究起步较晚,现有研究主要集中于饲料营养价值的提升及应用效果评价[13-16]等方面,而关于液态发酵饲料的生产工艺及其发酵过程中微生物及营养物质动态变化的研究较少,加之中国生物饲料行业标准化工作刚起步,缺乏液态发酵饲料品质检测标准,因此,监测、调控发酵进程以保证液态发酵饲料的品质显得尤为重要。
本文以玉米-豆粕-麦麸混合物为发酵基质进行乳酸菌菌株的筛选,通过监测发酵过程中液态饲料的pH值、主要微生物、酸溶蛋白等指标变化规律来探究筛选菌株、保留比例、发酵温度、外源苯甲酸和外源酶对发酵进程的调控及饲料营养价值的影响,以期将饲料生物安全性和营养价值的提升相结合,建立一套液态发酵饲料的连续生产工艺,为液态发酵饲料生产及应用提供参考。
1 材料与方法
1.1 试验材料
试验菌株:乳酸菌28-7、29-3、29-4、29-8、20765为实验室自行分离保存的乳酸菌菌株;乳酸菌CICC20765购于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
非淀粉多糖酶制剂:果胶酶(500 U/mg)、纤维素酶(绿色木霉,50 U/mg)购于上海源叶生物科技有限公司,使用时按比例(实验室数据,未发表)混合。
发酵基料:豆粕,购于重庆新涪食品有限公司;玉米、麦麸购自于重庆汇光饲料厂。玉米(适当粉碎)、豆粕、麦麸按31.5:22:4的比例混合均匀。
主要仪器:HQ-40d便携式pH计,美国哈希;L-8900氨基酸自动分析仪,日本日立;FOSS840自动凯氏定氮仪,丹麦福斯;UVIKON923紫外分光光度计,美国伯乐。
1.2 试验方法
1.2.1 发酵菌株的筛选
称取15 g发酵基料(自然风干)于100 mL三角瓶,加水,按4%(质量分数,下同)的接种量分别加入菌液 28-7、29-3、29-4、29-8、20765后充分混匀,使最终料水比为1:3,37℃恒温发酵24 h。试验以不接种乳酸菌的发酵组为对照(CK),共设置6组,每组2个重复。发酵结束后,测定发酵饲料的pH值,通过目测和鼻嗅评定其感官品质。测定待选菌株对大肠杆菌的抑菌性能,结合菌株对发酵饲料感官品质的影响及抑大肠杆菌性能进行筛选,并对筛选菌株进行产有机酸性能的测定。
1.2.2 连续发酵过程保留量的筛选
将发酵基料、发酵菌液和水加入10 L的发酵罐中,使最终整料水比为1:3,发酵罐内物料的乳酸菌浓度达到1.0×108CFU/mL,200 r/min充分混匀后调整转速为70 r/min,不通空气,于夏季自然温度(33~40 ℃)下发酵。设定每24 h为一个发酵阶段,试验进行4阶段共计96 h,第24、48、72 h时取料,使保留比例分别为50%、30%、20%,再按取料量补充等量的新鲜发酵基料和水,继续进行下一阶段的发酵,测定发酵饲料的pH值和大肠杆菌数量,以选择适宜的留样量。
1.2.3 发酵添加剂的筛选
根据1.2.2的试验结果进行该阶段试验。
将发酵基料、发酵菌液和水加入发酵瓶中,使最终整料水比为1:3,发酵瓶内物料的乳酸菌浓度达到1.0×108CFU/mL,于秋季自然温度(21~28 ℃)下进行连续发酵。试验进行3阶段共计72 h,设置乳酸菌发酵组,乳酸菌+酶发酵组,乳酸菌+苯甲酸发酵组,乳酸菌+酶+苯甲酸发酵组,每组3个重复,具体分组及其处理参照表1。发酵起始(0 h)及每阶段的第4、8、12、24 h,测定饲料中的主要微生物含量、pH值。取出的饲料于55 ℃烘干,测定发酵饲料中的可溶性糖、粗蛋白质、酸溶蛋白质含量,计算酸溶蛋白质/粗蛋白质值。
1.2.4 温度对发酵饲料的影响
将发酵基料、发酵菌液和水加入发酵瓶中,使最终整料水比为1:3,发酵罐内物料的乳酸菌浓度达到1.0×108CFU/mL,分别于冬季自然温度(3~12 ℃)、20 (代表春秋季温度)、37 ℃(代表夏季温度)下进行连续发酵,每个处理3个重复,通过5阶段(120 h)的连续发酵验证不同季节温度下发酵工艺的可行性。发酵起始(0 h)及每阶段结束时,测定饲料中的主要微生物含量及pH值。取出的饲料于55 ℃烘干,测定发酵饲料中的可溶性糖、粗蛋白质、酸溶蛋白质含量,计算酸溶蛋白质/粗蛋白质值。

表1 乳酸菌28-7、酶、苯甲酸不同组合的发酵试验分组及其处理
注:有“+”表示添加相应的试验处理项目,无“+”则表示不添加。
Note: With "+" means add corresponding processing items, without "+" means not add.
1.3 指标测定及方法
发酵饲料技术通则(T/CSWSL 002-2018)中规定,发酵饲料应色泽均一,具弱酸味且气味柔和,无霉变结块,pH值、有效活菌数、酸溶蛋白、粗蛋白质、酸溶蛋白/粗蛋白质等指标应符合相应的产品标准。
pH值:发酵罐内饲料的pH值由发酵罐pH电极自动测定并记录;三角瓶和发酵瓶内饲料的pH值用便携式pH计在饲料充分混匀后测定,每个重复测定3次。
主要微生物含量:发酵饲料充分混匀后稍静置,用无菌移液管吸取饲料上清液于无菌离心管内,每个(重复)饲料上清样不稀释或稀释3个梯度,每个梯度2个平行,用平板倾注法测定饲料中霉菌、酵母、大肠杆菌、乳酸菌数量。霉菌、酵母、大肠杆菌、乳酸菌数量测定范围分为≥0~102、≥102~104、≥104~106、≥106CFU/mL。
乳酸菌抑大肠杆菌性能:以大肠杆菌(猪粪中分离,实验室保存)为指示菌,用牛津杯法测定乳酸菌培养液的上清对大肠杆菌抑菌圈的大小,每个平板3个牛津杯,每株菌重复测定2次。
粗蛋白质含量的测定参照《GB/T 6432-2018》;酸溶蛋白含量的测定参照《GB/T 22492-2008》;有机酸含量的测定参照《GB5009.157-2016》;可溶性糖含量的测定参照蒽酮法。
1.4 数据统计及分析
试验数据采用Excel 2016分析软件进行统计和初步处理,SPSS19.0软件中的One-way ANOVA进行方差分析,图表采用Excel 2016绘制,主要微生物含量用平均值表示,其余结果以平均值±标准差表示。
2 结果与分析
2.1 菌株筛选
相比自然发酵,接种乳酸菌发酵显著降低了饲料的pH值(<0.05),各组饲料pH值均降低到4.0以下,且各组差异不显著(>0.05),改善了饲料感官品质,其中乳酸菌28-7发酵的饲料色泽米黄,具有温和的酸香味(表2)。乳酸菌28-7对大肠杆菌的抑菌圈最大,其直径为(1.25±0.20)cm(表3和图1);在培养36 h时其乳酸、乙酸、丙酸产量分别为14.86、3.39、<0.01g/mg,因此,筛选乳酸菌28-7为本试验液态发酵用菌株。
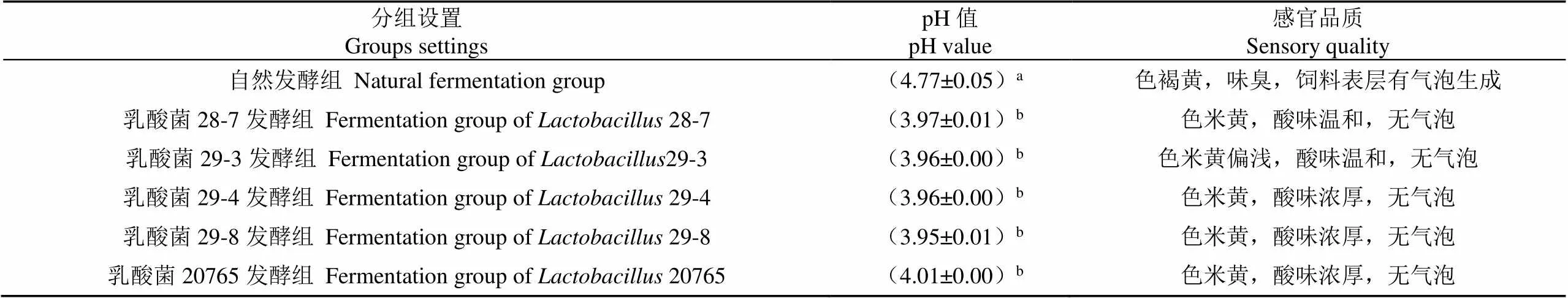
表2 发酵饲料的pH值及其感官品质
注:不同小写字母表示差异显著(<0.05)。
Note: The different superscript letter differ significantly (<0.05).

表3 乳酸菌对大肠杆菌的抑菌圈直径
注:“-”表示无抑菌圈产生。
Note: “-” indicates that there is no bacteriostatic circle.
2.2 连续发酵过程保留比例对发酵效果的影响
由图2和图3可知,0~8 h饲料的pH值快速下降,6 h饲料pH值(4.45)下降到4.5以下,24 h饲料的pH值和乳酸菌数量分别为3.90、4.10×1011CFU/mL。保留比例分别为50%、30%、20%时,补料后饲料pH值分别为3.97、4.64、4.82,发酵结束时饲料的pH值分别3.90、3.78、3.85,乳酸菌数量分别为4.65×1011、5.12×1011、6.03×1011CFU/mL。自24 h后,大肠杆菌无检出,霉菌数量在920~1 100 CFU/mL范围内较稳定存在。

注:0~24 h为第一阶段,保留比例为50%;24~48 h为第二阶段,保留比例为30%;48~72 h为第三阶段,保留比例为20%;72~96 h为第四阶段。

图3 不同保留比例对发酵饲料中主要微生物含量的影响
虽保留比例不一致,但发酵饲料的pH值、乳酸菌数量、霉菌数量变化差异不大,大肠杆菌无检出,故本试验采用20%的保留比例进行后续研究。
2.3 发酵添加剂对发酵效果的影响
乳酸菌28-7、外源酶、外源苯甲酸的不同组合对发酵饲料的pH值和主要微生物的影响见下图4。各阶段发酵结束时饲料中的乳酸菌数量(图4b)均达到1012CFU/mL,pH值(图4a)均小于4.0,且不同处理组饲料的pH值、乳酸菌数量的动态变化几乎一致;饲料中的大肠杆菌数量(图4c)在0~12 h内有一个快速增长和快速下降的过程,12 h后其数量≤200 CFU/mL。未加苯甲酸处理饲料中的酵母菌数量(图4e)在28~60 h内有小幅增加,60~72 h大幅增加,72 h达到106CFU/mL;霉菌数量(图4d)呈波形动态增长,在各阶段发酵结束时达到该阶段内峰值,但均符合GB 13078饲料卫生标准的要求。添加苯甲酸的饲料中的酵母和霉菌数量在0 h有最大值,此后霉菌数量始终≤80 CFU/mL,酵母无检出。可见外源苯甲酸的加入可有效抑制发酵过程中霉菌的增殖。

注:0~24 h为第一阶段,24~48 h为二阶段,48~72 h为第三阶段,下同。
乳酸菌28-7、外源酶、外源苯甲酸的不同组合对对发酵饲料营养价值的影响如图5所示。就3阶段均值而言,发酵饲料中粗蛋白含量(图5d)较0 h无显著变化,酸溶蛋白含量(图5a)、酸溶蛋白/粗蛋白质值(图5b)、可溶糖含量(图5c)较0 h均有显著增加(<0.05),其中加酶组增幅更高,较未加酶组相比达到显著水平(<0.05)。外源酶的加入可显著提升发酵饲料中的酸溶蛋白含量、酸溶蛋白/粗蛋白质比值、可溶性糖含量(<0.05)。
本试验选择菌、酶、苯甲酸3因素进行组合发酵以促进发酵饲料生物安全性和营养价值的提升。
2.4 温度对发酵效果的影响
温度对发酵饲料的pH值和主要微生物的影响见下图6。相比其他温度条件,37 ℃在pH值(图6a)降低和乳酸菌(图6b)增殖方面更具优势,3~12和20 ℃发酵的饲料的pH值、乳酸菌数量的变化趋势几乎一致。所有温度条件下所得饲料的pH值均<4.5,乳酸菌数量均>1.0×1010CFU/mL,大肠杆菌(图6c)、霉菌(图6d)、酵母(<102CFU/mL,未制图)自24 h后无检出,饲料生物安全性获得提高。
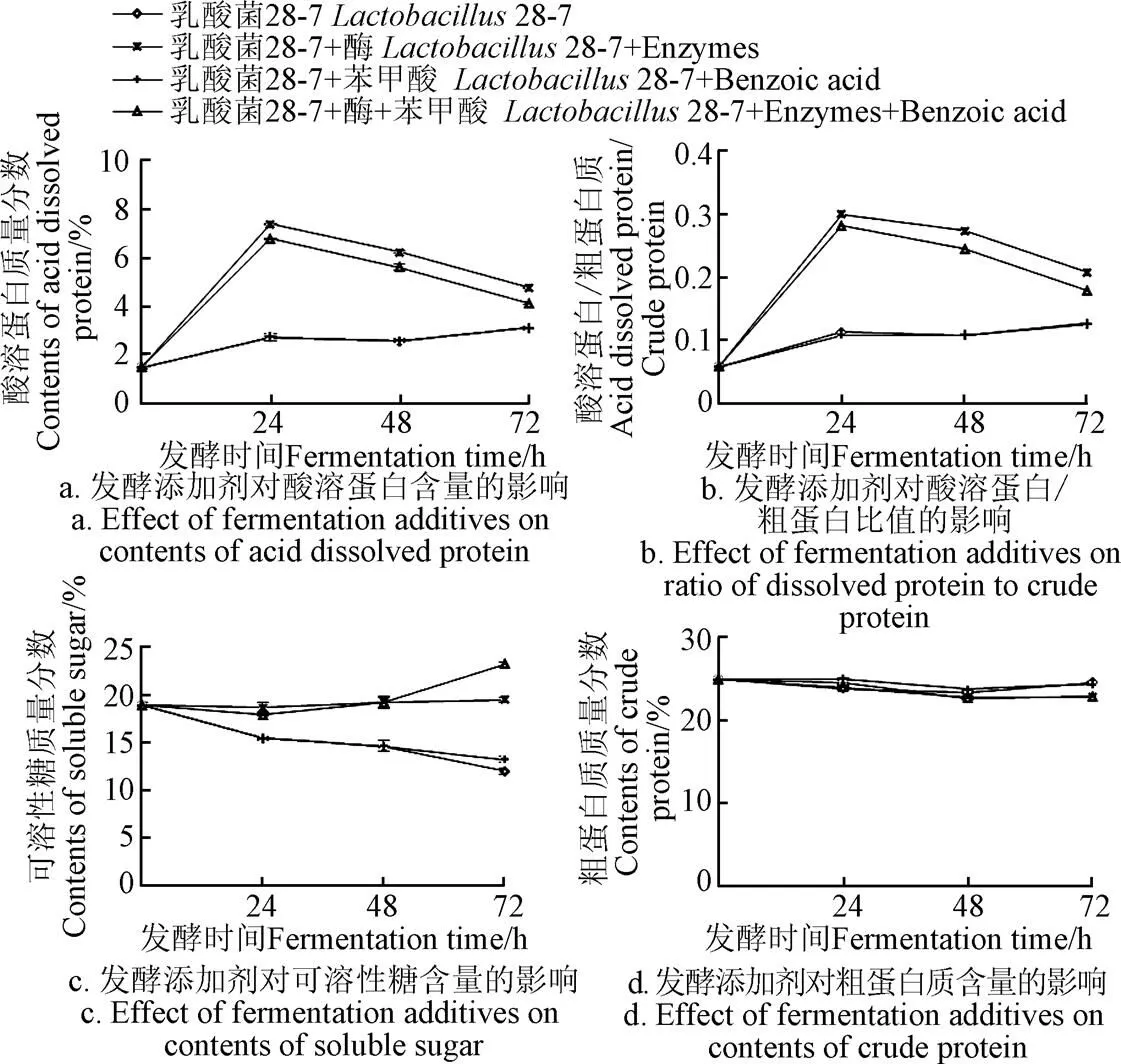
图5 发酵添加剂对发酵饲料的营养价值的影响

注:此处为验证不同季节温度下发酵工艺的可行性,故将3阶段发酵延长为5阶段发酵。其中0~24 h为第一阶段,>24~48 h为第二阶段,>48~72 h为第三阶段,>72~96 h为第四阶段,>96~120 h为第五阶段。延长发酵阶段验证不同季节温度下发酵工艺的可行性,下同。
温度对发酵饲料营养价值的影响如下图7所示。就五阶段均值而言,不同温度条件下的发酵饲料中的可溶糖含量(图7c)、粗蛋白质含量(图7d)与0 h相比无显著差异。各发酵饲料中的酸溶蛋白含量(图7a)、酸溶蛋白/粗蛋白值(图7b)较0h均有显著增加(图7a、7b、7c,<0.05),其中37 ℃较3~12和20 ℃相比达到显著水平(<0.05),3~12和20 ℃相比无显著差异。可见温度的升高有利于饲料中酸溶含量的提高,对粗蛋白质和可溶性糖含量无明显影响。
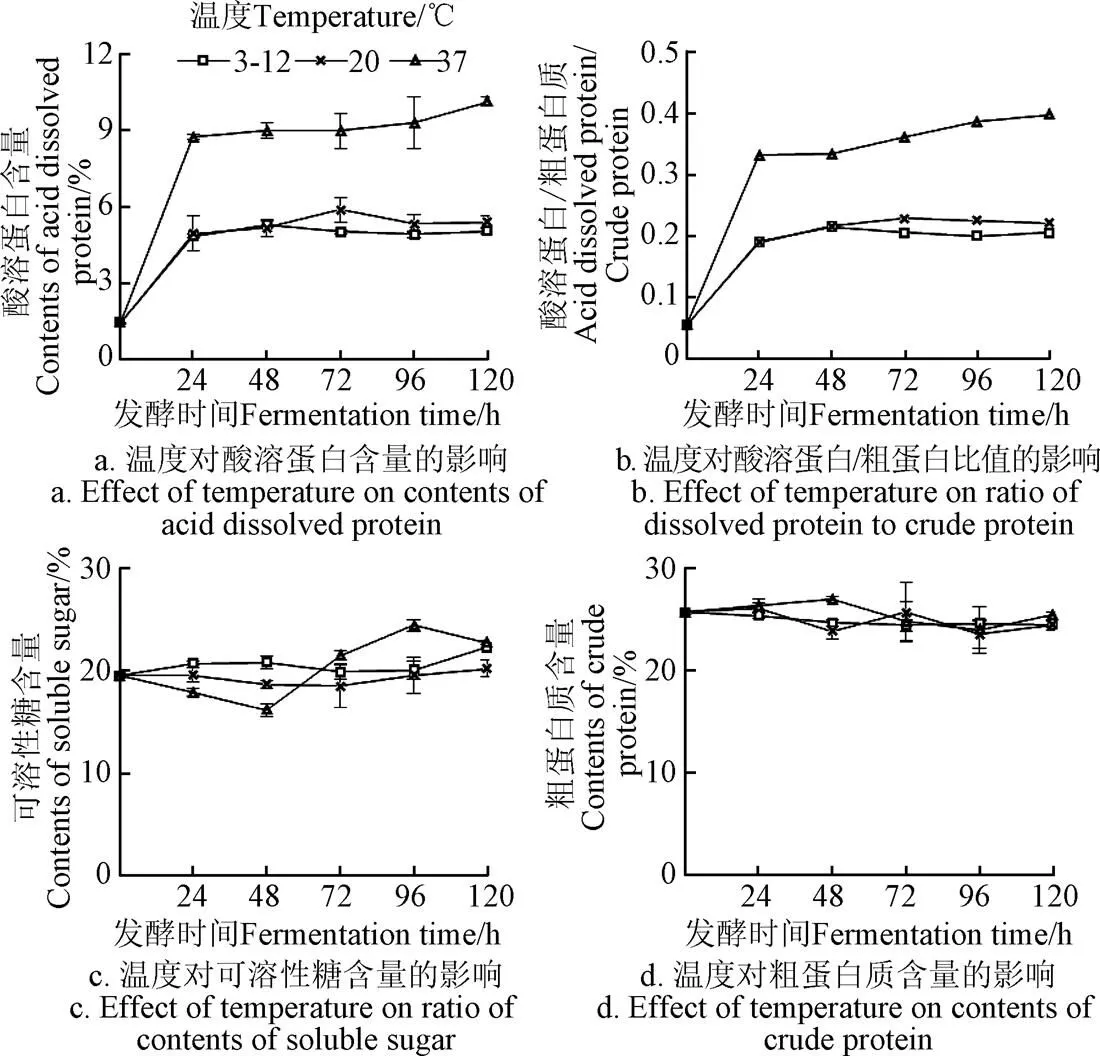
图7 温度对发酵饲料营养价值的影响
3 讨 论
3.1 添加剂对发酵效果的影响
3.1.1 乳酸菌28-7的发酵效果
菌种质量对发酵饲料的品质有直接影响,发酵过程中低pH值(3.5~4.5[17])和高浓度未解离形式的乳酸是抑制肠杆菌等致病菌增殖的重要保障[6,18],也是缓解部分原料发酵后混合新鲜原料和水再发酵时病原菌爆发式增殖的有效策略[2,19]。因此,发酵菌种应具备快速增殖、大量产生乳酸、快速降低发酵基料pH值的特点[20-22]。乳酸菌28-7液态发酵24 h饲料的pH值为3.97、乳酸菌数量达到4.10×1011CFU/mL,这与胡虹等[14,22]利用紫外线诱变后的乳酸菌菌种在最佳条件下发酵所得饲料的pH值和乳酸菌数量相差不多,同时符合Missotten等[3]提出的理想液态发酵饲料的pH值<4.5,乳酸菌活菌数>109CFU/mL的要求。在抑制大肠杆菌方面,乳酸菌28-7相比贾朋辉等[23]试验中使用的专用发酵剂更具优势,这与其能快速产生高浓度乳酸有关,还可能与其能产生某些细菌素类物质有关。此外,研究表明高浓度乳酸有利于提高饲料适口性[6],适量乙酸可协同乳酸抑制病原菌的增殖,但高浓度乙酸会产生“异味”,降低适口性[24]。乳酸菌28-7培养36 h时乳酸、乙酸产量分别14.86、3.39g/mg,乙酸产量低,接种该菌发酵的饲料色泽米黄,具有温和的酸香味。可见,乳酸菌28-7具备提高液态发酵饲料生物安全性及其感官品质的能力。
3.1.2 外源酶的发酵效果
较未加酶组相比,外源酶的加入可进一步提高玉米-豆粕型液态发酵饲料中可溶性糖含量和酸溶蛋白的含量,在酸溶蛋白含量的提升方面与张煜等[25]的研究结果具有一致性。这是因为酶制剂可以破坏植物细胞的胞间层和细胞壁,降解纤维素、淀粉链和蛋白质等大分子物质为单糖、小肽和氨基酸等小分子物质[26]。可溶性糖是发酵系统中乳酸菌等微生物迅速增殖的养分来源,其含量提高一方面可促进微生物发酵的快速启动,另一方面可降低微生物对糖分的消耗,提高饲料甜香味。酸溶蛋白是分子质量在10 KD以下的小肽,包括寡肽和游离氨基酸,现代饲料蛋白质消化理论认为一定的寡肽和游离氨基酸的混合物可以提高动物的消化率[27],这在张煜的试验中也得到了验证。
3.1.3 外源苯甲酸的发酵效果
某些乳酸菌可通过产生乳酸链球菌素、-聚赖氨酸、苯乳酸等物质效抑制腐败类微生物的增殖[28],黄慧福等[29]发现乳酸菌液态发酵可有效抑制霉菌的增殖,在发酵5 d时霉菌无检出。而本文试验结果显示发酵饲料中的霉菌数量并不随pH值的降低和乳酸菌数量的增加而稳定减少,与上述资料存在差异,致使霉菌成为影响饲料生物安全性的主要因素。研究表明有机弱酸[30]或有机酸盐[31]可抑制发酵或青贮过程中霉菌的增殖,Carme Plumed-Ferrer等[12]研究表明液态酸性环境可进一步增强甲酸、山梨甲酸、苯甲酸等弱酸对真菌的抑制作用而不影响乳酸菌的增殖,本文试验结果显示,添加外源苯甲酸的发酵饲料中霉菌和酵母无检出,同时饲料的pH值和乳酸数量的动态变化与未加苯甲酸组无明显差异,这与上述文献描述一致。
3.2 保留量对发酵效果的影响
连续发酵是在发酵罐内保留一定比例的发酵产物作为下一阶段的发酵种子,再混合新鲜的发酵基料和水进行继续发酵的过程,保留比例一般为20%~50%。Moran等[19]研究发现,20%的保留比例相比33%和42%的保留比例在降低饲料的pH值和抑制大肠杆菌增殖方面更具优势,而本文发现50%、30%和20%的保留比例在降低饲料pH值和抑制大肠杆菌方面无明显差异,这与保留饲料中微生物的种类和数量有关系。Moran等人的研究中前期采用较长时间的自然发酵以积累有机酸、降低饲料pH值,Christensen等[32]发现自然发酵时发酵基料的pH值在6~8 h才开始下降,这期间易使发酵原料中天然存在的大肠杆菌等病原菌爆发性增殖而成为优势菌群,并随保留饲料进入下一阶段的发酵体系中。本试验于发酵起始时接种乳酸菌28-7,发酵起始后第6 h时饲料pH值下降到4.45,以20%的保留比例进行连续发酵生产的饲料的pH值和乳酸菌数量分别为3.85、6.03×1011CFU/mL,大肠杆菌无检出。低pH值、富乳酸菌、少病原菌的保留饲料作为下阶段发酵体系中优质的发酵种子,不仅可调控发酵进程持续正向进行,还提高了饲料生产效率
3.3 温度对发酵效果的影响
温度和时间是影响液态发酵饲料品质最大的因素,在一定范围内,随着发酵温度的提升和发酵时间的延长,乳酸的产率和累积量增大,抑制病原菌增殖的效果更好。本试验设置的温度模拟了西南地区的冬季、春秋两季和夏季自然温度,考察了西南地区气候对发酵进程及饲料品质的影响。试验结果显示相比其他温度,37 ℃在提升饲料酸溶蛋白产量方面优势明显,这与酶活和菌株代谢速率相关。研究表明当温度上升至30 ℃时,乳酸产率显著增大[33],为保证乳酸产量及其对饲料品质的影响,生产液态发酵饲料的温度一般不能低于15 ℃[34],而本试验结果显示3~12、20和37 ℃条件下发酵所得饲料的pH值均<4.5,乳酸菌数量均>1.0×1010CFU/mL,达到优质液态发酵饲料的要求,同时饲料中大肠杆菌、霉菌、酵母自24 h后无检出。因此,本试验所建立的液态发酵工艺可不受西南地区气候影响以保证液态发酵饲料的适口性和生物安全性。
4 结 论
1)本研究筛选出了一株适用于液态连续发酵的乳酸菌菌株28-7,该菌具有较强产乳酸和抑制大肠杆菌增殖能力。
2)建立了一套液态发酵饲料连续发酵工艺:将乳酸菌28-7(接种量1.0×108CFU/mL)、非淀粉多糖酶剂(250 g/kg)、苯甲酸(0.1 g/kg)于发酵起始时同时加入,以24 h为发酵周期,以20%的保留比例进入下一发酵周期,在后续各阶段起始时补充加入非淀粉多糖酶制剂及苯甲酸进行连续发酵。
3)该工艺可在冬季(3~12 ℃)、春秋两季(20 ℃)、夏季(37 ℃)温度下进行,所得液态发酵饲料色泽淡黄,富有温和的酸香味;饲料的pH值低于4.0,乳酸菌数量达到1010CFU/mL,同时霉菌、酵母、大肠杆菌无检出;酸溶蛋白含量、酸溶蛋白/粗蛋白比值显著提升(<0.05)。其中夏季(37 ℃)发酵更有利于饲料酸溶蛋白含量的提升。
[1] 中华人民共和国农业农村部. 法规司. 法律法规:中华人民共和国农业农村部公告第194号[Z]. 2019-07-09. http://www.fgs.moa.gov.cn/flfg/202002/t20200217_6337167.htm.
[2] 官小凤,刘志云,黄金秀,等. 液态发酵饲料在养猪生产上的应用[J]. 动物营养学报,2018,30(11):4312-4319.
Guan Xiaofeng, Liu Zhiyun, Huang Jinxiu, et al. Application of fermented liquid feed in pig production[J]. Chinese Journal of Animal Nutrition, 2018, 30(11): 4312-4319. (in Chinese with English abstract)
[3] Missotten J A, Michiels J, Degroote J, et al. Permented liquid feed for pigs: an ancient technique for the future[J]. Journal of the Science and BioTechnology, 2015, 6(1): 4.
[4] Jakobsen G V, Jensen B B, Knudsen K E B, et al. Improving the nutritional value of rapeseed cake and wheat dried distillers grains with solubles by addition of enzymes during liquid fermentation[J]. Animal Feed Science and Technology, 2015, 208: 198-213.
[5] Canibe N, Kristensen N B, Jensen B B, et al. Impact of silage additives on aerobic stability and characteristics of high-moisture maize during exposure to air, and on fermented liquid feed[J]. Journal of Applied Microbiology, 2014, 116(4): 747-760.
[6] Canibe N, Jensen B B. Fermented liquid feed-microbial and nutritional aspects and impact on enteric diseases in pigs[J]. Animal Feed Science and Technology, 2012, 173(1/2): 17-40.
[7] 刘宇,王爽,李阳,等. 液态发酵饲料及其对猪肠道菌群和生长性能影响的研究进展[J]. 猪业科学,2016,33(10):50-52.
[8] 许镨文,李元晓,庞有志. 液体发酵饲料对断奶仔猪肠道健康的影响[J]. 动物营养学报,2011,23(12):2105-2108.
Xu Puwen, Li Yuanxiao, Pang Youzhi. Fermented liquid feed: Effects on weaner piglet intestinal health[J]. Chinese Journal of Animal Nutrition, 2011, 23(12): 2105-2108. (in Chinese with English abstract)
[9] 韦良开,郑斌,王海辉,等. 液体发酵饲料在猪业养殖中的应用研究[J].饲料研究,2019,42(5):122-125.
Wei Liangkai, Zheng Bin, Wang Haihui, et al. Research and application of fermented liquid feed in pig production[J]. Feed Research, 2019, 42(5): 122-125. (in Chinese with English abstract)
[10] Adams M, Mitchell R. Fermentation and pathogen control: A risk assessment approach[J]. International Journal of Food Microbiology, 2002, 79(1): 75-83.
[11] Plumed Ferrer C, Von Wright A. Fermented pig liquid feed: Nutritional, safety and regulatory aspects[J]. Journal of Applied Microbiology, 2009, 106(2): 351-368.
[12] Plumed-Ferrer C, Von Wright A. Antimicrobial activity of weak acids in liquid feed fermentations, and its effects on yeasts and lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2011, 91(6): 1032-1040.
[13] 欧维金,吕玉金,王泽仁.发酵液态饲料对断奶仔猪生产性能的影响[J]. 现代牧业,2019,3(2):12-16.
Ou Weijin, Lu Yujin, Wang Zeren. Effects of fermented liquid feed on the performance of weaner piglets[J]. Modern Animal Husbandry, 2019, 3(2): 12-16. (in Chinese with English abstract)
[14] 胡虹,张秀江,权淑静,等. 植物乳杆菌液体发酵仔猪全价饲料的试验研究[J]. 饲料研究,2019,42(8):55-59.
Hu Hong, Zhang Xiujiang, Quan Shujing, et al. Research of fermenting liquid complete feed for piglets byplantarum[J]. Feed Research, 2019, 42(8): 55-59. (in Chinese with English abstract)
[15] 陈鲜鑫,王金全,刘震坤,等. 玉米乳杆菌发酵液体饲料对断奶仔猪生产性能、养分消化率(全收粪法)和血清生化免疫指标的影响[J]. 饲料研究,2017(5):5-9.
[16] 李永明,徐子伟,李芳,等. 发酵谷物液体饲料对超早期断奶仔猪生长性能和肠道微生物菌群多样性的影响[J]. 动物营养学报,2010,22(6):1650-1657.
Li Yongming, Xu Ziwei, Li Fang, et al. Effects of fermented liquid cereal grain feed on growth performance and intestinal microbial flora diversity of early-weaned piglets[J]. Chinese Journal of Animal Nutrition, 2010, 22(6): 1650-1657. (in Chinese with English abstract)
[17] Plumed-Ferrer C, Kivela I, Hyvonen P, et al. Survival, growth and persistence under farm conditions of aplantarum strain inoculated into liquid pig feed[J]. 2005, 99: 851-858.
[18] Missotten J A M, Michiels J, Ovyn A, et al. Fermented liquid feed for pigs[J]. Archives of Animal Nutrition, 2010, 64(6): 437-466.
[19] Moran C A, Scholten R H J, Tricarico J M, et al. Fermentation of wheat: effects of backslopping different proportions of pre-fermented wheat on the microbial and chemical composition[J]. Archives of Animal Nutrition, 2006, 60(2): 158-169.
[20] Missotten J A M, Goris J, Michiels J, et al. Screening of isolated lactic acid bacteria as potential beneficial strains for fermented liquid pig feed production[J]. Animal Feed Science and Technology, 2009, 150(1/2): 122-138.
[21] Missotten J A M, Michiels J, Goris J, et al. Screening of two probiotic products for use in fermented liquid feed[J]. Livestock Science, 2007, 108(1/2/3): 232-235.
[22] 胡虹,杜迅,张秀江,等. 液体发酵饲料植物乳杆菌诱变育种的研究[J]. 河南科学,2019,37(4):570-574.
Hu Hong, Du Xun, Zhang Xiujiang, et al. Mutagenic breeding ofplantarum in liquid fermented feed[J]. Henan Science, 2019, 37(4): 570-574. (in Chinese with English abstract)
[23] 贾朋辉,郭洪新,李国军,等.微生态发酵饲料菌群变化及其应用[J]. 饲料博览,2009(3):24-27.
[24] Brooks P H, Beal J D, Niven S. Liquid feeding of pigs: Potential for reducing environmental impact and for improving productivity and food safety[J]. Recent Advance in Animal nutrition in Austalia, 2001, 13: 49-63.
[25] 张煜,石常友,王成,等. 菌酶协同发酵改善玉米-豆粕型饲料营养价值的研究[J]. 中国粮油学报,2018,33(3):70-77.
Zhang Yu, Shi Changyou, Wang Cheng, et al. Improving nutrition value of maize-soybean meal based diet by microbial fermentation combined with multiple-enzymes[J]. Journal of the Chinese Cereals and Oils Association, 2018, 33(3): 70-77. (in Chinese with English abstract)
[26] 许毅,周岩民,王恬,等. 酶制剂在玉米-豆粕型日粮中的应用[J]. 中国饲料,2004(8):21-23.
[27] 王婧瑶. 高蛋白酶解及抗营养因子降解菌株的诱变选育[D]. 哈尔滨:东北农业大学,2013.
Wang Jingyao. The Mutation Breeding of the Strain of High Protease Activity and Reducing the Anti-nutritional Factors[D]. Harbin: Northeast Agricultural University, 2013. (in Chinese with English abstract)
[28] Dhundale V, Hemke V, Desai D, et al. Evaluation and exploration of lactic acid bacteria for preservation and extending the shelf life of fruit[J]. International Journal of Fruit Science, 2018, 18(4): 355-368.
[29] 黄慧福,肖玉雪. 乳酸菌发酵对富源酸菜品质及安全性的影响[J]. 食品与机械,2019,35(5):191-194.
Huang Huifu, Xiao Yuxue. Effect of lactic acid bacteria fermentation on quality and safety of fuyuan sauerkraut[J]. Food and Machinery, 2019, 35(5): 191-194. (in Chinese with English abstract)
[30] 尉小强,罗仕伟,哈志刚,等. 添加乳酸菌和有机酸制剂对全株玉米青贮品质、微生物数量和有氧稳定性的影响[J].草学,2018(S1):63-68.
Wei Xiaoqiang, Luo Shiwei, Ha Zhigang, et al. The effect on fermentation quality, microbe quantity and aerobic stability of whole-plant corn by adding lactic acid bacteria and organic acid preparations[J]. Journal of Grassland and Forage Science, 2018(S1): 63-68. (in Chinese with English abstract)
[31] 李晓红,罗红霞,句荣辉,等. 有机酸盐在青贮乳酸发酵中的抑菌效果研究[J]. 安徽农业大学学报,2018,45(3):416-421.
[32] Christensen P, Glitsø V, Pettersson D, et al. Fibre degrading enzymes andplantarum influence liquid feed characteristics and the solubility of fibre components and dry matter in vitro[J]. Livestock Science, 2007, 109(1/2/3): 100-103.
[33] Beal J D, Niven A S J, Campbell A. et al. The effect of temperature on the growth and persistence ofin fermented liquid pig feed[J]. International Journal of Food Microbiology, 2002, 79(1/2): 99-104.
[34] Jensen B B, Mikkelsen L L. Feeding liquid diets to pigs[M]// Wiseman J. Rcent Developments in Pig Nutrition. Nottingman: Nottingman University Press, 1998: 107-126.
Continuous fermentation process of fermented liquid feed
Guan Xiaofeng1, Liu Zhiyun1,2, Xiao Rong1,2, Liu Zuohua1,2※
(1.,402460,; 2.,402460,)
This study aims to evaluate the effects of fermentation strain, retention ratio, fermentation temperature, exogenous benzoic acid, and exogenous enzyme preparation on fermentation process and the nutritional value of feeds, by means of monitoring the variations invarious indicators of liquid feed during fermentation, including the pH, the numbers of Lacticacid(LAB),(), mold, and yeast, acid-soluble protein content, and soluble sugar content. The experiment was performed using a corn-soybean-wheat bran mixture as the fermentation substrate, to select strains for producing liquid fermented feed. The results show that: 1) The selected LAB28-7 has strong ability in inhibitingand producing lactic acid. The pH value of feed dropped to 4.45 after 6 hours of fermentation, and thecannot be detected. 2) During the continuous fermentation with theLABstrain28-7, little difference showed in the effects on the pH or the numbers of LAB and mold in the fermented feed with retention ratio at 20%, 30% or 50%, and thewas not detected. Therefore, the retention ratio of 20% can ensure a good fermentation. 3) The addition of exogenous non-starch polysaccharide enzyme can significantly increase the acid-soluble protein content, acid-soluble protein/crude protein ratio, and soluble sugar content in the fermented feed (<0.05). The addition of exogenous benzoic acid can effectively inhibit moldmultiplication. 4) The acid-soluble protein and the acid-soluble protein/crude protein ratio significantly increased (<0.05) with the fermentation at 37℃. The pH values of feed at 3-12, 20, and 37 ℃ were less than 4.0. The LAB number was more than 1010CFU/mL. The, yeastand mold were not detected. The liquid fermentation technique was established in this study:(inoculation amount 1.0×108CFU/mL), non-starch polysaccharide enzyme (250 g/kg), and benzoic acid (0.1 g/kg) were simultaneously added at the beginning of fermentation. The production was proceeded with the fermentation period of 24 h, the retention ratio of 20%, and temperature at 3-12 ℃ (room temperature in winter), 20 ℃ (average room temperature in spring and autumn), and 37 ℃ (average room temperature in summer). The liquid fermented feed produced inthis process was light yellow in color, and rich in mild sour flavor; the pH value of feed was less than 4.0; the LAB number was more than 1010CFU/mL; the content of acid-soluble protein and the ratio of acid soluble protein to crude protein significantly increased (<0.05). The mold, yeast andwere not detected. Compared with spring, autumn and winter, the acid-soluble protein content can be more easily increased in summer production (<0.05).
feed; fermentation; process optimization
官小凤,刘志云,肖融,等. 液态发酵饲料连续发酵工艺[J]. 农业工程学报,2020,36(21):300-307. doi:10.11975/j.issn.1002-6819.2020.21.036 http://www.tcsae.org
Guan Xiaofeng, Liu Zhiyun, Xiao Rong, et al. Continuous fermentation process of fermented liquid feed[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(21): 300-307. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.21.036 http://www.tcsae.org
2020-06-15
2020-10-11
重庆荣昌农牧高新技术产业研发专项(19254);国家重点研发计划项目(2018YFD0500600)
官小凤,从事生物饲料研发与应用研究。Email:13627609867@qq.com
刘作华,研究员,从事生物饲料研发与机理研究。Email:liuzuohua66@163.com
10.11975/j.issn.1002-6819.2020.21.036
S825.5
A
1002-6819(2020)-21-0300-08

