胶州湾海水痕量金属-溶解有机质分配特征及其影响因素探讨
泮枫敏,袁华茂,4*,宋金明,4*,李学刚,4,李宁,4,段丽琴,4,邢建伟,4
( 1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071;2. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;3. 中国科学院大学,北京 100049;4. 中国科学院海洋大科学研究中心,山东 青岛 266071)
1 引言
溶解有机质是海水中痕量金属的主要载体,不仅可以与痕量金属进行多种形式的配合或吸附,还可以影响痕量金属与其他颗粒物之间的相互作用,改变痕量金属的形态和溶解度,从而影响痕量金属在水相与沉积相之间的分配及其迁移转化过程[1]。痕量金属在溶解有机质中的赋存情况极其复杂,其迁移性和生物可利用性等都强烈依赖于它们在不同分子量溶解有机质中的分配及相互作用[2]。高分子量的金属-有机配合物更易发生絮凝沉淀而进入沉积相,从而降低痕量金属的迁移性[3]。与低分子量亲脂性溶解有机质配合的痕量金属可以通过被动扩散直接运输到海洋生物体内被利用[4],高分子量有机质的配合作用则通常会降低痕量金属的生物可利用性[5]。因此,深入研究海水痕量金属在不同分子量溶解有机质中的分配特征及其机理与影响因素,对于了解痕量金属的生物地球化学行为,评估其生物可利用性和毒性效应均具有十分重要的意义。
胶州湾位于山东半岛南部,是一个典型的半封闭型海湾,也是我国重要的渔业及养殖业基地。近年来,随着社会经济高度发展,大量痕量金属及有机污染物经河流径流、人类活动等途径进入胶州湾,自然变化与人为干扰共同作用下的海洋生态环境变化值得关注[6]。目前,胶州湾海水痕量金属的研究多集中于元素总量及空间分布,而针对海水痕量金属-溶解有机质分配特征及规律的研究却未见报道。本文对胶州湾海水中不同分子量的溶解有机质及其所配合的痕量金属进行分级提取,探讨了痕量金属在不同分子量溶解有机质中的分配特征及调控机理,并探讨了痕量金属-溶解有机质分配的影响因素。
2 材料与方法
2.1 样品采集与预处理
于2019 年9 月随“创新号”科考船在胶州湾采集表层(2 m)及底层(离底2 m)海水样品,调查站位如图1 所示,其中水深小于5.0 m 的S2 和S3 站位仅采集表层水样。按照《海洋监测规范》要求,痕量金属样品采集过程中严格避免接触金属器具、容器,全部采用预先清洗过的塑料容器。样品以船载CTD 采集后立刻装入高密度聚乙烯样品桶内并即刻以封口膜进一步密封桶口以避免污染,运回实验室后尽快以0.45 μm 醋酸纤维素膜过滤除去颗粒物,滤液于4℃下冷藏待用,一部分用于测定总溶解态痕量金属,另一部分用于进一步的超滤分级实验。另取适量海水样品以0.45 μm 醋酸纤维素膜过滤,以N、N-二甲基甲酰胺萃取滤膜上的叶绿素并利用荧光分光光度计(F-4600,Hitachi)测定叶绿素a 浓度。
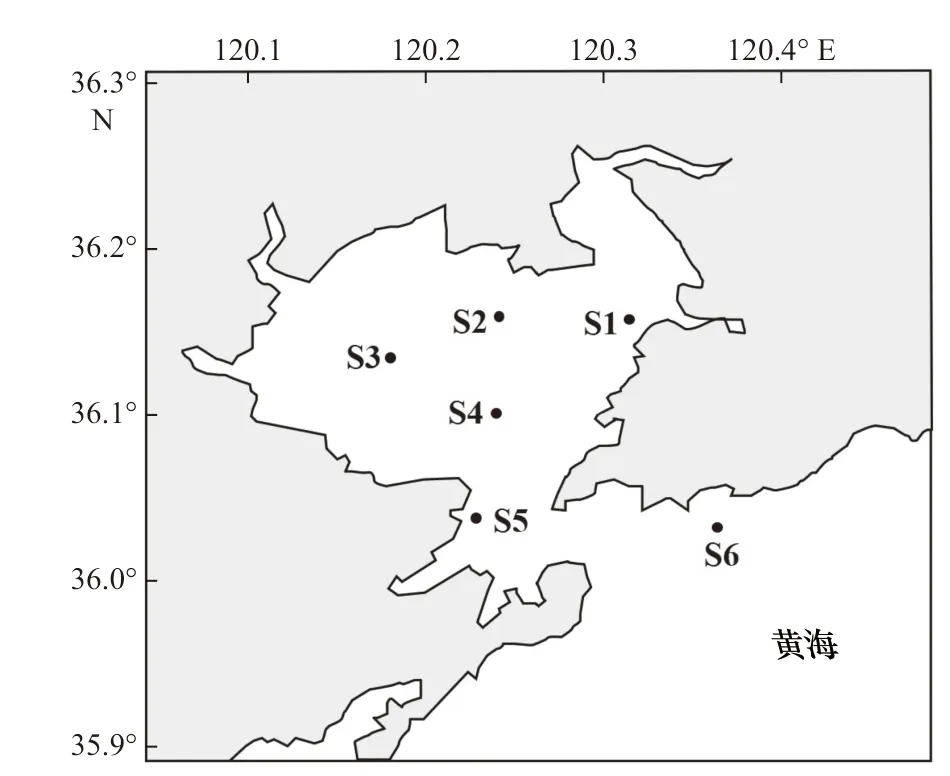
图1 胶州湾采样站位Fig. 1 Locations of the sampling stations in the Jiaozhou Bay
2.2 不同分子量溶解有机质及其所配合痕量金属的分离、提取与检测
不同分子量痕量金属有机配合物的分离利用搅拌式加压超滤装置(UFSC40001,Millipore)完成。取以0.45 μm 滤膜过滤后的海水样品,依次通过10 kDa、3 kDa 及1 kDa 的超滤膜(Millipore),不同级分痕量金属有机配合物的分子量以所用滤膜孔径界定(如以0.45 μm 滤膜过滤则滤液中配合物的分子量表示为<0.45 μm)。各滤膜取下后置于高密度聚乙烯烧杯中密封保存,<1 kDa 滤液置于氟化低密度聚乙烯样品瓶中在4℃下保存,分别测定滤膜与滤液中的痕量金属含量,以其总值代表总溶解态痕量金属浓度。此外,在超滤过程中留取各级滤液,于4℃下避光冷藏保存并尽快以总有机碳分析仪(Vario EL,Elementar)测定溶解有机碳浓度。以紫外-可见分光光度计(T6,Persee)测定溶解有机质紫外-可见吸收特征参数,波长范围为250~700 nm,每隔1 nm读取一次吸光度,根据所得吸光度计算样品在275~295 nm 波长范围内的曲线斜率(S275-295)以分析溶解有机质来源及组成特征,以250 nm 与365 nm 下吸光度的比值(E2∶E3)分析溶解有机质的芳构化程度。以荧光分光光度计测定溶解有机质荧光特性,激发波长范围为200~500 nm,发射波长范围为250~600 nm,根据测得荧光峰的位置分析溶解有机质的组分、官能团结构及离子配合能力。
超滤膜上痕量金属以5% HNO3(痕量级,Merck)作为提取剂采用超声浸提法进行[7–8],提取前首先利用紫外灯(BFDUV-X800W230,博飞达)照射滤膜4 h(800 W)以破坏痕量金属与有机质的结合[9–10],连续进行3 次分别历时30 min、10 min 及10 min 的超声振荡(40 kHz,240 W),并在每次超声振荡前更换提取液(10 mL,5% HNO3)。超声结束后合并提取液,以4 500 r/min离心5 min(ST 40R,Thermo Scientific),取上清液以电感耦合等离子体质谱仪(ICP-MS,ICAP Q,Thermo Scientific)检测其痕量金属含量。以相同体积milli-Q 水过空白超滤膜,采用同样浸提方法作为样品空白。
<1 kDa 及<0.45 μm 滤液中的痕量金属采用固相微萃取法进行富集[11],所用萃取剂为Chelex-100 螯合树脂(分析纯,Bio-rad)。树脂在使用前首先以1 mol/L HNO3(痕量级,Merck)浸泡活化48 h,再以微升枪头填充至树脂柱内待用。滤液在富集前同样进行紫外消解以破坏痕量金属与有机质间的结合,并以NH4Ac溶液(优级纯,Thermofisher)调节pH 至5.5 左右待用。以1 mol/L HNO3冲洗树脂20 min 以使其进一步活化,流速设置为0.5 mL/min。之后排空管路中的HNO3溶液,以0.5 mol/L NH4Ac 冲洗树脂5 min,使其表面附满NH4+,以利于样品溶液中痕量金属的吸附。排空管路中多余的NH4Ac 溶液,再使样品溶液以0.5 mL/min的流速缓慢通过树脂柱,将痕量金属吸附于螯合树脂上。待样品全部通过后,以0.5 mol/L NH4Ac 冲洗树脂柱以除去多余杂质,最后利用N2反向加压,以5 mL 1 mol/L HNO3洗脱富集在树脂上的金属离子,洗脱液直接以ICP-MS 进行痕量金属测定。样品空白同样以Milli-Q 水代替滤液经固相萃取测定。经CASS-6标准海水(加拿大国家研究委员会)验证,该方法的回收率为87%~113%。痕量金属测定方法的检出限定义为样品空白平均值(n=3)加3 倍标准偏差(GB/T 27417—2017),超滤膜上痕量金属的方法检出限为0.01(Cd)~0.1(Cr)μg/L,海水痕量金属的方法检出限为0.002(Cd)~0.02(Cr、Cu、Ni)μg/L。各级超滤膜与海水痕量金属检测方法的精密度采用平行样品(n=3)评估,结果的相对标准偏差均小于5%,方法重现性较好。此外,通过比较超滤膜及<1 kDa 滤液中痕量金属浓度的加和值与未分级溶解态痕量金属的测定值,计算得到超滤-超声浸提/固相微萃取法分离痕量金属的回收率为76%~93%,说明该方法分离效果较好,分离过程中痕量金属损失及污染较小。
为保证结果的准确性,实验过程中严格避免污染。超滤装置各组件在使用前依次以5 mmol/L Na2EDTA(优级纯,国药)、超纯水、0.05 mol/L NaOH(优级纯,国药)、超纯水及0.02 mol/L HNO3(痕量级,Merck)分别浸泡24 h 以上并以超纯水充分洗净,富集装置各组件及其他所有塑料容器以5% HNO3(痕量级,Merck)浸泡7 d 并以超纯水充分洗净,滤膜在使用前以5%HNO3(痕量级,Merck)浸泡24 h 并以超纯水充分洗净,总有机碳分析仪进样管在使用前以超纯水充分洗净并于450℃下灼烧6 h 以去除有机污染物。此外,在痕量金属提取测定及溶解有机碳、紫外-可见吸收特性、荧光特性测定过程中均添加空白样品以扣除仪器、试剂等对实验结果造成的影响。样品的吸光度值还应减去683~687 nm 的平均吸光度以去除仪器基线漂移与散射的影响,荧光强度值应减去超纯水荧光强度值以去除拉曼散射的影响。
3 结果与讨论
3.1 胶州湾海水痕量金属的空间分布
总体而言,胶州湾海水痕量金属具有近岸浓度较高的分布特点,多在湾内东北部出现高值区(表1),显示出陆源输入的显著影响。胶州湾东北部靠近李村河、娄山河等河口,受人类活动影响明显,大量污染物随工业污水和生活废水排入湾内。此外,胶州湾东北部水域水流交换相对缓慢,不利于污染物的扩散[12],进一步导致痕量金属高值区的出现。
胶州湾表层海水中Cu 的浓度为1.59~4.81 μg/L,平均值为2.88 μg/L,高浓度主要集中在受人类活动影响剧烈的河口及港口邻近海域。Cr 的浓度为0.7~1.4 μg/L,平均值为1.0 μg/L,整体浓度较低且分布相对均匀,湾东北部河口与北部红岛临近海域出现高值区。Cr 的污染主要来自于工业废水,沿岸陆地工业生产所排出的铬化合物是主要的污染源[12]。Cd 的浓度为0.04~0.40 μg/L,平均值为0.02 μg/L,在东北部河口及湾口附近海域出现高值区。东北部陆地岩石风化及工业生产累积的Cd 随河流汇入湾内,湾口处青岛港油港也是Cd 的一大来源,装卸及运输过程中进入水体中的原油会带来Cd 的污染[13]。Pb 的浓度为0.84~2.64 μg/L,平均值为1.77 μg/L,除东北部外,胶州湾中部也出现Pb 的高值区。Ni 的浓度为0.31~1.53 μg/L,平均值为0.77 μg/L;Co 的浓度为0.75~2.01 μg/L,平均值为1.37 μg/L,高值区均出现于近岸水域。
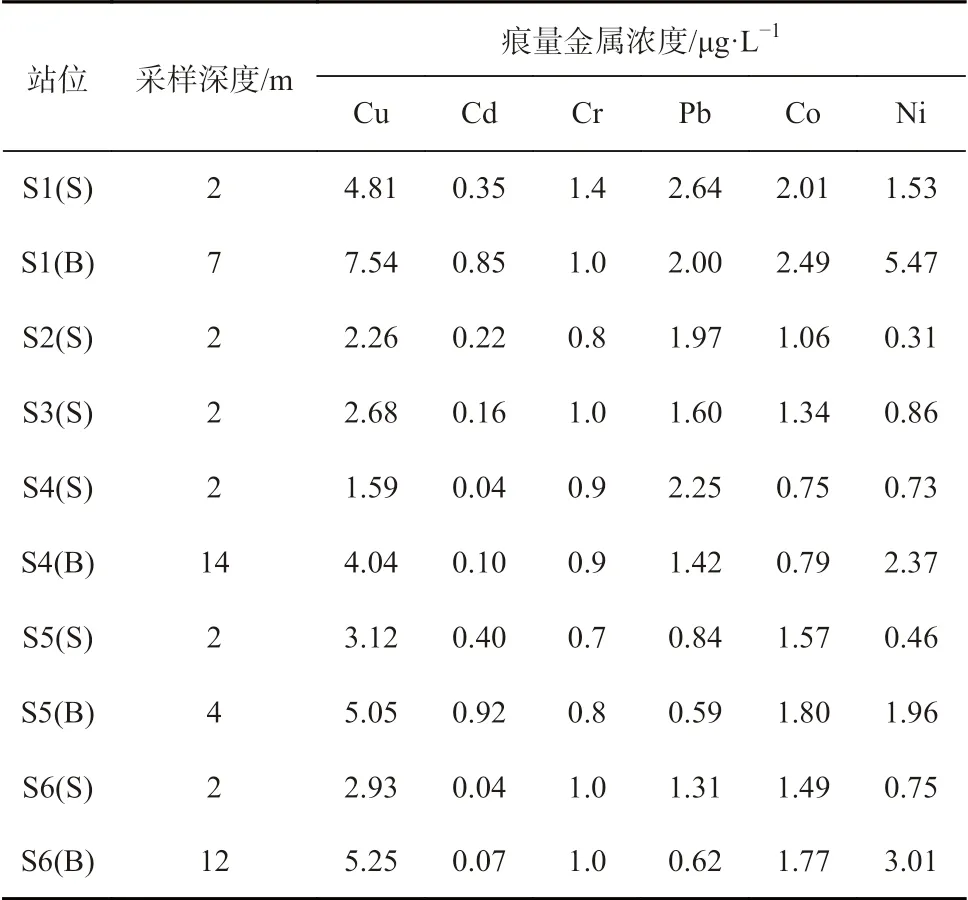
表1 胶州湾海水中痕量金属浓度Table 1 Concentrations of trace metals in seawater of the Jiaozhou Bay
与表层海水相比,胶州湾底层海水中Cu(4.04~7.54 μg/L,t-test,p<0.01)、Ni(1.96 ~5.47 μg/L,t-test,p<0.05)和Co(0.79~2.49 μg/L,t-test,p<0.05)的浓度明显更高,Pb(0.59~2.00 μg/L,t-test,p<0.05)则呈现出表层海水含量高于底层海水的趋势,不同深度海水中Cd(0.07~0.10 μg/L,t-test,p>0.05)和Cr(0.8~1.0 μg/L,t-test,p>0.05)的浓度无显著性差异。表层海水中浮游植物的吸收利用是导致其Cu、Ni 和Co 浓度较低的重要原因,表层痕量金属的垂直迁移及潮流、风浪、船舶运输和生物扰动等作用下沉积物的再悬浮则会导致底层海水中痕量金属浓度升高[14]。在纳拉甘塞特湾采集沉积物进行再悬浮模拟实验,结果显示Cd 和Pb 向水体中的释放量较小,Cu 和Zn 则在再悬浮过程中被明显从沉积物中释放出来[15]。对泉州湾沉积物及悬浮颗粒物中痕量金属的研究表明,二者之间的含量变化相对应,涨潮期间水体中金属浓度的迅速增加归因于沉积物的释放[16]。在珠江三角洲入海口的研究也发现,沉积物在潮流剪切力作用下的再悬浮会使得水体中Zn 和Cd 的浓度明显增加[17]。表层海水中较高浓度的Pb 归因于大气悬浮颗粒物沉降而引起的Pb 输入,有研究显示含铅汽油燃烧所导致的大气沉降输入与工业废水排放Pb 的输送通量是相当的[12]。胶州湾底层海水中Cu、Cd、Ni 和Co 的浓度水平分布与表层海水基本一致,多在湾内东北部及湾口处出现高值区,湾中部与湾外浓度较低。Cr 在底层水体中分布较为均匀,除湾口处浓度相对较低之外,其余站位浓度基本相近。Pb 在底层水体中的分布也与表层海水中相似,高值区出现于湾内东北部及湾中部,湾口与湾外水体中浓度相对较低。
与之前胶州湾海水中痕量金属的研究相比(表2),本研究所获痕量金属的平均浓度略有升高,但变化幅度较小,整体污染水平较低,其中Cu、Cd、Cr、Ni 浓度均低于国家一类海水水质标准(GB 3097—1997)。与国内其他海湾相比,胶州湾海水中的Cu 和Cd 浓度均高于大亚湾和钦州湾,Cr 和Pb 浓度则低于后者,渤海(渤海湾与莱州湾)中Cu、Cd、Pb、Co、Ni 的浓度均低于胶州湾。胶州湾表层海水中的Cu、Cd、Pb、Co 浓度均明显高于美国旧金山湾,Ni 浓度则低于后者。北黄海表层海水中的Cu 和Pb 浓度低于胶州湾海水,Cd 浓度则明显高于胶州湾。西太平洋表层海水中的痕量金属浓度均明显低于胶州湾海水,Cu、Co、Ni 浓度也低于旧金山湾和北黄海,Cd 浓度低于北黄海,但与旧金山湾相当。
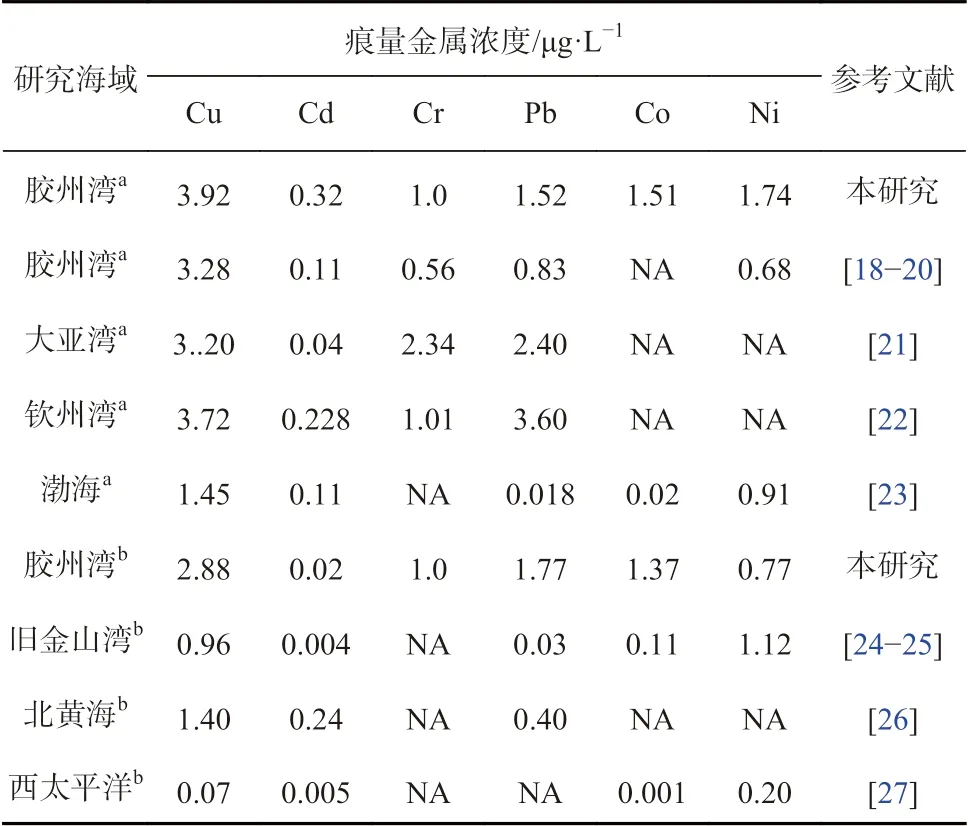
表2 胶州湾及其他海域海水中痕量金属浓度Table 2 Concentrations of trace metals in seawater of the Jiaozhou Bay and other areas
3.2 痕量金属在不同分子量溶解有机质中的分配
整体而言,胶州湾海水痕量金属均主要分配于低分子量组分(<1 kDa)中(图2),所占比例平均达70.1%(47.5%~86.6%)。不同痕量金属在不同分子量组分中的分配情况存在明显差异,根据其低分子量组分(<1 kDa)所占比例可大致分为3 类。Cu 和Cd 低分子量组分所占比例明显高于其他元素,平均值分别达到79.0%(70.7%~86.6%)及77.6%(68.7%~83.0%)。Cr、Ni 和Co 分子量分布较为相似,低分子量组分所占比例稍低,平均值分别为71.5%(61.9%~79.9%)、67.3%(55.8%~76.9%)及66.9%(57.5%~77.4%)。Pb的分配情况与以上元素存在显著差异,低分子量组分所占比例明显较低,平均值仅为58.2%(47.5%~70.3%)。海水痕量金属在低分子量组分(<1 kDa)中的分配是有机配合与无机配合共同作用的结果,但多数痕量金属无机配合态占总溶解态比例极小。海水中有98%以上的Zn、99%以上的Fe 和Cu 在溶解态中以有机配合物的形式存在[28],与有机配体相配合的Pb 可达总溶解态Pb 的95%[29],与强有机配体相配合的Co 与总溶解态Co 浓度也几乎相等[30],溶解有机质在这几种金属的分配过程中起主导作用。大洋表层水中有70%~99% 的溶解态Cd 与溶解有机质相配合,但河口及近岸海域中该赋存比例较低,一般在80%以下[31–33]。海水中的溶解态Ni 仅有不足60%以有机配合物的形式存在[34],溶解态Cr 的存在形态则尚处于探索阶段,针对其有机配合作用的研究较少[35]。无机配合作用可能在Ni 和Cr 在低分子量组分(<1 kDa)的分配过程中具有一定作用,其在低分子量溶解有机质中的分配仍需要进行进一步的探索。有研究显示,Cu 和Cd 与浮游植物及细菌释放的低分子量有机配体间存在极强的亲和力[36],Pb 等固液分配系数较大的金属与较高分子量的有机质亲和力更高,这可能与金属的电荷、离子半径、轨道能量等的差异有关[37],也是导致Pb 的高分子量(>1 kDa)组分比例明显高于Cu 和Cd 的主要原因。对于高分子量部分(1 kDa~0.45 μm)而言,10 kDa~0.45 μm 的组分通常所占比例最小,平均值仅为5.4%,其中Cu 和Cd 的分配比例分别仅4.4% 与5.0%,最高值为8.7%(Pb),该分子量范围内的溶解有机质对痕量金属的调控作用较弱。此外,就整体均值而言,痕量金属在1~3 kDa(13.5%)与3~10 kDa(11.0%)溶解有机质中的分配比例是相当的,但不同金属与不同站位间差别较大,无统一规律可循。
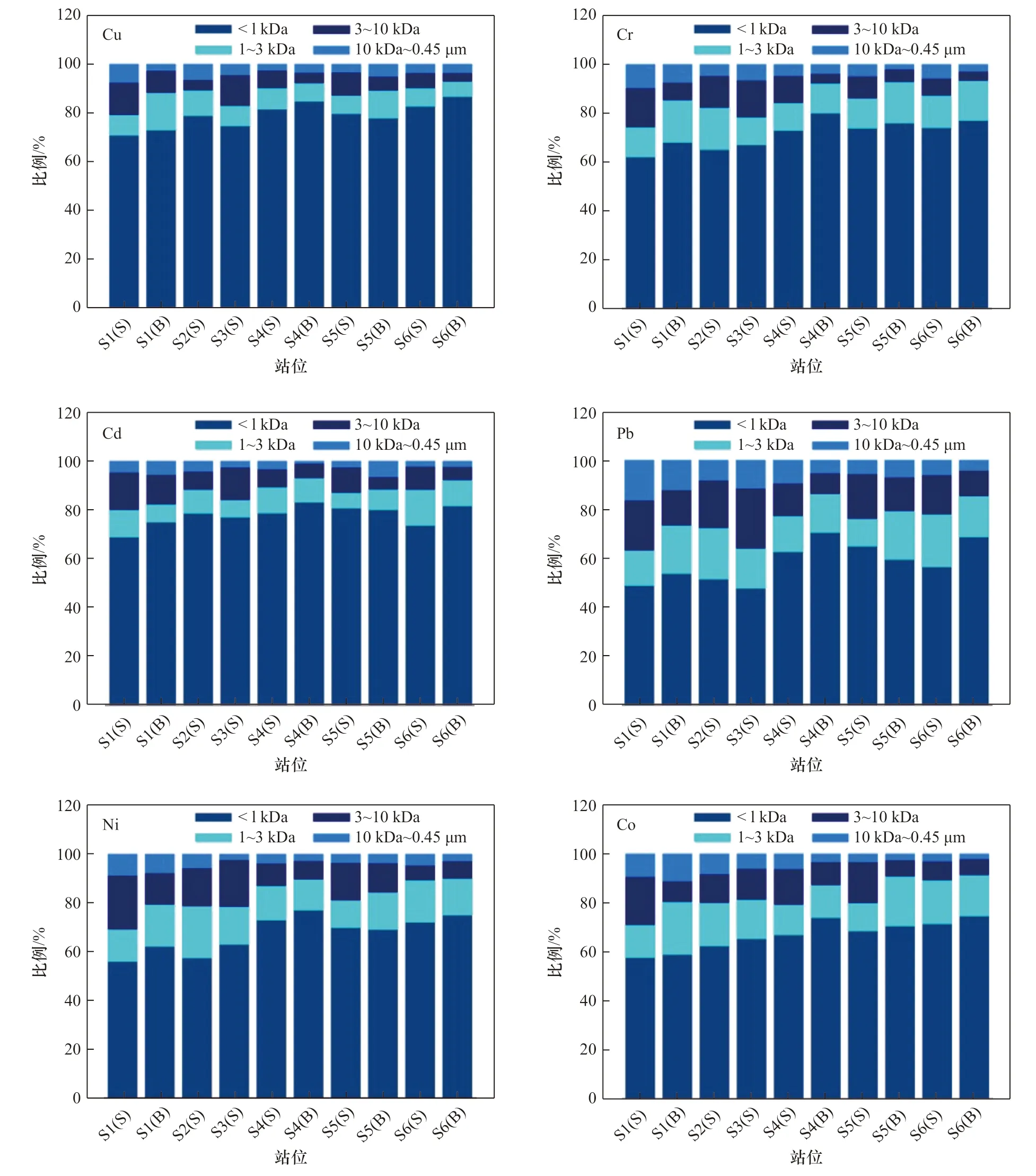
图2 胶州湾海水中痕量金属在不同分子量溶解有机质中的分配(S:表层海水;B:底层海水)Fig. 2 Distribution of trace metals among different sized DOM in seawater of the Jiaozhou Bay (S:surface seawater;B:bottom seawater)
目前,国内外已有多项针对水体中痕量金属-溶解有机质分配特征的研究,但所获结论并不统一。利用超滤技术分离九龙河口分配于不同分子量组分中的痕量金属,发现有60%~80%的Cu 和82%以上的Ni分配于3 kDa 以下[38]。通过切向流超滤研究墨西哥湾海域痕量金属的赋存形态,结果表明其中Cd 有97%分配于10 kDa 以下,Cu 也有近50%分配于10 kDa 以下[36]。通过尺寸排阻色谱-紫外检测技术分离不同分子量的腐殖质样品,进而利用ICP-MS 分析多种元素在不同级别腐殖质(<1 kDa,1~15 kDa,>15 kDa)中的分配比例,结果显示U 和Th 分别有93.0% 和96.9%分配于2 kDa 以下的腐殖质中,As 在小于2 kDa(49.7%)与2~15 kDa(42.8%)腐殖质中的分配比例相当[39]。利用切向流超滤研究北黄海Cd、Cu 和Pb 等痕量金属的形态特征,发现其中有49.2%~69.1%分配于1 kDa以下[40]。由此可见,不同研究区域间痕量金属的分配特征存在显著差异,结合实际因素分析其分配机理及影响因素等具有十分重要的意义。
与表层海水相比,胶州湾底层海水中与低分子量组分(<1 kDa)相配合的Ni、Cd、Cr 和Co 所占比例明显高于表层海水(t-test,p<0.05),Cu 和Pb 则未发现显著性差异。此外,胶州湾北部水体中痕量金属低分子量组分(<1 kDa)所占比例普遍低于湾口及湾外水体。Cu 和Cd 低分子量组分在北部水体中所占平均比例分别低于其余站位平均比例7.9% 与4.8%。Cr和Co 更为明显,其差值分别达10.1%与9.9%,Ni 和Pb则最为显著,湾口及湾外水体中低分子量组分所占比例分别高于北部水体13.0%与13.4%。与之相对,高分子量组分(>1 kDa)在北部水体(35.8%)中的平均分配比例分别高于湾口与湾外水体(26.0%),但具体各部分的分布规律仍不明显。其中,湾北部水体中痕量金属在10 kDa~0.45 μm 分子量范围内的分配比例大致高于湾口及湾外水体,在1~3 kDa 及3~10 kDa 分子量范围的分配则更为复杂,其高值区的出现通常是不确定的。
3.3 痕量金属在不同分子量溶解有机质中的分配机理
痕量金属在不同分子量溶解有机质中的分配主要取决于水体中溶解有机质的分子量分布及不同分子量溶解有机质的金属配合能力。
已有多项研究证明,天然水体中的溶解有机质以较低分子量组分为主。利用超滤技术分离海水中不同分子量的溶解有机质,发现其中有65%~80%分布于1 kDa 以下,10 kDa 以上的组分仅占2%~7%[41]。利用离心超滤研究不同类型水体中的溶解有机碳,结果表明河流、湖泊及海湾3 种水体中的溶解有机碳均以小于3 kDa 的组分为主[1]。采用杯式超滤系统探究天津临港海域中溶解有机质的分子量分布情况,发现有51.73%分布于小于1 kDa 的范围内,大于100 kDa的部分仅占10.18%[42]。利用超滤技术分析德拉瓦河口中的溶解有机质,发现其分子量有42%低于1 kDa,23%处于1~30 kDa,30 kDa~0.2 μm 仅占1.3%[43]。在墨西哥湾北部海水中的研究也发现,水体中70%以上的溶解有机质分子量处于0.5~5 kDa,20 kDa 以上所占比例不足10%[44]。天然水体中的有机质大部分为腐殖质,其主要组分富里酸与胡敏酸的质量比可达9∶1[45],富里酸等低分子量溶解有机质是水体中痕量金属最重要的有机配体。海水中溶解有机质的浓度通常以溶解有机碳的浓度来表示[2]。胶州湾海水中总溶解有机碳的浓度为0.577~1.360 mg/L,其中低分子量组分(<1 kDa)的浓度达0.418~0.866 mg/L,明显高于其余分子量范围内的浓度,10 kDa 以上的溶解有机碳浓度仅0.014~0.041 mg/L。由图3 可知,胶州湾海水中有62.1%~86.0% 的溶解有机碳分布于1 kDa以下,10 kDa 以上的组分仅占2.4%~10.4%,低分子量组分(<1 kDa)在海水溶解有机碳中占主要优势,是海水中痕量金属配体的主要来源,这与其他海域溶解有机质分子量分布研究的结果是一致的。此外,胶州湾表层海水中低分子量溶解有机碳(<1 kDa)所占平均比例低于底层海水(t-test,p<0.05),湾内东北部水体中低分子量溶解有机碳所占比例基本低于湾口及湾外水体,高分子量范围内各部分(1~3 kDa, 3~10 kDa,10 kDa~0.45 μm)分配比例的空间分布则规律较弱,这与大多数痕量金属在相应溶解有机质中的分配情况是一致的。将痕量金属在不同分子量溶解有机质中的分配比例与相应级分溶解有机质占总溶解态有机质的比例做相关性分析,发现二者之间呈显著正相关(p<0.01,R2=0.904 4(Pb)~0.968 3(Cd)),这进一步证明了有机配合作用及溶解有机质的分子量分布情况在胶州湾海水Cu、Cr、Cd、Pb、Ni 和Co 等目标痕量金属分配过程中的重要作用。

图3 胶州湾海水中溶解有机碳的分子量分布Fig. 3 Size distribution of dissolved organic carbon in seawater of the Jiaozhou Bay
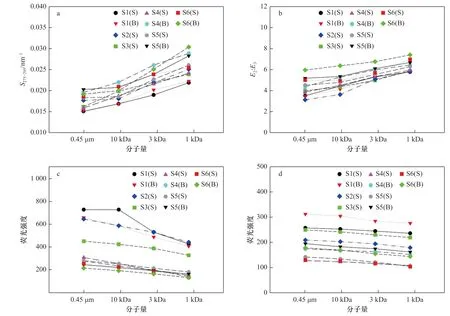
图4 胶州湾海水中溶解有机质的紫外吸收特征参数及荧光强度Fig. 4 UV-Vis absorption characteristics and fluorescence intensities of dissolved organic matters in seawater of the Jiaozhou Bay
此外,低分子量溶解有机质的强配合能力也已得到普遍认可。对不同分子量的有机质提取物(<3.5 kDa、3.5~14 kDa、>14 kDa)与Cu2+之间配合作用的研究表明,有机质的配合能力随分子量增加而降低[46]。研究环境中不同分子量有机质对Cd 迁移性的影响,结果显示小分子量有机质(<1 kDa)对Cd2+的配合能力更强[47]。利用紫外-可见吸收特征参数探究水体中不同分子量溶解有机质的浓度及组成特征,发现对胶州湾海水而言,不同站位溶解有机质的紫外-可见吸收特征参数随分子量变化而改变的趋势大致相似(图4)。不同分子量溶解有机质的光谱斜率存在明显差异(ttest,p<0.01),其S275-295值随溶解有机质分子量降低而逐渐升高,这表明低分子量组分中来源于浮游植物活动及微生物降解等的海源有机质浓度较高[48],且海水溶解有机质的主要组分腐殖质中富里酸与胡敏酸的比值较高,富里酸的作用更为显著[49]。对腐殖质的结构分析已经表明,分子量较低的富里酸以羧基化合物、碳水化合物及多糖为主要结构,高分子量的胡敏酸则主要为长链烷烃,前者的金属配合能力更高[50]。一项针对九龙河河口中痕量元素的研究发现,水体中Cu、Ni、Co、Pb 和Cd 等痕量金属的生物地球化学行为主要受控于陆源输入的富里酸[51]。此外,低分子量溶解有机质在250 nm 与365 nm 下吸光度的比值(E2:E3)明显高于高分子量组分(t-test,p<0.01),这表明低分子量溶解有机质芳构化程度较低[52],链烷烃及芳香族基团含量较低,碳水化合物含量丰富,具有大量可用于配合痕量金属的羧基、羟基等官能团,金属配合能力较高。将各站位痕量金属在不同分子量溶解有机质中的分配比例与相应溶解有机质的吸收光谱特征参数做相关性分析,结果表明其分配比例与溶解有机质的S275-295值(p<0.05,R2=0.610 4(Pb)~0.836 5(Co))及E2:E3值(p<0.05,R2=0.693 8(Pb)~0.840 5(Cd))均呈显著性正相关,这进一步验证了紫外-可见吸收特征参数对溶解有机质金属配合能力的指示意义。
溶解有机质荧光特性的分析结果显示,胶州湾海水中的荧光组分主要包括类蛋白质与类腐殖质两种。不同分子量类蛋白质与类腐殖质的荧光强度存在明显差异(t-test,p<0.05),随分子量降低而逐渐降低,且两种组分荧光强度随分子量变化而变化的趋势有所不同(图4)。其中,类蛋白质荧光强度下降十分明显,类腐殖质荧光强度下降幅度则较小,表明大量类蛋白质组分在过滤过程中被滤膜截留,而大部分类腐殖质组分能够穿过滤膜进入滤液。胶州湾海水中的高分子量溶解有机质(>1 kDa)主要为类蛋白质,还包含一部分高分子量的腐殖酸,低分子量溶解有机质(<1 kDa)则主要由类腐殖质组成,包括大量的富里酸及一部分低分子量的腐殖酸,还含有一定量的小分子氨基酸。将各站位类腐殖质与类蛋白质荧光强度的比值与痕量金属在低分子量溶解有机质(<1 kDa)中的分配比例做相关性分析,结果表明Cu、Ni、Cd 和Co 的分配比例与该比值呈显著性正相关(p<0.01,R2=0.716 1(Co)~0.769 3(Cu)),Cr 和Pb 也存在较显著正相关(p<0.05,R2=0.619 4(Cr)~0.634 8(Pb)),同样也印证了类腐殖质在低分子量溶解有机质与痕量金属配合过程中的重要作用。海水中的类蛋白质荧光主要与芳环蛋白质和氨基酸有关,类腐殖质荧光则主要来自于其结构中的羧基和羰基[53]。研究显示,海水中仅有不超过10%的痕量金属与蛋白质类溶解有机质相配合,含有丰富含氧官能团的腐殖质类溶解有机物尤其是富里酸则对海水痕量金属的配合起主要作用[54]。由此可见,胶州湾海水中低分子量的溶解有机质(<1 kDa)具有更高的金属离子配合能力,这与紫外-可见吸收光谱的分析结果是一致的。
3.4 痕量金属在不同分子量溶解有机质中分配的影响因素
水体中溶解有机质的分子量分布情况及金属配合能力受生物活动、光照、盐度等多种因素影响,痕量金属的分配也由此受这些因素调控。光降解和微生物分解会将水体中的高分子量有机质转化为低分子量组分,絮凝和沉淀作用可以导致高分子量有机质迁出水体,浮游生物活动的影响则更加复杂[37]。
浮游生物活动是控制水体中溶解有机质分子量分布的主要因素,水体中40%~60%的溶解有机质来源于浮游植物的释放[55],主要途径包括浮游植物渗出、自我分解及细菌分解等[56],其中高分子量溶解有机质(>1 kDa)可占浮游植物整个生长过程中所释放溶解有机质的30%~60%[57]。真光层内藻类的初级生产是海洋中溶解有机质的主要来源[58],所释放溶解有机质的分子量因生物群落结构、环境条件等的差异而有所不同。有研究发现,在初级生产力较高的福克斯河中,高分子量溶解有机碳(>1 kDa)的浓度(约7.62 mg/L)明显高于圣路易斯河(约2.88 mg/L)与密西西比河(约3.68 mg/L)[59]。此前还有多项培养实验证实,浮游植物生长过程中可以释放与海水中高分子量溶解有机质组分相似的有机质[60]。测定胶州湾海水的叶绿素a 浓度以分析其浮游植物生物量及初级生产力分布,结果如表3 所示。将各站位叶绿素a 浓度与不同分子量溶解有机质所占比例做相关性分析,发现其与10 kDa~0.45 μm 有 机 质 间 呈 显 著 正 相 关(n=10,p<0.01,R2=0.876 1),与3~10 kDa 有机质间也存在较显著正相关(n=10,p<0.05,R2=0.562 5),与1~3 kDa有机质间则无明显相关性(n=10,p>0.05)。将各站位叶绿素a 浓度与总高分子量有机质(>1 kDa)所占平均比例做相关性分析,发现二者呈显著正相关(图5,n=10,p<0.01,R2=0.889 1),高分子量组分所占比例随叶绿素a 浓度升高而增加,这进一步印证浮游植物初级生产是海水中高分子量溶解有机质的一个重要来源。此外,低叶绿素区域可能出现于浮游植物被摄食或死亡后,该过程会释放高分子量溶解有机质或产生浮游植物残骸,之后迅速被微生物分解转化为小分子[58],由此增加低叶绿素水体中低分子量组分所占比例。
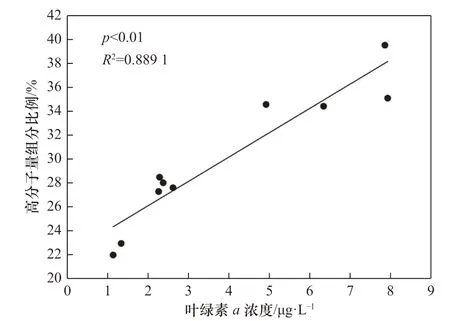
图5 胶州湾海水中叶绿素a 浓度与高分子量溶解有机质(>1 kDa)所占比例的相关性Fig. 5 Correlations between chlorophyll a concentration and high molecular weight proportion (>1 kDa) in seawater of the Jiaozhou Bay
除分子量分布情况外,海水溶解有机质的配合能力也可能随环境因素尤其是盐度的变化而发生改变。溶解有机质相邻官能团之间的静电斥力会随盐度升高而减小,使其在高离子强度下发生自身折叠而形成较为紧密的空间结构[37],降低羧基、羟基等有效官能团对痕量金属的配合能力。同时,盐度升高还会促进高分子有机聚集体的沉淀迁出,增加低分子量金属有机配合物的比例[61]。盐度对痕量金属与溶解有机质配合作用的显著影响已通过多项研究被证实[62–63],胶州湾海水盐度呈湾外及湾口略高于湾顶,底层略高于表层的趋势,但变化幅度极小。湾顶低盐度水域痕量元素高分子量组分(>1 kDa)略高,一定程度上也证明了低盐度有利于高分子量有机质的稳定性,从而增加了高分子量有机质与痕量元素的配合能力,但该海域叶绿素a的浓度也较高,高分子量组分略高可能是生物活动与盐度综合作用的结果,盐度变化所引起的差异有待进一步研究。此外,湾顶东北部低盐水域靠近李村河、娄山河河口,陆源输入可能是高分子量溶解有机质的另一来源。有研究发现,高分子量溶解有机质随盐度的降低所占比例逐渐升高[59],且来源于陆生或高等水生植物的溶解有机质分子量通常高于海洋浮游植物和微生物活动所产生的溶解有机质[64],由此导致离岸较远的高盐度水域中高分子量溶解有机质及分配于其中的痕量金属所占比例较低。
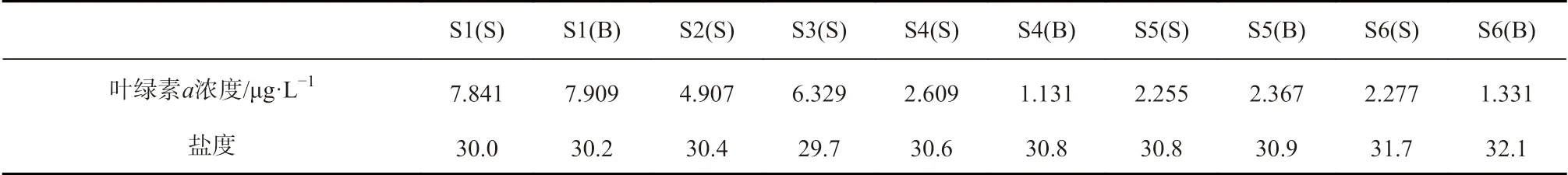
表3 胶州湾海水叶绿素a 浓度与盐度Table 3 Chlorophyll a concentration and salinity in seawater of the Jiaozhou Bay
4 结论
胶州湾海水痕量金属具有近岸浓度较高的分布特征,高值区多出现于湾东北部及湾口等受人类活动影响明显的水域。底层海水中Cu、Ni 和Co 的浓度高于表层海水,Pb 则呈现出表层海水高于底层海水的趋势。胶州湾海水痕量金属主要分配于低分子量组分(<1 kDa)中,其中Cu 和Cd 低分子量组分所占比例明显高于其他元素,Pb 低分子量组分所占比例最低。海水痕量金属的分配特征主要取决于溶解有机质的分子量分布及金属配合能力。海水中的溶解有机质以低分子量组分(<1 kDa)为主,且低分子量有机质中羟基、羧基含量更高,以富氧官能团的类腐殖质组成,金属配合能力更强,导致痕量金属多与低分子量溶解有机质生成配合物。生物活动是影响水体中溶解有机质分子量分布的主要环境因素,浮游植物初级生产所释放的溶解有机质以高分子量组分(>1 kDa)为主,浮游植物被摄食过程中及死亡后也会产生高分子量有机溶解有机质或有机碎屑,但这部分高分子量组分会迅速经微生物分解转化为小分子。此外,盐度增加会导致有机质空间结构发生折叠,降低羧基、羟基等有效官能团对痕量金属的配合能力,胶州湾湾顶水域高分子量痕量金属浓度较高可能是低盐度、高输入及高生产力共同作用的结果。
本文初步揭示了胶州湾海水痕量金属在不同分子量溶解有机质中的分配特征,为进一步了解胶州湾海水痕量金属的生物地球化学行为及评估其生物可利用性和毒性效应等提供了一定的理论支持。未来可针对痕量金属与溶解有机质之间的作用方式、痕量金属-溶解有机质分配的生态学意义、有机与无机配合共同作用下痕量金属的分配等进行进一步的研究探索,深入理解溶解有机质参与背景下海水痕量金属的生物地球化学循环过程。
致谢:感谢胶州湾生态站的科考队员在海水样品采集过程中给予的支持和帮助。

