鸭油甘油二酯与壳聚糖联合应用对小鼠溃疡性结肠炎修复的影响
王 茜 ,王宝维,*,葛文华,张名爱,,丛红霞,徐慧心,孔 敏,凡文磊,
(1.青岛农业大学食品科学与工程学院,山东青岛 266109;2.国家水禽产业技术体系营养与饲料功能研究室,山东青岛 266109)
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和Crohn 病(CD)[1]。溃疡性结肠炎是一种非特异性结肠炎,其临床表现包括腹痛、血便等[2]。近年来,人类和动物溃疡性结肠炎的发病率呈上升趋势,并伴有向结肠癌转化的风险[3],因此寻找安全修复方法具有重要意义。甘油二酯(DG)是油脂酶解的中间产物,在食品、医药等行业有广泛的应用[4],具有抑制革兰氏阴性菌与革兰氏阳性菌[5]、刺激肠道脂质代谢[6]等功能。目前,国外对于食品级DG 的研究刚刚起步,少数产品采用植物油制备。我国肉鸭每年屠宰约45 亿只,屠宰产生了大量腹脂、皮脂等副产品,经过加工提取和精炼,可获得到大量鸭油,且价格低廉。本研究室采用鸭油成功制备DG[7]。目前,鸭油甘油二酯(DDG)与其他产品的功能性差异性及其在食品中的应用技术还缺乏深入研究。Lin 等[8]试验发现,富含脂质的肠内营养可以控制肠缺血再灌注损伤后的肠炎症,改善肠运动性和黏膜屏障损伤。壳聚糖(CTS)是天然多糖甲壳素脱除部分乙酰基的产物,具有减少脂肪形成[9]、抑制细菌活性[10]等功能。Davydova 等[11]研究发现,高分子量CTS 可刺激小鼠血清中抗炎症细胞IL-10 的合成,降低髓过氧化物酶(MPO)活性。目前,国内外对壳聚糖抑菌方面的研究已有许多,而DDG 与CTS联合使用对溃疡性结肠炎小鼠肠道炎症的修复效果研究未见报道。因此,本文通过探究DDG 与CTS 联合应用对小鼠肠道炎症屏障保护的效果,分析炎症细胞因子含量的变化,旨在探索肠道健康的新型生物防护方法。
1 材料与方法
1.1 试验材料及饲料配方 6 周龄雄性昆明系小鼠,体重为25~30 g,购自青岛大任富城有限公司。DDG 为实验室自制产品,纯度达85%。CTS 购自山东奥康生物科技有限公司(MW:850 000 DA;脱乙酰度:96.1%;批号190416A),按照3%(w/w)的比例将CTS 溶解于1%(v/v)醋酸盐水中,即CTS 溶液[12]。LD3020 硫酸葡聚糖(MW:50 000)购自合肥博美生物科技有限公司。饲料购于德州诺唯实生物技术有限公司,基础饲粮组成及营养成分见表1。

表1 基础饲粮组成及营养成分(风干基础)
1.2 DDG 的制备方法[13]①将鸭油和水按1:1 放在87℃恒温水浴锅中1.5 h,然后转移至分液漏斗除去下层溶液。②在油层中加入一倍的1 mol/L NaOH 溶液,87℃恒温水解1.5 h。③加入一倍量的NaCl 洗涤除去甘油,调节pH 为2~3,释放游离的脂肪酸。④将混合脂肪酸与甘油按照2.02:1 放入锥形瓶中混合,并加入1.65%固定化南极假丝酵母脂肪酶B,放置在恒温摇床54℃进行酶解反应。⑤反应结束后,以2 500 r/min 离心15 min,将酶与底物分离,得到DDG。
1.3 试验设计 试验小鼠饲养于SPF 级动物房,保持室温24~25℃,人工光照12 h/d,相对湿度40%~60%,试验开始前适应性喂养1 周,自由饮食。按照《实验动物福利伦理审查指南》(GB/T 35892-2018)开展本项试验。
1.3.1 结肠炎模型建立 参照Chassaing 等[14]的方法建立小鼠溃疡性结肠炎模型。设计对照组与模型组,对照组和模型组组间差异采用独立性T 检验分析,对照组5个重复,模型组20 个重复,每个重复10 只。所有小鼠自由饮食,对照组小鼠自由饮用蒸馏水,模型组将葡聚糖硫酸钠(DSS)溶于蒸馏水中配制5%(w/v)的DSS溶液,替代饮用水,每天进行更换,小鼠连续自由饮用7 d 诱发结肠炎,建立溃疡性结肠炎模型。对照组与模型组各抽取25 只小鼠,禁食24 h,实施安乐死,收集血样,检测致炎因子,测量结肠长度,验证模型建立是否成功。
1.3.2 结肠炎修复试验 试验设计正常对照组、炎症模型组和炎症修复组(Ⅰ~Ⅵ组),共8 个组。每组5 个重复,每个重复5 只,共200 只小鼠。炎症修复组采用2×3 两因素交叉等重复的析因设计。正常对照组与炎症模型组灌服4 mL/kg 生理盐水,炎症修复组分别灌服甘油二酯2、3、4 mL/kg 及壳聚糖溶液2、4 mL/kg,所有小鼠均饲喂基础饲粮。试验周期为3 周。具体饲喂情况如表2 所示。连续灌胃7 d 进行修复治疗后,对所有小鼠实施安乐死。
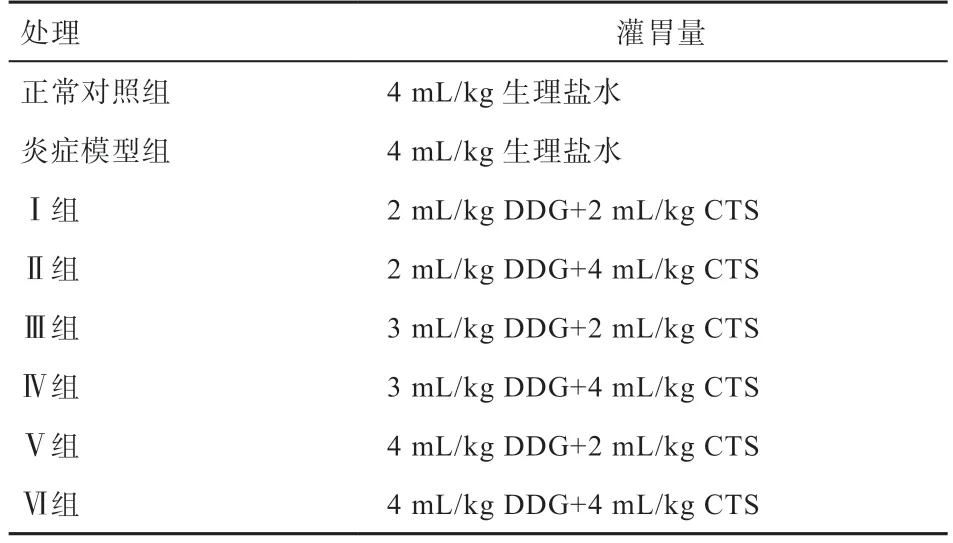
表2 试验期小鼠分组处理情况
1.4 血清生化指标的测定 在试验结束时,眼球取血收集血样,并在3 000 r/min 下离心20 min 获得血清,并将其储存在-40℃下。使用ELISA 试剂盒(南京建成生物工程研究所)测定血清中白细胞介素1β(IL-1β)、白细胞介素4(IL-4)、白细胞介素6(IL-6)、白细胞介素17(IL-17)、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)、MPO 含量。
1.5 结肠肠道组织学检测 收集每只小鼠的结肠,测量结肠的长度和重量,然后切下结肠下段相同位置的长0.5 cm的结肠样品,在10%中性福尔马林中固定24 h 后,将结肠样品用流水冲洗12 h 后分级酒精溶液脱水,进行石蜡包埋切片,苏木精和曙红染色后通过生物显微镜观察不同组之间的组织学变化,并通过数码相机获取图像,采用LY-WN-HP SUPPER CCD 软件测量结肠的绒毛高度和隐窝深度。
1.6 统计分析 试验数据用 Excel 2016 进行整理,利用SPSS 17.0 统计软件对结肠炎模型建立阶段对照组和模型组组间差异进行独立性t检验分析,结肠炎修复试验阶段,通过GLM 模型进行2×3 因子分析,差异显著者用 Duncan's 法进行多重比较。结果以平均值和集合标准误(SEM)表示,P<0.05 表示差异显著,0.05 ≤P<0.10表示有趋势。
2 结果与分析
2.1 DSS 诱导溃疡性肠炎模型的建立 如表3 可知,饲喂DSS 后,与对照组相比,模型组的体重变化及结肠长度均显著降低,模型组TNF-α、IL-6 含量均显著增加,表明DSS 诱导小鼠溃疡性结肠炎模型建立成功[14]。
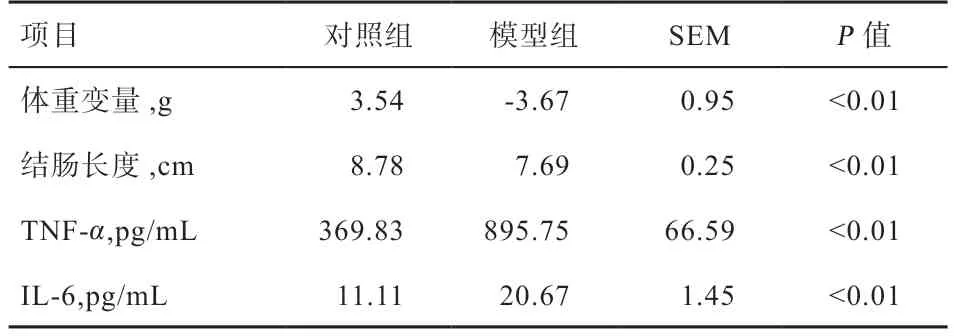
表3 DSS 对小鼠造模的影响
2.2 DDG 与CTS 联合对溃疡性结肠炎小鼠体重修复、结肠长度和MPO 活性的影响 如表4 所示,DDG、CTS 对小鼠体重变化影响显著;DDG 与CTS 交互对于体重变化作用极显著,Ⅲ组体重变化分别较Ⅰ、Ⅱ、Ⅳ、Ⅴ、Ⅵ组高1.13%、1.78%、6.48%、5.33%、2.74%(P<0.01)。DDG、CTS 对于小鼠结肠长度变化无显著影响;DDG 与CTS 交互对于结肠长度作用不显著。DDG 对MPO 活性影响极显著;CTS 对MPO 活性变化有显著影响;DDG 与CTS 交互对MPO 活性影响极显著,Ⅱ、Ⅲ、Ⅳ组的MPO 值无显著差异,但显著低于其他试验组。
2.5 DDG 与CTS 联合对溃疡性结肠炎小鼠细胞因子水平的影响 修复治疗后,各组小鼠的生理指标变化如表5,DDG 对IL-4、IL-17、IL-1β、IFN-γ浓度变化影响极显著,对于IL-6、TNF-α浓度变化有显著影响;CTS对IL-4、IL-6、IL-17、IL-1β、IFN-γ、TNF-α浓度变化作用极显著;Ⅲ组与Ⅴ组的TNF-α浓度无显著差异,但显著低于其他试验组;Ⅲ组的IL-6、IL-17、IL-1β浓度均显著低于其他各试验组。DDG 与CTS 交互对IL-4、IL-6、TNF-α浓度的变化有显著影响,DDG 与CTS 交互对于IL-17、IL-1β、IFN-γ浓度的变化作用极显著。
综上所述,经过DDG 与CTS 联合修复治疗可降低结肠炎小鼠的炎症反应,减少炎性细胞因子的释放。
2.6 DDG 与CTS 联合对溃疡性结肠炎小鼠结肠组织发育的影响 如图1 可知,正常对照组小鼠结肠黏膜完整,隐窝腺体完整,无炎性细胞浸润;与正常对照组相比,炎症模型组小鼠结肠黏膜上皮出现较大溃疡,隐窝结构大部分消失,大量炎性细胞浸润;与炎症模型组相比,Ⅰ~Ⅵ组小鼠结肠黏膜较少缺损,隐窝腺体破坏较轻,炎性细胞较少。
如表6 所知,DDG 对于绒毛高度、线隐比变化作用极显著,对于隐窝深度无显著影响;壳聚糖可显著增加绒毛高度,对隐窝深度与绒隐比无显著影响;Ⅲ、Ⅳ组绒毛高度显著高于其他试验组,Ⅱ组、Ⅲ组的隐窝深度显著低于Ⅵ组。Ⅲ组的绒隐比高于Ⅴ组、Ⅵ组;DDG 与CTS 交互对绒毛高度、隐窝深度的变化作用显著,对于绒隐比的变化作用不显著。

表4 DDG 与CTS 联合对溃疡性结肠炎小鼠体重变量、结肠长度和MPO 活性的影响
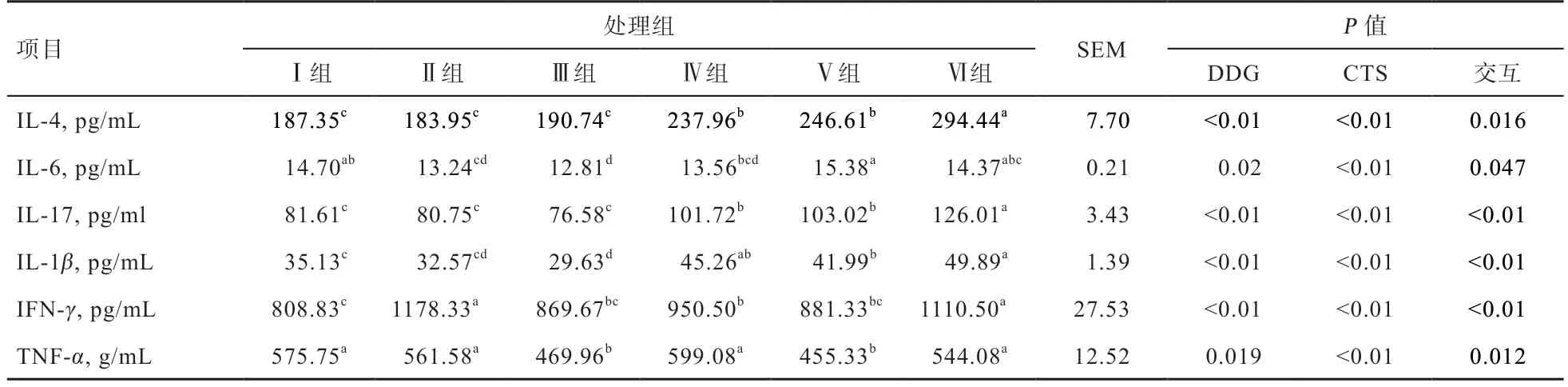
表5 DDG 与CTS 联合对溃疡性结肠炎小鼠细胞因子的影响
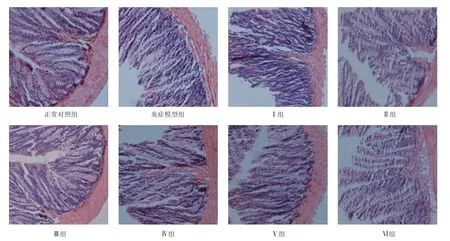
图1 各组结肠组织H&E 染色情况(×20)
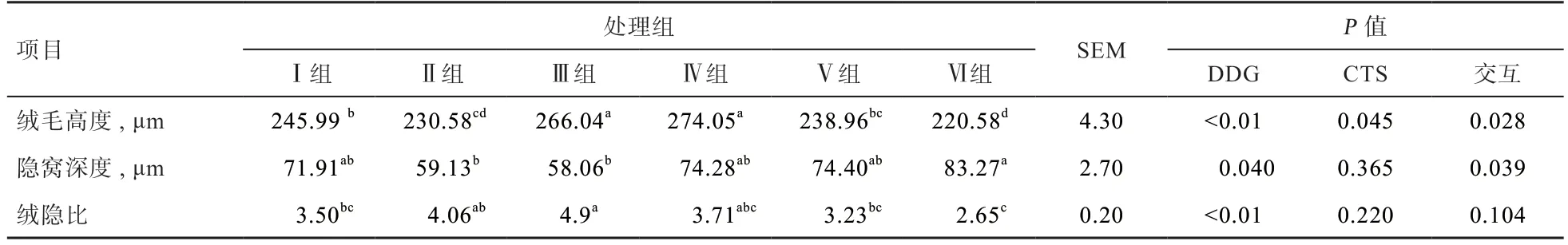
表6 DDG 与CTS 联合对溃疡性结肠炎小鼠结肠发育的影响
综上所述,对于结肠炎小鼠给予不同水平的DDG与CTS 进行治疗,可使结肠绒毛高度增大,隐窝深度变浅,绒隐比增大,促使小鼠肠道炎症恢复,其中Ⅲ组修复治疗效果最好。
3 讨 论
3.1 DDG 与CTS 联合对降低炎症反应的影响 溃疡性结肠炎的炎症可能是巨噬细胞破坏结肠黏膜,导致免疫失调,症状为体重减轻、腹泻、血便、结肠缩短等[15],会导致MPO 含量增加,结肠中MPO 的积累为中性粒细胞进入组织的标志[16]。Park 等[17]研究发现,富含中链脂肪酸-二酰甘油(MCDG)的食用油与常规使用的低芥酸菜籽油和橄榄油对照相比,MCDG 可抑制巨噬细胞的吞噬作用。Liu 等[18]通过研究CTS 对DSS 诱导的溃疡性结肠炎小鼠肠道菌群和肠屏障功能的影响发现,CTS 通过增加体重和结肠长度等显示出对结肠炎的治疗效果。DG 对胆汁酸的分泌有抑制作用,可用于预防或治疗腹泻,可治疗炎症[19]。本试验发现,与对照组比较,结肠炎模型组小鼠体重显著下降,结肠长度显著缩短,这与肠炎造成肠道黏膜损伤、组织坏死、营养物质吸收受阻有关。肠炎造成MPO 含量显著增加,说明MPO 发挥了调控作用,通过催化氧化氯离子产生次氯酸在吞噬细胞内杀灭微生物,破坏多种靶物质,对调节炎症反应等多方面进行干预。DDG 与CTS 修复治疗后,能够使小鼠体重上升,结肠长度增加,MPO 含量降低,表明肠道炎症修复后,肠道组织发育和营养物质吸收恢复正常。DDG 与CTS 联合具有降低炎症反应的协同作用。
3.2 DDG 与CTS 联合对炎症细胞因子水平的影响 CTS 具有抗菌、抗病毒、抗炎等广泛的生物活性。Yousef 等[20]研究发现,急性结肠炎小鼠接受CTS 治疗后可抑制其结肠组织中的NF-κB 活化以及TNF-α和IL-6 水平;Yoon 等[21]研究发现,在增加CTS 浓度的情况下,可降低由革兰氏阴性细菌的脂多糖(LPS)诱导分泌在RAW 264.7 细胞孵育培养基中的TNF-1 和IL-6,说明CTS 具有抗炎作用。DG 是由丙三醇(甘油)与2 个脂肪酸酯化后得到的产物,是一种天然性油脂,具有抗炎、抑菌等作用。郭夏丽等[22]通过研究樟树籽油甘油二酯的抑菌活性发现,樟树籽油甘油二酯对于革兰氏阳性细菌和革兰氏阴性细菌均有抑制作用。Wendell 等[23]阐述了脂肪酸可在分解阶段释放大量H 离子,使炎症细胞代谢衰竭,破坏细胞结构,进而起到抗炎作用。核因子-κB(NF-κB)是调控炎症细胞因子基因表达的主要转录调控因子之一,在创伤后的炎症反应中发挥着重要的作用。目前,治疗溃疡性结肠炎的手段主要有水杨酸类、糖皮质激素类药物、细胞因子、细胞因子抗体等,共同作用机制是调节和阻断NF-κB/Rel 信号通路,从而减少炎性细胞因子的释放,或抑制炎性细胞因子的作用,炎性细胞因子中 IL-6、IL-1β、TNF-α等均在转录水平上为NF-κB/Rel 所控制[24]。本试验结果表明,与对照组相比,结肠肠炎处理组各指标均显著升高,鸭油甘油二酯与壳聚糖以及交互对各指标均作用显著,表明鸭油甘油二酯与壳聚糖对小鼠溃疡性结肠炎有一定的修复治疗作用,可调节免疫紊乱。鸭油甘油二酯与壳聚糖对结肠炎的改善作用可能是通过抑制NF-κB 通路,减少炎性细胞因子的释放,其机理有待于继续研究。
3.3 DDG 与CTS 联合对结肠组织发育的影响 绒毛高度、隐窝深度及绒隐比是衡量肠黏膜完整的重要指标[25]。冯俊等[26]在断奶仔猪的基础日粮中添加CTS 后发现,仔猪小肠绒毛高度呈升高趋势;刘亚楠等[25]研究发现,不同水平的DDG 与维生素D3可显著升高结肠炎大鼠的绒毛高度,降低隐窝深度。陈星等[27]研究发现,乙酸诱导的结肠炎仔猪的十二指肠、回肠绒隐比显著降低。本试验发现,炎症模型组结肠黏膜缺损,腺体不完整,绒毛高度显著降低,隐窝深度显著增加,大量隐窝结构破坏,绒隐比显著降低,炎性细胞明显浸润。经过DDG 与CTS 协同修复治疗后,Ⅲ组小鼠修复效果对比于其他各组较好,结肠黏膜缺损较轻,炎性细胞较少,绒毛高度增加,少量隐窝腺体不完整,隐窝深度降低,绒隐比增加,且大于其他各组,表明DDG 与CTS 联合可促进小鼠结肠组织发育。
4 结 论
本试验结果显示,DDG 与CTS 联合可降低DSS 诱导小鼠结肠炎炎症反应,降低肠道炎症因子水平,可改善溃疡性结肠炎小鼠生理指标,促进溃疡性结肠炎小鼠结肠组织发育,具有交互协同修复治疗作用,是一种很有开发价值的肠道炎症健康修复剂,其中3 mL/kg DDG与2 mL/kg CTS 组合对于小鼠结肠炎治疗效果最佳。

