碱性蛋白酶限制性酶解对蓝圆鲹分离蛋白功能特性的影响
孙乐常,刘伟峰,林怡晨,赵阿云,张凌晶,翁 凌,曹敏杰,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程中心,福建 厦门 361021;3.海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
海洋鱼类水产品肌肉具有高蛋白、低脂肪的特点,其蛋白中必需氨基酸含量高、分布均衡,是理想的优质食物蛋白。2017年,我国海洋鱼类产量951.74万 t,其中海洋捕捞鱼类产量820.85万 t,而低值经济鱼类年捕捞量则高达412.35万 t,占总海洋鱼类捕捞量的50.23%[1]。随着海洋捕捞资源的日益匮乏,如何高效利用与开发低值海洋经济鱼类的优质蛋白资源是当前水产品精深加工领域研究的重点[2]。
目前,国内外针对水产鱼类蛋白的开发与应用主要是通过多酶或单酶的酶解方法,制备具有抗氧化活性[3]、矿物质离子螯合活性[4]、降血压活性[5]以及抗凝血活性[6]功能的小分子生物活性肽。另一方面,通过一定的加工手段对蛋白进行修饰改性,可显著提高蛋白的乳化性、溶解性、分散性以及起泡性等功能特性,将其作为新型蛋白配料应用于各类食品中,能进一步改善食品的品质[7-11]。其中,利用商业化蛋白酶对蛋白原料进行一定程度的限制性酶解是蛋白修饰改性的主要手段之一。迄今为止,限制性酶法改性研究多集中在植物蛋白方面,如:Klost等[7]通过胰蛋白酶水解以改善豌豆分离蛋白的溶解度和乳液的整体稳定性;Thaiphanit等[8]在碱性蛋白酶对椰子蛋白进行处理时发现酶解蛋白的水解度(degree of hydrolysis,DH)为8.25%~10.17%的蛋白乳化活性最好,说明特定的限制性酶解能有效提高蛋白的功能特性。类似结果在国内也有研究报道,如Xu Xingfeng等[9]发现胰蛋白酶酶解可以显著改善稻谷蛋白的功能特性。目前对于酶解提升动物蛋白功能特性的研究主要集中在蛋清蛋白[10]与乳清蛋白[11],而关于酶解对水产动物肌肉蛋白功能特性的影响则鲜见报道。
蓝圆鲹是我国重要的低值海洋经济鱼类之一,据统计,2017年蓝圆鲹全国捕捞总量达53.52万 t,其中福建省捕捞量为24.37万 t,位居全国首位[1]。前期研究发现,采用等电点沉淀制备得到的蓝圆鲹碱分离蛋白不仅营养价值与消化性高,而且无明显鱼腥等不良气味,具有很好的开发前景[12]。本研究拟以蓝圆鲹碱分离蛋白为对象,采用碱性蛋白酶限制性酶解制备酶解蛋白,研究DH对酶解蛋白溶解性、持水性、持油性、乳化性和起泡性等功能特性的影响,旨在为水产蛋白在食品配料蛋白领域的应用提供一定理论参考。
1 材料与方法
1.1 材料与试剂
冰鲜蓝圆鲹(均质量约150 g/尾)购于厦门市夏商水产批发市场;压榨葵花仁油 市售。
碱性蛋白酶(5.0×104U/g) 无锡诺维信酶制剂公司;邻苯二甲醛(o-phthalaldehyde,OPA)、8-苯胺基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS) 美国Sigma公司;考马斯亮蓝R-250 兴隆达公司;其他试剂均为分析纯级。
1.2 仪器与设备
FJ-200高速分散均质机 上海标本模型厂;pH计德国Sartorius公司;恒温水浴锅 德国Memmert公司;ATN-300全自动凯氏定氮仪 上海洪纪设备有限公司;Alpha 1-4 LDplus冷冻干燥机 德国Christ公司;Avanti J-26S XP大型台式高速冷冻离心机 美国Beckman公司;凝胶成像仪 英国Syngen公司;Lambda紫外分光光度计 美国Perkin Elmer公司;FP-8200荧光分光光度计日本Jasco公司;1260超高效液相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 碱法提取蓝圆鲹分离蛋白
参考孙乐常等[12]的方法,在4 ℃环境下进行。将蓝圆鲹去头、去内脏和去皮之后,收集肌肉部分,与8 倍体积的冰水混合,并组织捣碎。用1 mol/L NaOH溶液调节pH 11.0,用玻璃棒搅拌10 min,使鱼肉充分溶解。将提取液8 000×g离心10 min,小心收集上清液部分,用1 mol/L HCl溶液调节pH 5.5,持续搅拌10 min后,8 000×g离心10 min,收集沉淀部分。得到的沉淀部分用1 mol/L NaOH溶液调节pH 7.0即为蓝圆鲹分离蛋白,并贮存于4 ℃,48 h内用于以下实验。
1.3.2 蓝圆鲹分离蛋白酶解
配制0.25 g/mL的蓝圆鲹分离蛋白溶液,采用碱性蛋白酶酶解。酶解条件:pH 8.0,加酶量(占蛋白质量计)25 U/g,水解温度50 ℃。反应体系用0.1 mol/L磷酸盐缓冲溶液维持恒定pH 8.0。水解结束时,将酶解液在8 000×g、4 ℃离心15 min,收集上清液部分,进行冷冻干燥,即可得到蓝圆鲹分离蛋白的酶解产物。
1.3.3 DH的测定
参照Church等[13]的方法,用OPA法测定水解样品的DH。酶解产物用蒸馏水稀释至终质量浓度为5 mg/mL。将100 μL样品与750 μL OPA试剂混合,并在室温下反应2 min,而后在340 nm波长处测量其吸光度。样品的DH计算如式(1)所示:
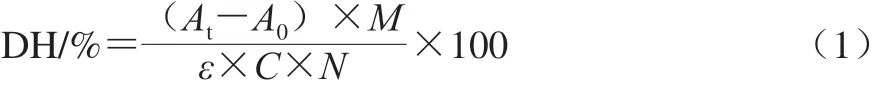
式中:At为样品在340 nm波长处的吸光度;A0为空白对照(水)在340 nm波长处的吸光度;M为蛋白质量/g;ε为340 nm的摩尔消光系数(6 000 L/(mol·cm);N为稀释因数;C为蛋白质量浓度/(g/L)。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)
根据Laemmli[14]的方法略有修改,浓缩胶和分离胶丙烯酰胺凝胶分别为4%和15%。电泳后用考马斯亮蓝染色法染色,用脱色液脱色后。全蛋白SDS-PAGE样品制备参考孙乐常等[12]的方法,将蛋白样品液与蛋白溶解液(20 mmol/L Tris-HCl pH 8.0、1% SDS、8 mol/L尿素、2% β-巯基乙醇)以1∶2比例充分混合,95 ℃加热20 min。利用Lowry法对样品进行蛋白含量测定,调节样品的上样量为每泳道10 μg蛋白。
1.3.5 酶解产物的分子质量分布分析
参考Zhong Chan等[15]的高效液相色谱方法,将样品上样于TSK-gel G 2000 SWXL色谱柱。色谱条件为:进样体积1 μL,流动相为0.1 mmol/L Na2SO4的0.1 mol/L磷酸盐缓冲液(pH 6.7),洗脱流速0.5 mL/min,紫外检测波长230 nm。标准分子质量参照为:L-半胱氨酸(240 Da)、马尿酰-组氨酰-亮氨酸(hippuryl-histidylleucine,HHL)(430 Da)、神经降压素(1 673 Da)、本实验室合成的肽IACGNW(6 640 Da)和小清蛋白(11 950 Da)。使用GPC软件对所得色谱图进行分子质量分布分析。
1.3.6 表面疏水性测定
采用荧光探针剂ANS法[16],具体步骤为:用pH 7.0、10 mmol/L的磷酸盐缓冲溶液将不同DH的酶解产物稀释至0.025~0.1 mg/L。将2 mL样品液加入20 μL 8 mmol/L ANS溶液混匀,于黑暗中反应20 min,测定荧光强度。测试所用激发波长和发射波长分别为390 nm和470 nm,狭缝宽度为10 nm。
1.3.7 溶解性的测定
参考Latorres等[17]方法。称取200 mg鱼蛋白水解物样品,将其溶解在20 mL蒸馏水中,用1 mmol/L HCl或1 mol/L NaOH溶液调节样品pH值至2.0、4.0、6.0、8.0与10.0。混合物30 ℃、100 r/min转速搅拌30 min,然后7 500×g离心15 min。上清液和样品蛋白质含量按照Lowry法测定。样品总蛋白质含量用0.5 mmol/L NaOH溶液溶解后样品蛋白含量表示。蛋白质溶解度计算如式(2)所示:

1.3.8 乳化性与乳化稳定性分析
蛋白乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)的测定参照Xu Xingfeng等[9]方法,并做一定改进。取0.15 g分离蛋白放入50 mL烧杯中,加入15 mL蒸馏水和5 mL葵花仁油,涡旋混匀,用1 mol/L HCl或1 mmol/L NaOH溶液将样品pH值分别调节至2.0、4.0、6.0、8.0与10.0,随后在20 000 r/min条件下高速分散1 min。分别在均质后0、10 min从离心管底部取50 μL乳状液,加入5 mL 0.1% SDS溶液,涡旋10 s,随后在500 nm波长处测定吸光度。EAI、ESI计算如式(3)、(4)所示:

式中:A0为0 min时吸光度;T为浊度(2.303);DF为稀释倍数;ρ为蛋白质量浓度/(g/mL);φ为油在乳状液中的比例(0.25);At为放置10 min后吸光度;Δt为时间差/min。
1.3.9 起泡性与起泡稳定性分析
根据Agyare等[18]方法测定。配制50 mL 1 g/100 mL的蛋白液,用1 mol/L HCl或1 mol/L NaOH溶液分别调pH值至2.0、4.0、6.0、7.0、10.0,放入250 mL的烧杯中,将蛋白悬浮液用高速分散器以10 000 r/min速率搅打1 min,记录搅打前后的体积。起泡能力用体积增加的百分比表示。随后,将搅打起泡的样品静置10 min,记录不同时间段的泡沫体积,其中所有实验平行测量3 次。计算如式(5)、(6)所示:

式中:V1为搅打前的体积/mL;V2为搅打后的体积/mL;V3为搅打后静置10 min的体积/mL。
1.3.10 持油力的测定
参考陈志军等[19]的方法。准确称取分离蛋白水解物0.5 g,并分别置于原质量m1的50 mL离心管中,加入10 mL的葵花籽油,混匀,静置30 min,2 800×g离心30 min,小心去除分离的油层后,称量离心管总质量m2,平行测定3 次,求取平均值。持油力计算如式(7)所示:

1.4 数据统计分析
2 结果与分析
2.1 蓝圆鲹分离蛋白DH与蛋白回收率

图1 酶解时间对蓝圆鲹分离蛋白DH和蛋白回收率的影响Fig. 1 Effect of hydrolysis time on DH and protein recovery
由图1可知,在碱性蛋白酶作用下蓝圆鲹分离蛋白的DH和蛋白回收率随着反应时间的延长而增加。在前120 min,分离蛋白DH增幅较大,而随后的DH增幅逐渐减缓。当反应到180 min后,DH与蛋白回收率几乎没有变化,第180分钟时DH和蛋白回收率分别为21.51%和51.21%,这可能是因为酶解过程中产生的产物抑制效应、酶的热失活以及特异性酶解位点的减少等因素的共同影响所导致。这与Xia Yichen等[20]在酶解大麦谷蛋白中DH和蛋白溶解性随时间变化的趋势一致。
2.2 SDS-PAGE分析
根据图1的水解曲线,选取DH为5%、10%、15%与20%的样品(分别记为DH5、DH10、DH15、DH20),对全蛋白与酶解上清液中蛋白进行SDS-PAGE分析,并与未酶解的分离蛋白进行比较,结果如图2所示。酶解蛋白上清液中(图2A),仅DH5的样品中可观察到组分中10~20 kDa之间蛋白条带,其后的酶解样品上清液中均无明显的蛋白条带,推测其上清液中主要组成可能为寡肽类小分子物质。对酶解样品的全蛋白(图2B)进行分析,发现随着酶解进行,蓝圆鲹分离蛋白中的肌球蛋白重链与肌动蛋白发生强烈降解,且产生的酶解产物主要集中在20~60 kDa范围。其中,泳道2、3更高分子的蛋白条带可能是伴肌动蛋白等肌原纤维蛋白中更大分子质量的蛋白。当DH为15%以上时,全蛋白组分中蛋白主要为15 kDa以下的小分子蛋白。结合图2A(上清液)与图2B(全蛋白)的蛋白分布情况,可知随着酶解时间的延长,依旧存在部分不溶解的蛋白组分,其分子质量分布于10~30 kDa之间,推测其可能是酶解过程中释放出来的疏水性较强的多肽片段,这与图1中蛋白溶解度的结果一致。刘书来等[21]分别利用3 种蛋白酶(使用量为250~500 U/g)对鲢鱼肌原纤维蛋白进行限制性酶解,发现DH为5%时,其肌原纤维蛋白的降解条带主要集中在20~30 kDa范围,这与本实验的结果基本一致。由于未酶解分离蛋白的溶解性较低(图1),因此在之后实验中主要对不同DH的酶解上清液组分(以下简称酶解产物)进行比较分析。
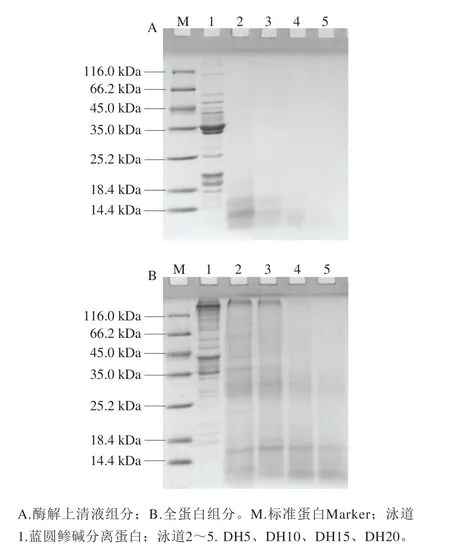
图2 蓝圆鲹分离蛋白酶解产物SDS-PAGE分析Fig. 2 SDS-PAGE profiles of protein isolate of blue round scads and its hydrolysates at different DHs
2.3 蓝圆鲹分离蛋白酶解产物的分子质量分布
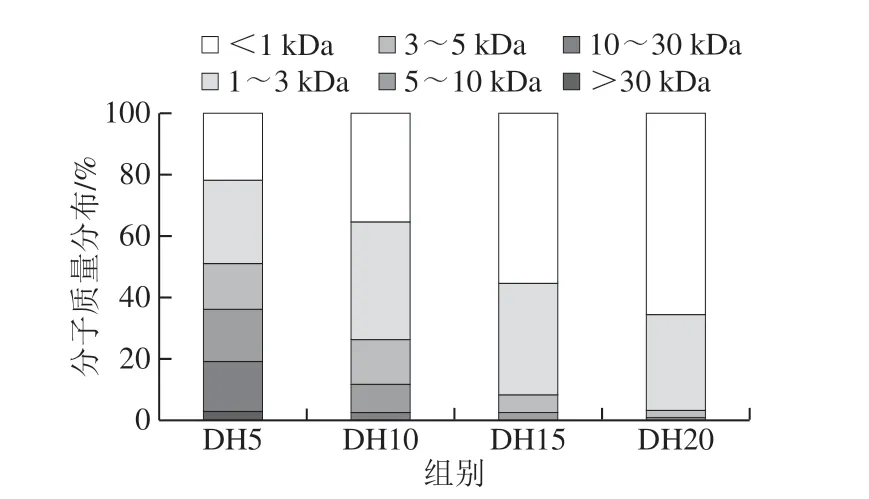
图3 不同DH酶解产物的分子质量分布Fig. 3 Molecular mass distribution of blue round scad protein isolate hydrolysates at different DHs
由图3可知,随着水解反应的进行,大分子的多肽逐渐被分解成大小不一的寡肽。DH为5%时,大于30 kDa有2.61%,10~30 kDa有16.1%。DH为10%时,5~10 kDa有9.4%,3~5 kDa有14.8%。当DH在15%以上,分子质量小于3 kDa的组分所占比例增大,分别为91.8%和96.8%,这与图2中酶解产物的电泳图结果一致。Morales-Medina等[22]利用枯草芽孢杆菌蛋白酶对沙丁鱼和马鲛鱼肌肉蛋白进行酶解时,也发现类似的现象。
2.4 表面疏水性分析

图4 不同DH酶解产物的表面疏水性Fig. 4 Surface hydrophobicity of blue round scad protein isolate hydrolysates at different DHs
如图4所示,与分离蛋白(全蛋白)相比,酶解产物的表面疏水性随DH的增加呈先上升后下降的趋势,其中DH为5%时酶解产物所呈现的表面疏水性最高,其后则逐渐降低。这说明适度的酶解有助于将原本埋藏在蛋白内部的疏水基团暴露在溶液当中,进而使其表现出更高的疏水性[23]。而随着水解的进一步进行,释放出的肽段进一步通过离子键或氢键作用与大分子蛋白结合,并掩盖蛋白表面的疏水氨基酸残基,进而使其整体的表面疏水性降低[24]。这与Liu Yongle等[25]在碱性蛋白酶酶解鱼糜的结果一致。
2.5 pH值对酶解产物溶解度的影响

图5 pH值对不同DH蓝圆鲹分离蛋白酶解产物溶解度的影响Fig. 5 Solubility of blue round scad protein isolate hydrolysates at different DHs as influenced by pH
如图5所示,酶解产物的溶解度随着DH的增加而增加,且在pH 2.0、7.0以及10.0溶解度均具有较好的溶解性,溶解度达80%以上。当DH为20%,pH 10.0时,酶解产物的溶解度达到最大值((98.3±1.45)%)。当溶液pH 4.0时,所有酶解产物的溶解度均达到最低值,推测该pH值接近酶解产物的等电点,此时蛋白之间的分子作用力减小,容易发生聚集,从而导致溶解度降低[26]。与其他DH相比,DH20的酶解产物具有更高的溶解度,表明酶解能进一步将原本因疏水而易絮凝沉淀的蛋白分解成更小分子肽段,使其溶解于水相中,进而提高了酶解产物的溶解性[22]。
2.6 乳化性与乳化稳定性分析

表1 pH值对蓝圆鲹分离蛋白酶解产物乳化性质的影响Table 1 Effect of pH on emulsifying properties of blue round scad protein isolate hydrolysates
如表1所示,与未酶解分离蛋白上清液组分相比,酶解产物在不同pH值条件下的EAI均得到不同程度的提升(pH 4.0除外)。但随着DH的增加,EAI呈现逐渐下降趋势。其中,DH为5%时EAI最高,在pH 10.0有最高的EAI为(100.87±0.65)m2/g,为未酶解对照组的5 倍以上。此外,DH15与DH20组的EAI与ESI明显低于DH5与DH10。酶解产物的分子质量对乳化性质具有重要影响。一定的DH范围内,蛋白分子质量的减少有利于提升表面疏水性与溶解性。此外,酶解过程中释放的肽段也会增强蛋白分子间的电荷作用,有助于在一定程度上提高蛋白的乳化性[21]。而过度水解则会导致蛋白的肽链变短,无法在乳液油滴界面上形成黏弹性的膜,从而使其乳化性降低[27]。所有样品在pH 4.0时EAI和ESI均为最小值,这是由于pH 4.0接近酶解产物的等电点,酶解产物中各蛋白片段的表面电荷减小,分子间相互作用减弱,进而导致乳化性下降[17]。相对地,当pH 10.0时所有的酶解产物EAI最高,这可能是由于在碱性条件下,酶解产物分子表面电荷增强,会诱导蛋白展开,增强酶解产物的乳化性[27]。另一方面,当DH为5%,酶解产物具有相对较高的ESI,其中pH 7.0与pH 10.0的ESI明显高于pH 4.0与pH 2.0。酶解产物的溶解性是决定蛋白功能特性的重要因素。在本实验中,DH为5%时的酶解产物在pH 2.0与pH 4.0时的溶解度明显低于pH 7.0与pH 10.0,这可能是其ESI较低的重要原因。
2.7 起泡性与起泡稳定性分析
如表2所示,随着DH的增加,酶解产物的起泡性和起泡稳定性呈先上升后下降的趋势,DH为5%的酶解产物的起泡性最大((227.3±3.8)%),当DH增加到10%时,酶解产物的起泡性反而下降。这与陈志军等[25]使用碱性蛋白酶和复合蛋白酶酶解鱼糜加工副产物的结果一致。起泡性的增加是因为酶解使得蛋白的溶解度显著增加,从而使更多的多肽能够吸附到界面,有利于液膜的形成[28]。随着酶解程度的增加,起泡性和起泡稳定性下降,这是因为过度水解破坏了蛋白的结构,对蛋白的起泡能力和起泡稳定性产生不利影响[16]。与表1结果相似,所有酶解产物在pH 4.0时的起泡性和起泡稳定性最差,这与酶解产物在接近等电点时溶解性降低有关[25]。刘书来等[21]采用胰蛋白酶、中性蛋白酶及复合酶对鲢鱼肌原纤维蛋白进行限制性酶解,结果发现复合蛋白酶酶解40 min时,蛋白的起泡性达到最高值(110%),并认为酶解时所使用的蛋白酶与DH对酶解产物的蛋白功能特性具有重要影响。相比之下,本研究酶解产物具有更高的起泡性,这可能与酶解蛋白的不同有关。本研究中酶解蛋白为分离蛋白,其不仅含有肌原纤维蛋白,还包含了较高含量的水溶性蛋白,因此在蛋白的整体溶解性上优于单纯肌原纤维蛋白样品。

表2 pH值对不同DH蓝圆鲹分离蛋白酶解产物起泡特性的影响Table 2 Foaming properties of blue round scad protein isolate hydrolysates at different DHs as influenced by pH
2.8 持油力分析

图6 不同DH酶解产物的持油力Fig. 6 Oil-holding capacity of blue round scad protein isolate hydrolysates at different DHs
由图6可知,蛋白经酶解后,持油力先提高后降低,DH在15%以下时,持油力为3.00 g/g(油/蛋白)以上,其中,DH5的持油力最高,达3.50 g/g。而当DH为20%时,持油力仅为1.20 g/g。蛋白对油脂的吸附力与其表面疏水性以及暴露在蛋白表面的氨基酸残基侧链的非极性基团有关[29]。在本研究中,适度的酶解能有效增强分离蛋白的表面疏水性(图1)与蛋白的溶解性(图2),使得蛋白与油脂的接触率与亲和力提高,故而其持油力显著提升。值得一提的是,蛋白的持油力是一种物理阻隔作用,过度的酶解则会导致酶解产物全部转化为较小的小肽和游离氨基酸,无法有效阻隔油脂,因此导致持油力下降[30]。
3 结 论
本实验利用碱性蛋白酶对蓝圆鲹分离蛋白进行酶解,研究不同DH蓝圆鲹分离蛋白酶解产物的功能性质。结果表明,通过限制酶解可以显著提高分离蛋白的溶解性、乳化性、起泡性及持油力等功能性,其中DH为5%时酶解产物的蛋白功能性最佳,但继续增加DH,蛋白功能性反而呈现逐渐下降趋势,这说明酶解程度对开发利用蓝圆鲹分离蛋白有关键影响。本研究酶解产物DH5在pH 2.0、pH 7.0以及pH 10.0均具有较好的起泡性与溶解性,表明其在未来蛋白饮料方面具有良好应用前景。此外,酶解产物还具有良好持油力,也表明其可以应用于肉糜制品的油脂乳化之中。综上所述,本研究结果可为蓝圆鲹分离蛋白在食品配料蛋白中的应用提供一定的理论参考。

