薏苡仁油对小鼠肠道菌群及炎症因子的影响
王 韬 费建东 聂双发 李 磊
河北北方学院附属第一医院胃肠外科,河北张家口 075000
薏苡仁油,是从薏苡仁中提取出的一种活性成分,在中医上具有益气养阴、消症散结的功效。中药的药效与肠道菌群存在着密切的联系,进入消化道的中药不可避免与肠道菌群接触,会对肠道菌群结构产生调节作用或其他影响[1]。有些补益类中药会促进肠道内某些益生菌的生长、繁殖,而某些清热解毒类中药会抑制一些有害菌的生长、繁殖及炎症因子的表达[2]。近年来,肠道菌群的相关研究一直是热点[3-5],但还未有相关研究对薏苡仁油是否对肠道菌群有调整作用进行验证。因此,本文旨在探讨薏苡仁油对小鼠肠道菌群失衡的调控研究,以及其对肠道炎症因子表达的影响。
1 材料与方法
1.1 实验动物
3 月龄SPF 级健康雄性昆明小鼠75 只,购自上海斯莱克实验动物有限公司,体重(20±2) g,实验动物生产许可证号:SCXK(沪)2017-0005,实验动物均已通过伦理委员会审批。
1.2 主要试剂
薏苡仁油(批号:1503163-1)购于浙江康莱特药业公司;盐酸林可霉素(批号:L0166-201408)购于百灵威科技有限公司;Qiagen RNeasy Mini Kit 试剂盒(货号:74104)购于北京碧橙蓝生物科技有限责任公司;cDNA 逆转录试剂盒 (TOYOBO)(货号:fsq-101)购于上海松雷生物科技有限公司;SYBR Green 染料(TOYOBO)(货号:QPK-201)购于北京索莱宝科技有限公司。
1.3 方法
1.3.1 实验动物造模与分组 按照随机数字表法将小鼠分为5 组,即空白对照组、造模组、低剂量组、中剂量组、高剂量组,每组15 只。造模使用林可霉素灌胃干扰小鼠肠道菌群,0.3 mL/次,2 次/d,连续灌胃3 d,小鼠出现腹泻现象,气相色谱法检测小鼠粪便中的短链脂肪酸乙酸、丙酸、丁酸,对应的出峰时间没有出峰,即建模完成。空白对照组采用等剂量的生理盐水进行灌胃,0.3 mL/次,2 次/d,连续灌胃3 d。造模过程中无模型的脱落。
造模后,造模组和空白对照组给予0.33 g/(kg·d)生理盐水,低、中、高剂量组分别给予0.17、0.33、1.00 g/(kg·d)薏苡仁油进行灌胃30 d,实验完成后颈椎脱臼处死小鼠,称其体重。严格按照无菌操作规范,取出实验所需结肠,行后续实验分析。
1.3.2 苏木精-伊红(HE)染色 取一部分结肠,用甲醛固定,固定好的组织冲洗过夜后,分别用70%、80%、90%、95%、95%、100%、100%乙醇进行脱水各1 h,石蜡包埋,切成4 μm 切片,HE 染色,封片。显微镜观察。
1.3.3 肠道菌群的测定 在无菌条件下,在结肠样本中各刮出0.2 g 肠道内容物,1 mL 无菌水稀释,转入灭菌eppendorf(EP)管中。随后震荡30 min 充分混匀后,吸取0.5 mL 转入另一EP 管内,继续震荡10 min。稀释到10-6mmol/L 后,将最后的样品吸取50 μL 涂布到无菌选择性培养基中,每个稀释度做3 个重复样本。在37℃条件下,双歧杆菌、乳酸杆菌在无菌厌氧环境下培养24 h,肠球菌、肠杆菌在普通环境下培养24 h进行计数,取其平均值。参考《保健食品检验与评价技术规范(2003 年版)》[6]要求培养后统计其菌落总数,结果以常用对数值logCFU/g 表示。
1.3.4 炎症因子的测定 用液氮研磨法将冷冻小鼠回肠组织匀浆,用不含EDTA 的胰酶消化收集,收集总数约为1×106个细胞。取5×105个/mL 接种于6 孔板中,每孔2 mL 培养液,用trizol 法提取总RNA。弃去培养液,取总RNA(根据浓度计算体积)1 μg,利用逆转录试剂盒进行逆转录反应。PCR 反应体系(20 μL)为cDNA 第一链产物1 μL,DreamTaq Green PCR Master Mix(2×) 10 μL,10 μmol/L 上游引物0.2 μL,10 μmol/L 下游引物0.2 μL,ddH2O 为8.6 μL。上述反应体系振荡混匀后置于PCR 仪中进行循环扩增。扩增条件为95℃预变性3 min,58℃退火30 s,72℃延伸1 min,持续30 个循环。取每组PCR 产物各5 μL 在琼脂糖凝胶(1.5%)电泳30 min 后,用凝胶成像系统扫描、分析,以白细胞介素(IL)-6、趋化因子2(CCL2)、IL-1α、IL-1β 与内参β-肌动蛋白(β-actin)积分吸光度IA 比值进行分析,实验重复3 次。具体引物序列如表1。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,多组间比较用采用方差分析,进一步两两比较采用SNK-q 法。以P < 0.05为差异有统计学意义。

表1 各组基因引物序列
2 结果
2.1 各组小鼠结肠组织病理形态观察
空白对照组小鼠结肠黏膜结构完整,肠绒毛正常,无炎症细胞浸润;造模组小鼠结肠黏膜结构破坏,层次不清,弥漫炎症细胞浸润;低剂量组小鼠结肠黏膜结构基本完整,肠绒毛减少,炎症细胞浸润于肠绒毛内及上皮全层;中剂量组小鼠结肠黏膜结构基本完整,肠绒毛减少,炎症细胞较少,只浸润于肠绒毛内;高剂量组小鼠结肠黏膜结构完整,肠绒毛正常,基本无炎症细胞浸润。见图1。

图1 各组小鼠结肠组织病理形态(HE,400×)
2.2 各组小鼠结肠菌群结果比较
造模组小鼠结肠中肠球菌、肠杆菌计数高于空白对照组;双歧杆菌、乳酸杆菌计数低于空白对照组,差异均有统计学意义(均P < 0.05)。低、中、高剂量组小鼠结肠中肠球菌、肠杆菌低于造模组;双歧杆菌、乳酸杆菌高于造模组,差异均有统计学意义(均P < 0.05)。各剂量组间各结肠菌群结果比较,差异均有统计学意义(均P < 0.05)。见表2。
表2 各组小鼠结肠菌群结果比较(logCFU/g,)

表2 各组小鼠结肠菌群结果比较(logCFU/g,)
注:与空白对照组比较,aP < 0.05;与造模组比较,bP < 0.05;与低剂量组比较,cP < 0.05;与中剂量组比较,dP < 0.05
2.3 各组小鼠体重比较
第0、15、30 天,造模组小鼠体重低于空白对照组,差异均有统计学意义(均P < 0.05)。第15 天,中、高剂量组小鼠体重高于造模组,差异均有统计学意义(均P < 0.05)。第30 天,低、中、高剂量组小鼠体重高于造模组,差异均有统计学意义(均P<0.05)。第15、30天,各济量组间小鼠体重比较,差异有统计学意义(P <0.05)。见表3。
表3 各组小鼠体重比较(g,)

表3 各组小鼠体重比较(g,)
注:与空白对照组比较,aP < 0.05;与造模组比较,bP < 0.05;与低剂量组比较,cP < 0.05;与中剂量组比较,dP < 0.05
2.4 各组小鼠炎症因子比较
造模组IL-6、CCL2、IL-1α、IL-1β 水平高于空白对照组;低、中、高剂量组IL-6、CCL2、IL-1α、IL-1β水平低于造模组,差异均有统计学意义(均P < 0.05)。各剂量组间差异有统计学意义(P < 0.05)。见表4。
表4 各组小鼠炎症因子比较(pg/mL,)
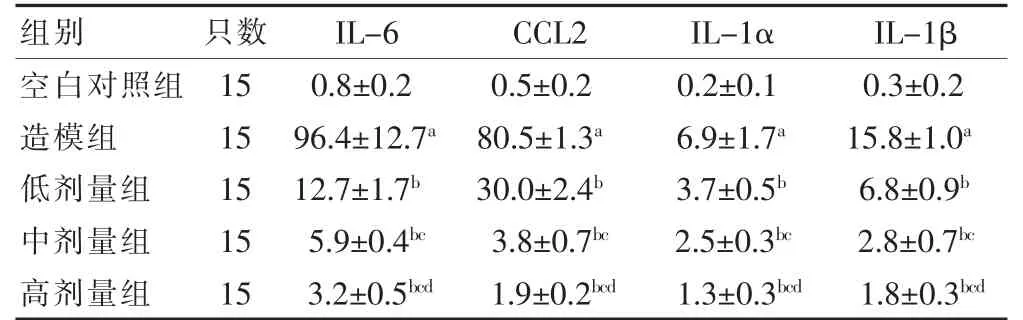
表4 各组小鼠炎症因子比较(pg/mL,)
注:与空白对照组比较,aP < 0.05;与造模组比较,bP < 0.05;与低剂量组比较,cP < 0.05;与中剂量组比较,dP < 0.05
3 讨论
禾本植物薏苡的成熟种仁主要含蛋白质、脂肪、碳水化物[7]。《中华人民共和国药典》[8]里提到其种仁可以清热解毒、健脾止泻、镇痛、可供食用,在中医中用于治疗水肿、脚气、小便不利、脾虚泄泻、湿痹拘挛、肺痈、肠痈、赘疣、癌肿。薏苡仁油是从薏苡仁中提取得到的脂肪油。研究发现[9-11],薏苡仁油中的主要成分有薏苡仁酯、薏苡内酯、棕榈酸、硬脂酸、十八碳一烯酸、十八碳二烯酸、肉豆蔻酸、甾醇类、角鲨烯和维生素E等。以薏苡仁油为主要成分的抗肿瘤药物康莱特注射液已经在临床上广泛应用[12-13],但薏苡仁油药理方面的研究不仅仅局限于抗肿瘤,也能够改善菌群失衡、抑制炎症因子的功能。
微生物与健康的关系一直是人们关注的话题,但长期以来对肠道微生物与健康关系的了解却非常有限。随着新的研究方法的不断出现,肠道微生物对人类健康的影响重新引起重视,成为当前生命科学和医学的研究热点[14-18]。肠道微生物又被认为是人体的第二基因组,与人体基因组一起,通过与环境因素的相互作用,通过不同方式影响健康[19]。肠道就是免疫系统的最前线的基地。体内约70%的免疫细胞集中在肠黏膜,而且使这些免疫细胞活化的,正是肠道细菌[20-21]。本研究结果发现,低、中、高剂量组小鼠结肠中肠球菌、肠杆菌低于造模组;双歧杆菌、乳酸杆菌高于造模组(均P < 0.05)。提示薏苡仁油对林可霉素小鼠模型的肠道菌群失衡具有很好的调节作用。此外,薏苡仁油还能够增加菌群失衡小鼠的体重,间接说明小鼠各脏器蛋白合成能力提高。
研究显示[22-24],炎症性肠病被认为是肠道微生物失衡产生的刺激,引发遗传易感个体对肠道共生菌的异常免疫应答,进而造成肠道损伤。许多中药都有调节肠道微生态平衡的作用[25-27]。通过各组小鼠结肠组织病理形态观察可见,菌群失衡小鼠结肠黏膜结构破坏、层次不清、弥漫炎症细胞浸润,薏苡仁油能够改善结肠黏膜直至接近正常。
IL-6、CCL2、IL-1α、IL-1β 为人体的前炎症因子,对于炎症反应有很大的预示作用,因此本研究测量了这些前炎症因子,反映了小鼠整体的炎症情况[28-32]。其中IL-1、IL-6 是由一组单核巨噬细胞、内皮细胞产生的细胞因子,具有激活T、B 细胞分化,增强自然杀伤细胞杀伤靶细胞,促进吞噬功能,也是机体炎症反应和一系列病理生理过程的重要炎症介质。CCL2 在感染或损伤过程中产生高浓度,并决定炎症性白细胞向受损区域的迁移。对肠道炎症因子的检测结果发现,薏苡仁油有效地抑制了林可霉素小鼠模型肠道炎症因子IL-6、CCL2、IL-1α、IL-1β 的表达。因此,薏苡仁油的应用不应仅仅局限于癌症治疗,还可以扩展到炎症性肠病的治疗中。
综上所述,薏苡仁油可改善小鼠的肠道菌群失衡,并抑制肠道炎症因子表达。随着科学的进步,人类将更深入地从细胞、分子、基因水平对薏苡仁油的功效与临床应用进行更深入的研究。

