植物非组蛋白赖氨酸乙酰化修饰的蛋白质组学研究进展
郑璐 沈仁芳,2 兰平,2
(1. 中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京 210008;2. 中国科学院大学,北京 100049)
蛋白质赖氨酸乙酰化(Nε-lysine acetylation)是一种在原核生物和真核生物都广泛存在的重要的蛋白质翻译后修饰(Post-translational modifications,PTMs)[1-4]。赖氨酸乙酰化酶(Lysine acetyltransferases)催化乙酰基转移到赖氨酸的ε-氨基侧链形成蛋白质的乙酰化修饰,同时这一反应可以被赖氨酸去乙酰化酶(Lysine deacetylases)逆转。植物线粒体中一些赖氨酸乙酰化修饰也可以通过非酶促反应发生[5]。
赖氨酸乙酰化包括组蛋白和非组蛋白的乙酰化修饰。1964年,Allfrey等[6]在牛胸腺细胞核染色体的组蛋白上首次发现了赖氨酸乙酰化修饰。真核生物染色体由核心组蛋白八聚体(H2A、H2B、H3和H4)和其缠绕的146 bp的DNA组成了基本单位核小体[7]。组蛋白赖氨酸乙酰化修饰主要发生在核心组蛋白的N末端,是影响染色体结构的重要翻译后修饰。赖氨酸乙酰化有利于组蛋白和DNA八聚体的解离,核小体松弛,从而使各种转录因子能够与DNA结合位点特异性结合,控制基因的表达水平[8]。大量研究表明,组蛋白通过乙酰化修饰可逆而快速的变化在植物生长发育和非生物/生物胁迫响应中发挥着重要的调控作用[8-10]。
1997年,Gu和Roeder[11]在 人 肿 瘤 抑 制 因子p53上首次发现了乙酰化修饰参与非组蛋白的转录调控。随后,基于乙酰化肽段的免疫亲和纯化(Acetylpeptides immune affinity purification)和液相色谱-串联质谱(Liquid chromatography - tandem mass spectrometry,LC-MS/MS)的乙酰化蛋白质组(Acetylproteome)技术不断发展[12],大量非组蛋白赖氨酸乙酰化修饰被发现。2006年,Kim等[13]首次报道了HeLa细胞和小鼠肝脏线粒体的乙酰化蛋白质组,一共鉴定了195个乙酰化蛋白质,且大部分为非组蛋白。随后,Lundby等[14]在小鼠的不同组织中一共鉴定到4541个乙酰化蛋白质(15474个修饰位点),主要参与基因表达、蛋白质代谢、三羧酸(Tricarboxylic acid,TCA)循环和细胞凋零等代谢过程。Zhang等[4]在原核生物大肠杆菌(Escherichia coli)中也鉴定到了91种乙酰化蛋白质,主要为代谢酶和调节因子。这些都表明赖氨酸乙酰化修饰在非组蛋白中大量存在,且这种翻译后修饰的调控方式从细菌到哺乳动物在生物进化上是相对保守的。非组蛋白的乙酰化修饰通过调控酶活力[15-16]、蛋白质相互作用[17]和蛋白质稳定性[18]等方式调控各种生物学过程。目前,随着乙酰化蛋白质组学技术的普及,植物中普遍存在的大量非组蛋白赖氨酸乙酰化修饰被发现。本文综述了植物中非组蛋白赖氨酸乙酰化修饰的蛋白质组学研究进展,阐述其特征以及在植物生长发育和环境胁迫中的响应和作用,旨在为乙酰化修饰介导的调控机理和相关实际应用奠定理论基础。
1 植物乙酰化蛋白质组学技术的发展
过去大量研究局限在植物组蛋白的乙酰化修饰调控。近十年来,植物的非组蛋白乙酰化修饰越来越受到研究者的关注。乙酰化蛋白质组学在多种植物中展开,主要集中在模式植物拟南芥和粮食作物水稻和小麦,还包括一些经济作物大豆、茶树和草莓等(表1)。随着乙酰化蛋白质组学技术的日益成熟和发展,植物乙酰化蛋白质组学鉴定到的非组蛋白乙酰化蛋白质数量从不足一百增加到几千,并且从定性的静态分布研究拓展到了不同时空下的乙酰化的定量动态变化,极大加深了对植物非组蛋白赖氨酸乙酰化修饰的时空变化特征和潜在的生物学功能的认知。
目前,植物乙酰化蛋白质组研究大多采用乙酰化肽段的特异性抗体亲和富集技术结合LC-MS/MS进行分析(表1)。该方法的基本流程如图1所示。植物样品一般采用TCA-丙酮法提取总蛋白,提取的蛋白质采用过滤辅助样品制备法(Filter-aided sample preparation,FASP)进行胰蛋白酶酶解成肽段,然后其中的乙酰化肽段采用特异性抗体树脂进行富集。富集的乙酰化肽段脱盐后进行LC-MS/MS质谱分析以及蛋白质定性和定量分析。最后进行生物信息学分析,包括蛋白质功能富集和蛋白质互作网络分析等。与常规蛋白质组学相比,乙酰化蛋白质组学还需要对乙酰化修饰位点的基序进行分析。一般对乙酰化位点上下游10个氨基酸进行肽段序列分析,解析其保守肽段特征。
早期的植物蛋白乙酰化蛋白质组学研究虽然也采用了赖氨酸乙酰化抗体的免疫亲和层析富集技术,但是受质谱分辨率和精密度等因素影响[42-43],鉴定到的乙酰化蛋白质数量相对较少[19,20,24]。2011年,Finkemeier等[19]在拟南芥不同器官中只鉴定到74个乙酰化蛋白质和91个乙酰化位点。2014年,Nallamilli等[24]在水稻悬浮细胞中只鉴定到40个乙酰化蛋白质和66个乙酰化位点。但是,这些研究初步表明了乙酰化修饰不仅存在于组蛋白,而且广泛存在于植物不同组织的非组蛋白,参与多种代谢过程。近年来,通过高效的固定化抗乙酰化赖氨酸抗体(Anti-acetyllysine antibodies)亲和纯化技术来富集乙酰化肽段,增加了低丰度肽段的检出率,同时随着质谱分辨率的提高,极大地提高了修饰肽段检测的准确度和灵敏度[44-46]。这些技术的创新使得乙酰化蛋白质组学鉴定到的乙酰化修饰的非组蛋白及其修饰位点的数量显著增加。目前,植物乙酰化蛋白质组学鉴定到的蛋白质数量及其对应的乙酰化位点大多可以超过600个和1000个(表1)。研究者在发育中的水稻花药[28]、水稻幼苗叶片[32]、茶树幼苗叶片[40]中分别鉴定到了676个、866个和1286个乙酰化蛋白质,对应有1354个、1353个和2229个乙酰化位点。这些组学研究夯实了非组蛋白赖氨酸乙酰化修饰在植物中的普遍存在性,广泛参与各个代谢途径。
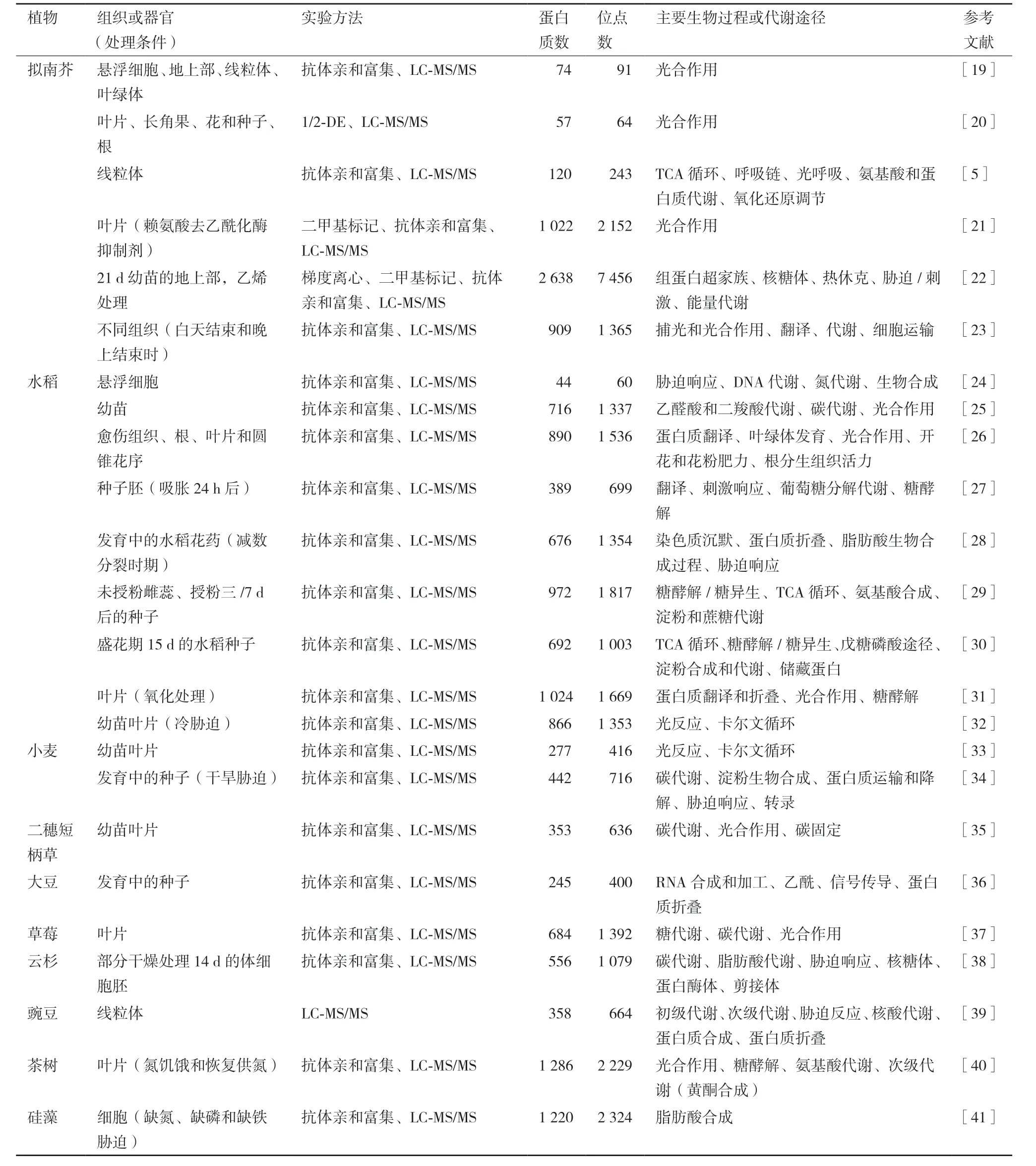
表1 植物乙酰化蛋白质组研究
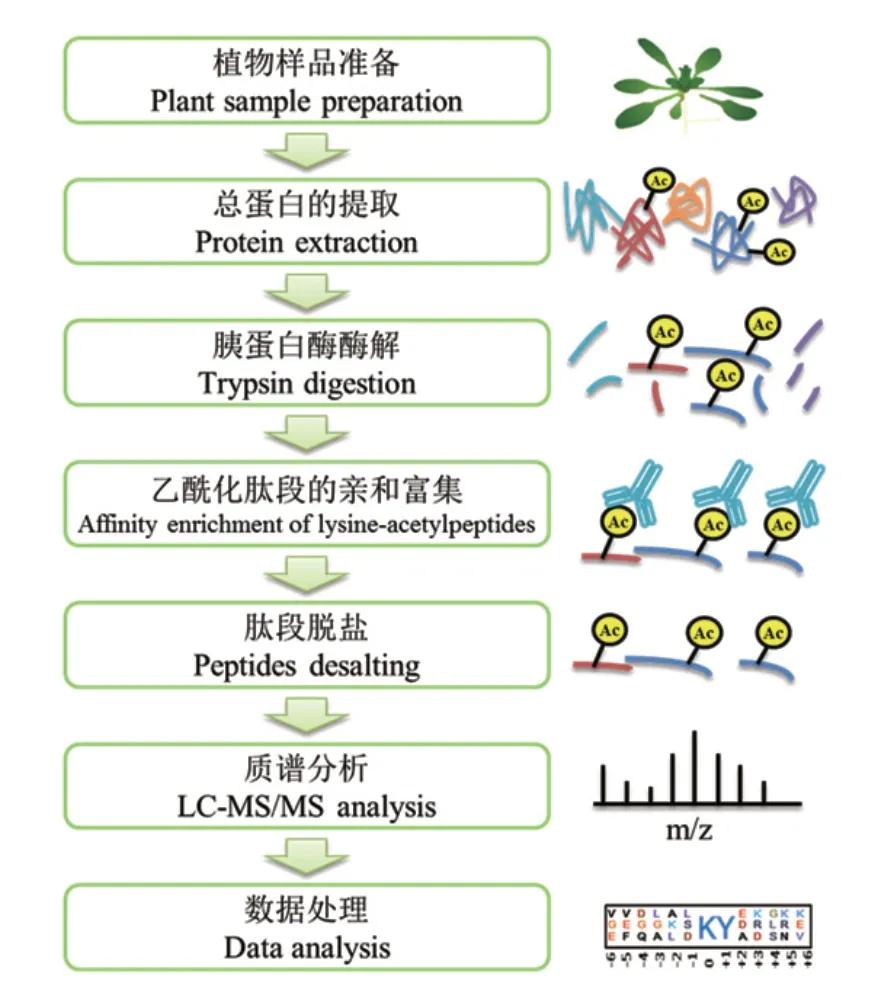
图1 基于抗体亲和富集的乙酰化蛋白质组学实验流程
2018年,Liu等[22]对植物乙酰化蛋白质组学方法进行了改进,提出了基于氯化铯密度梯度(CsCl density gradient,CDG)离心的蛋白质分离和二甲基标记的4C定量的翻译后修饰组学研究方法。与过去常规乙酰化蛋白质组学相比,该方法首先对提取的蛋白质样品进行CDG离心,将蛋白质分级成上中下3层再分别进行后续分析,这有利于乙酰化修饰的膜蛋白富集。同时,不同处理的酶解肽段分别等分成2份进行轻同位素(12CH3,~28 Da)和重同位素(13CD2H,~34 Da)的二甲基标记,然后交换混合样品后,再进行抗体亲和富集和LC-MS/MS分析。最后,乙酰化蛋白质通过Mascot和SQUA-D进行定性和定量分析。该方法对拟南芥幼苗的地上部进行乙酰化修饰分析,成功鉴定到了2638个不同的乙酰化蛋白的7456个乙酰化位点,其中有4228个乙酰化位点为首次鉴定。目前为止,该研究在拟南芥中鉴定到乙酰化蛋白质数量最多,大大超过其它拟南芥或其它植物乙酰化蛋白质组分析鉴定到的600个左右的蛋白质(表1)。这些乙酰化蛋白质主要为组蛋白超家族、核糖体蛋白、热休克蛋白以及胁迫/刺激和能量代谢相关的蛋白质。新鉴定的乙酰化蛋白质主要是一些细胞运输蛋白、膜结合受体和受体激酶,参与油菜素类固醇、光、重力和发育信号传导等过程。该研究也再一次扩大了非组蛋白乙酰化修饰参与的生物学过程。乙酰化蛋白质组学在蛋白质提取纯化[22]、肽段富集以及质谱分析[44-46]的技术改进都提高植物非组蛋白乙酰化蛋白质定性和定量能力。今后,随着样品制备方法的成熟以及高通量质谱检测灵敏度的提高[47-48],乙酰化修饰鉴定将更快速高效。未来对植物中非组蛋白赖氨酸乙酰修饰进行深度精准的的动态分析,将为后续乙酰化修饰调控机制研究提供可靠的数据支撑。
2 赖氨酸乙酰化修饰蛋白质的空间分布
非组蛋白赖氨酸乙酰化修饰广泛存在于植物不同组织、器官和细胞器中,且空间分布具有特异性。在植物不同组织器官中,乙酰化蛋白质的种类和丰度都具有显著差异[20,23]。通过免疫印迹法分析,拟南芥叶片、长角果、花、种子和根中的乙酰化蛋白质的丰度存在明显的差异[20]。Uhrig等[23]通过乙酰化蛋白质组学研究也表明乙酰化蛋白质在拟南芥不同组织中的种类和丰度都存在差异,在幼苗(地上部和根系)、莲座叶、根、花(花萼和花瓣)和长角果分别鉴定到351、199、526、146和160个乙酰化蛋白质。水稻愈伤组织、叶片、圆锥花序和根系4个典型组织的乙酰化蛋白质组分析发现,170个乙酰化蛋白质是4个组织中共有的,而97、93、27和44个乙酰化蛋白质是分别在愈伤组织、叶片、圆锥花序和根系中所特有的[26]。
植物不同的亚细胞器中乙酰化蛋白质的种类和丰度也具有显著差异。本文对不同植物叶片中的乙酰化蛋白质的亚细胞定位的分布情况进行比较[21,31,33,35,37-38,40],结果(图 2)显示,90%左右的乙酰化蛋白质主要定位在叶绿体、细胞质、细胞核和线粒体。而质膜、细胞骨架、内质网和过氧化酶体等细胞器中鉴定到的乙酰化蛋白质含量极低。但是,Liu等[22]采用CDG梯度分级提取蛋白质的4C定量乙酰化蛋白质组学在拟南芥幼苗地上部鉴定到很多内质网、高尔基体和质膜上的乙酰化蛋白质,这是基于常规蛋白质提取方法的乙酰化蛋白质组学没有发现的。因此,乙酰化蛋白质提取和富集过程中的偏好性、蛋白质降解以及脱乙酰化等都可能造成内质网和高尔基体等细胞器中鉴定到的蛋白质数量偏低[22]。
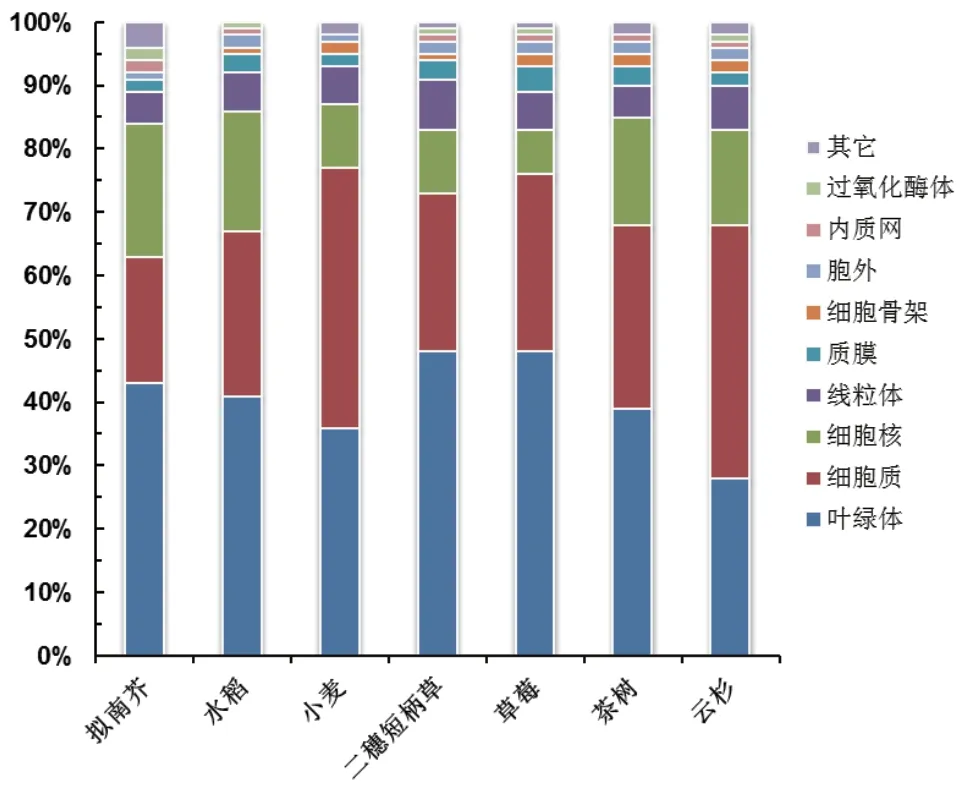
图2 不同植物叶片乙酰化修饰蛋白质的亚细胞定位分布情况的比较
乙酰化蛋白质在植物叶片的叶绿体中比例最高,可以达到40%左右(图 2)。叶绿体是植物光合作用发生的最主要的细胞器,这也表明乙酰化修饰可能在光合作用中发挥重要的调控作用。相一致地,乙酰化蛋白质组学在植物叶片的叶绿体中发现了大量光合作用相关的蛋白质发生了极其显著的乙酰化修饰[19-20,33,35,37]。早期拟南芥的乙酰化蛋白质组就发现,光系统(Photosystem II,PSII)亚基和捕光色素蛋白(Light-harvesting chlorophyll a/bbinding proteins,LHC a/b)、以及卡尔文循环(Calvin cycle)中关键酶核酮糖-1,5-二磷酸羧化酶/加氧酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO)和磷酸甘油酸酯激酶(Phosphoglycerated kinase,PGK)都具有乙酰化修饰[19-20]。Zhang等[33]发现,小麦幼苗叶片捕光复合体(Light-harvesting complex,LHC)的4个 亚 基(LHCa1、LHCb3、LHCb5和LHCb6)、PS I的 两 个 亚 基(PsaA和PsaB)、PSII的4个 亚 基(PsbO、PsbP、PsbH和Psb28)以及类囊体膜中催化PSII到PSI复合体之间的电子转移的细胞色素复合体(Cytochrome complex,Cyt)的3个亚基(Cyt b6、Cyt f和PetD)都具有很多的乙酰化修饰位点。小麦叶片中大量卡尔文循环的代谢酶也发生了乙酰化修饰,特别是RuBisCO中含有13个乙酰化修饰位点。RuBisCO的大量乙酰化修饰在不同的植物中都普遍存在[21,31,35,37]。研究表明,拟南芥中RuBisCO的乙酰化修饰会显著影响其三级结构形成和酶活力,进而影响光合作用的速率[19]。组蛋白脱乙酰基酶14(Histone deacetylase 14,HDA14)是叶绿体中的RPD3/HDA1类蛋白质,其大多数靶蛋白质具有光合作用[21]。HDA14功能缺失突变体的分析表明,RuBisCO的活化状态在弱光条件下受RuBisCO活化酶(RuBisCO activase)的赖氨酸乙酰化作用控制。这些蛋白质可以通过乙酰化修饰程度来调控光合作用。研究表明,与和PSII紧密结合的LHCb相比,拟南芥中和PSII松散结合的LHCb以及游离的LHCb显示出明显更高的赖氨酸乙酰化水平。这表明乙酰化修饰可能在LHCb复合物在类囊体膜的分布中发挥作用[20]。乙酰化修饰是植物叶绿体中普遍存在的保守的重要翻译后修饰,在光合作用的光反应和碳同化过程都发挥重要的调控作用。
线粒体也一直被认为是植物中乙酰化修饰参与调控的重要细胞器,因此有研究专门针对线粒体进行乙酰化蛋白质组学分析[5,39]。拟南芥[5]和豌豆[39](Pisum sativum)的线粒体乙酰化蛋白质组分析分别发现了120个和358个乙酰化蛋白质。这些蛋白质广泛参与碳代谢、光呼吸、核酸代谢、氨基酸和蛋白质代谢以及氧化还原调节等代谢过程。特别是,碳代谢中糖酵解和TCA循环中的大量酶发生乙酰化修饰。拟南芥线粒体中TCA循环的每一步酶促反应中至少有一个酶被乙酰化修饰,包括绝大多数的丙酮酸脱氢酶复合体(Pyruvate dehydrogenase complex)等[5]。叶绿体和线粒体分别是植物光合作用和呼吸作用的细胞器,对环境变化极其敏感[49-50],研究发现参与这些代谢过程的很多蛋白质都存在翻译后非组蛋白乙酰化修饰(图 2),暗示乙酰化修饰在这些代谢过程和环境适应中可能发挥了重要的调控作用。
在学习角色台词时有很多的学习技巧,要看重语言的魅力以及潜台词的发掘。那么有时我闷在探究语言魅力的同时要抓住台词中的一些行为动词,往往语言的魅力都会体现在动词之中。比方说,有这样一个经典舞台剧,主人公在讲述自己不幸遭遇的时候都会有很多台词,在所有的台词中行为动词是最经典的,这种行为动词是在表演是会很夸张的笑,到最后却出现哈哈大笑。但在使用动词时不会出现“笑着说”或“哈哈大笑着说”,不这样安排台词的原因是表演的情景是主人公惨遭不幸,而所遇到的坏人却没有机智的头脑,主人公才会使用这种台词进行抒发自己内心的情感。所以,影视表演中主人公的台词是由三个词语构成,即叙述、嘲讽和赞扬。[1]
3 赖氨酸乙酰化修饰肽段的结构特征
植物不同组织中,目前鉴定到的赖氨酸乙酰化修饰蛋白质大部分只有一个乙酰化修饰位点,而一部分蛋白质则同时存在多个乙酰化修饰位点(表1)。早期的乙酰化蛋白质组[19-20,24]鉴定到的乙酰化修饰位点数量平均只有1.2个,明显偏低。根据目前已报道的植物乙酰化蛋白质组[4,19-41],每个乙酰化修饰蛋白质的平均乙酰化位点为1.7个。最近报道的水稻种子[30]和小麦叶片[33]中都有72%的乙酰化蛋白质仅有一个乙酰化位点,而有4个或超过4个乙酰化位点的蛋白质分别只有4%(表2)。2018年,Liu等[22]鉴定的拟南芥地上部2638个蛋白质具有7456个乙酰化位点,平均每个蛋白质具有2.8个乙酰化修饰位点。只有56.6%的蛋白质仅有一个乙酰化位点,而有高达12%的蛋白质具有4个或超过4个乙酰化位点。与其它拟南芥乙酰化蛋白质组[21,23]相比,Liu等[22]从拟南芥中提取并鉴定的乙酰化蛋白质及其修饰位点数量多一倍以上,包括大量新发现的乙酰化修饰位点。该方法采用的蛋白分级提取方法不仅增加了低丰度修饰蛋白等的检出,而且提取的蛋白质更为完整,特别是增加了膜蛋白的检出率。因此,该乙酰化蛋白质组鉴定的乙酰化蛋白质也更为完整,得到的数据更趋向于拟南芥中真实存在的乙酰化修饰情况。这也表明了植物非组蛋白的乙酰化修饰的普遍性和重要性,在植物中仍有很多未知值得研究者发掘。
植物中乙酰化修饰位点的上下游的肽段通常具有一些保守的氨基酸序列(表2)。研究发现,草莓叶片中有近90%的乙酰化修饰位点是保守的肽段[37]。这些保守的氨基酸序列在同种植物的不同组织以及不同植物种类中也相对保守。水稻种子[30]和叶片[31]中的保守乙酰化修饰位点序列极其相似,保守序列Kac*R、Kac*K和KacH都大量存在。不同植物中,芳香族氨基酸酪氨酸(Tryosine,Y)和苯丙氨酸(Phenylalanine,F)以及带正电荷的组氨酸(Histidine,H)和赖氨酸(Lysine,K)在保守基序中最常出现。例如,小麦叶片中乙酰化修饰的保守基序主要为KacY、KacH、KacF、LKac和FKac[33]。同时,一些植物中也有一些特有的保守基序。例如,带正电荷的精氨酸(Arginine,R)在水稻保守基序中高频出现[30-31],而在小麦[33]、二穗短柄草[35]、草莓[37]的叶片和云杉的体细胞胚[38]的保守基序中并没有发现。这些保守氨基酸往往带正电荷或具有疏水侧链,很可能对乙酰化修饰的发生具有重要的功能。在今后的研究中,通过对乙酰化修饰保守位点的分析可以确定并优先选择重要的关键氨基酸残基进行定点突变以解析乙酰化修饰的作用方式和调控机制。
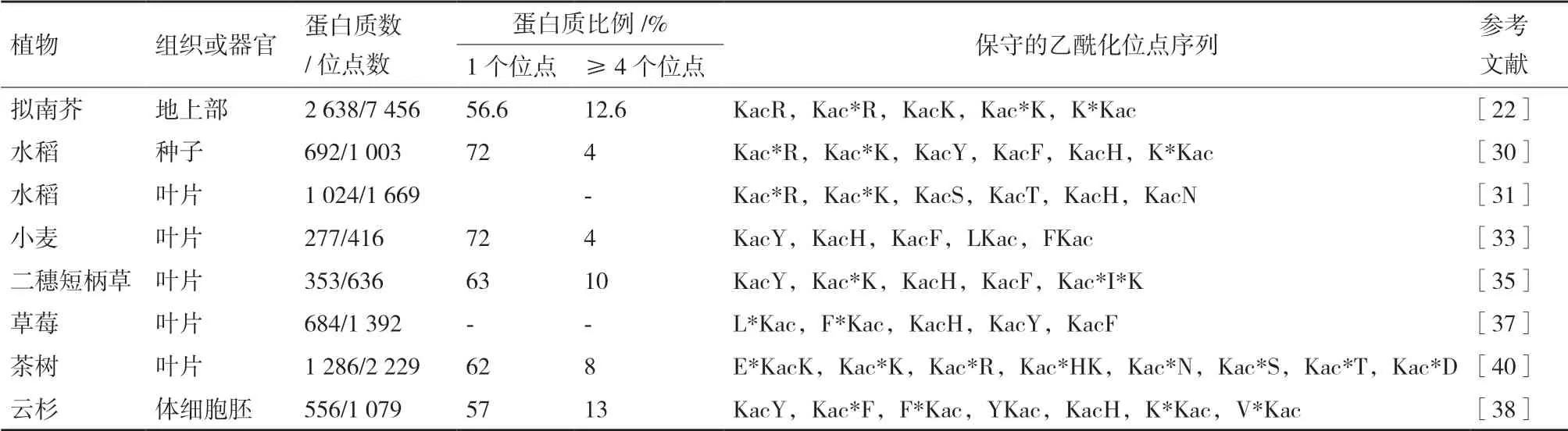
表2 不同植物乙酰化修饰位点的特征
4 非组蛋白赖氨酸乙酰化修饰在植物生长发育中的作用
植物的非组蛋白乙酰化蛋白质的分子功能大部分属于催化活力(约45%)和结合(约40%)[30-31,33,35,37,40],这也表明植物主要通过调控酶活力和蛋白质相互作用等参与各种生物过程。其中,非组蛋白赖氨酸乙酰化修饰在植物种子萌发和生殖生长过程中的作用有着较为深入的探究。
4.1 种子萌发
非组蛋白赖氨酸乙酰化修饰在植物种子的萌发过程中的变化尤为显著。研究发现,水稻种子在吸胀0-48 h内蛋白质的乙酰化修饰发生了显著的变化[27]。Western blot分析显示24 h后,蛋白质的乙酰化水平较高,乙酰化蛋白质组一共鉴定到了389个乙酰化蛋白质,包含699个乙酰化位点。这些蛋白质广泛参与翻译、刺激响应、葡萄糖分解代谢、糖酵解、前体代谢产物和能量、核苷酸代谢等代谢过程。这可以为后续水稻种子萌发的调控机制研究提供参考依据。
部分干燥处理可以提高针叶类植物体细胞胚的萌发能力。云杉体细胞胚的子叶和胚根的蛋白质乙酰化水平在部分干燥处理不同时间后(0、7、14和21 d)有着明显的差异[38]。其中,处理14 d后的云杉体细胞胚的乙酰化蛋白质组分析一共鉴定到556个乙酰化蛋白质。这些乙酰化蛋白质主要参与碳代谢(糖酵解/糖异生、TCA循环和磷酸戊糖途径)、脂肪酸途径以及胁迫响应。蛋白质相互作用分析显示,核糖体、蛋白酶体、剪接体和碳代谢相关的乙酰化蛋白质高度富集,它们很可能在干燥处理下的种子萌发过程中发挥主导作用。
4.2 生殖生长
非组蛋白赖氨酸乙酰化修饰在植物的生殖生长中同样发挥着至关重要的作用。早期发育的水稻种子的乙酰化蛋白质组分析表明,非组蛋白乙酰化蛋白质占到了乙酰化蛋白质的绝大部分(948/972,97.5%)[29]。而且,在生殖生长的各个不同发育时期,花和种子都受到非组蛋白乙酰化修饰广泛而特异性的精密调控。很多研究者对水稻花和种子在各个不同时期进行了细致的乙酰化蛋白质组研究,以剖析其中的调控机制。
植物在有性生殖过程中,减数分裂产生单倍体配子。Li等[28]通过乙酰化蛋白质组学在减数分裂时期,发育中的水稻花药中一共鉴定到了676个乙酰化蛋白,包含1354个乙酰化位点。GO富集分析表明,染色质沉默、蛋白质折叠、脂肪酸生物合成过程以及胁迫响应相关的蛋白质大量富集。其中,超过一半的乙酰化蛋白质(357个)同时也是减数分裂早期花粉母细胞(Meiocyte)中检测到的蛋白质[51],包括一些与水稻绒毡层和花粉发育相关的关键蛋白质。这些都表明乙酰化修饰广泛参与水稻花药发育和减数分裂。
5 非组蛋白赖氨酸乙酰化修饰在植物逆境响应中的作用
植物可以通过代谢酶的可逆乙酰化修饰来迅速感知细胞能量状态并灵活改变反应速率或方向从而应对环境变化。近几年,鉴于非组蛋白乙酰化修饰的广泛调控作用,研究者通过乙酰化蛋白质组学解析植物应对逆境的响应和适应机制。
随着水资源的匮乏和气候变化的加剧,干旱胁迫已经成为影响农作物生产力的主要限制因子之一[52]。世界上约70%的小麦种植在干旱或半干旱地区[53],干旱胁迫已经成为限制小麦生长和产量的主要非生物胁迫因素。Zhu等[34]考察了大田实验中干旱胁迫对发育中的小麦种子(开花后20 d)乙酰化修饰的影响。该研究一共鉴定到442个乙酰化修饰蛋白质(716个修饰位点)。其中,93个乙酰化蛋白质(106个乙酰化位点)在干旱胁迫下具有显著变化,大部分差异蛋白与代谢(57%)和细胞(20%)过程有关。这些蛋白质参与碳代谢、淀粉生物合成、蛋白质运输和降解、胁迫响应、转录等过程。干旱胁迫还导致蛋白质乙酰化和其它PTMs之间的交互作用。尤其是,淀粉生物合成的两种关键酶蔗糖合酶(Sucrose synthase,SuSy)和ADP葡萄糖焦磷酸化 酶(ADP glucose pyrophosphorylase,AGPase)的乙酰化和磷酸化修饰在干旱胁迫下均发生显著变化。干旱胁迫导致SuSy酶活力显著增加,这表明乙酰化修饰可能在淀粉合成中发挥正调控作用。酵母分子伴侣热休克蛋白90(Heat shock protein 90,HSP90)K294位点的乙酰化将减弱其与客户蛋白(client protein)的相互作用,影响其与辅助伴侣蛋白的结合[17]。干旱胁迫还导致HSP90和HSP81-3去乙酰化,这可以增强其对客户蛋白和辅助伴侣蛋白的相互作用,维持蛋白酶体的稳定性,保护细胞免受干旱胁迫的损害。
氮是植物生长发育过程中需求量最大的必需元素,缺氮严重抑制作物的生长发育以及最终的产量[54]。植物应对不同的氮供应有着复杂而精密的调控机制。Jiang等[40]通过乙酰化蛋白质组学解析了茶树幼苗在氮饥饿和恢复供氮条件下叶片乙酰化修饰蛋白质的变化。恢复供氮后,光合作用、糖酵解、氨基酸代谢以及次级代谢(黄酮合成)相关的乙酰化蛋白质发生显著变化。例如,恢复供氮后,光合系统的天线蛋白LHCa1的丰度显著上调,而LHCa3和LHCb6的丰度显著下调,这表明可逆的乙酰化修饰影响天线蛋白的功能,进而调控不同氮供应下叶片的光合速率。蛋白质相互分析也表明,氮供应相关的乙酰化蛋白质的多种相互作用主要涉及光合作用和核糖体。此外,还发现类黄酮合成相关的蛋白质苯丙氨酸解氨酶(Phenylalanine ammonia)、二氢黄酮还原酶(Dihydroflavonol 4-reductase)、柚皮苷3-双加氧酶(Naringenin 3-dioxygenase)和查耳酮异构酶(Chalcone isomerase)在短期恢复供氮(3 h)和长期恢复供氮(3 d)后具有差异的修饰变化。
值得注意的是,养分胁迫下,除了碳代谢和光合作用等初级代谢过程,更多次级代谢过程的乙酰化修饰也发生特异性的响应。三角褐指藻是一种重要的产油微藻,其生长和油脂的生物合成受环境养分的影响[55]。Chen等[41]通过乙酰化蛋白质组学发现,几乎所有参与脂肪酸合成的酶都被赖氨酸乙酰化。其中,长链乙酰辅酶A合成酶(Long-chain Acyl-CoA synthetase)为几乎所有的脂肪酸代谢提供活性乙酰基。Western Blot分析显示,该酶的乙酰化位点(K407和K425)的修饰水平受缺氮、缺磷和缺铁胁迫影响。部分干燥处理的云杉体细胞胚处于一个缺水、缺营养和氧化胁迫的环境中。与非干燥处理相比,部分干化处理的云杉体细胞胚中的脂肪酸途径也发生特异性富集[38]。这些次级代谢酶的快速可逆乙酰化修饰,在养分供应响应和适应的调节过程中发挥作用,有利于植物更加快速地应对不利环境。
氧化胁迫是常见的非生物胁迫方式之一。H2O2氧化胁迫下,水稻叶片中有只有12%-32%的赖氨酸乙酰化或琥珀酰化蛋白质的含量发生了变化,这表明这种调控是特异性[31]。差异蛋白质在蛋白质翻译和折叠、光合作用和糖酵解等生物过程富集,且大部分(77%-87%)差异蛋白质的含量发生下调。嘌呤核糖体和核小体装配相关的乙酰化位点可能特异性地参与H2O2氧化胁迫的响应。差异的乙酰化修饰蛋白在乙醛酸和二羧酸代谢、谷胱甘肽代谢以及半胱氨酸和甲硫氨酸代谢等代谢途径富集。综上,这些逆境胁迫下的非组蛋白乙酰化蛋白质组研究为植物应对不利环境的响应和适应的调控机制研究提供了新的参考依据。
6 赖氨酸乙酰化修饰和其他蛋白质翻译后修饰的交互作用
蛋白质翻译后修饰在代谢调控中具有快速、低耗和微调的特征[56-58]。除了乙酰化修饰,非组蛋白的赖氨酸还可以被其它多种类型翻译后修饰,如琥珀酰化(Succinylation)[59]、泛素化(Ubiquitination)[60]和甲基化(Methylation)[61]等。同时,蛋白质普遍存在磷酸化、糖基化等多种PTMs,赖氨酸乙酰化修饰与其它多种翻译后修饰之间存在交互作用(Crosstalk),形成多位点修饰,相互激活或相互抑制,协同调控各种条件下的生命过程[62-63]。
6.1 赖氨酸琥珀酰化修饰
除了赖氨酸乙酰化,琥珀酰化也是赖氨酸的一种重要的可逆酰化过程,在各种生物中广泛存在[59]。赖氨酸琥珀酰化将琥珀酰基从琥珀辅酶A(Succinylcoenzyme A)转化到赖氨酸的ε-氨基侧链[64]。很多赖氨酸乙酰化的位点同时也是琥珀酰化的修饰目标,因此,研究者会同时进行赖氨酸乙酰化和琥珀酰化分析。水稻种子在吸胀24 h后,一共鉴定到389种乙酰化蛋白质(699个乙酰化位点)和261种琥珀酰化蛋白质中(665个琥珀酰化位点)[27]。其中,78个蛋白质的133个位点同时被乙酰化和琥珀酰化。这些重叠的赖氨酸修饰位点更趋向发生在极性的酸性/碱性氨基酸区域,并且暴露在蛋白质表面。这些蛋白质几乎涵盖所有细胞功能,其中核糖体复合物和糖酵解/糖异生相关蛋白显著富集。二穗短柄草幼苗叶片中鉴定到了353个乙酰化蛋白质(636个乙酰化位点)和262个琥珀酰化蛋白质(605个琥珀酰化位点)[35]。其中,119个蛋白质和115个位点同时被乙酰化和琥珀酰化。这些蛋白质参与能量代谢、光合作用以及蛋白质合成等,且近一半的修饰发生在叶绿素。与乙酰化或甲基化相比,琥珀酰化增加的结构集团更大,这将导致赖氨酸结构改变更大,从而可能导致更为显著的蛋白质结构和功能的变化。因此,赖氨酸乙酰化和琥珀酰化很可能协同调控碳代谢和光合作用等重要生物过程。
6.2 蛋白质磷酸化修饰
蛋白质可逆磷酸化是一种植物中极为普遍的蛋白质翻译后修饰,主要发生在丝氨酸、苏氨酸以及酪氨酸上。蛋白质磷酸化修饰几乎参与了生命活动的所有过程,在信号传导、细胞增殖、发育以及胁迫响应中发挥重要作用[65]。蛋白质磷酸化和赖氨酸乙酰化这两种重要的翻译后修饰也存在交互作用。Uhrig等[23]通过解析拟南芥不同组织(幼苗、莲座叶、根、花和长角果)在白天结束时(the end of day,ED)和晚上结束时(the end of night,EN)乙酰化和磷酸化蛋白质丰度的变化来阐述蛋白质翻译后修饰在调控植物的昼夜节律和光响应的作用机制。组学分析一共鉴定出909个乙酰化蛋白质和2549个磷酸化蛋白质。其中,134种参与核心植物细胞过程(捕光和光合作用、翻译、代谢和细胞运输)的蛋白质同时被两种修饰,这也表明这两种修饰在这些关键过程中的调控作用。Zhu等[34]在发育中的小麦种子鉴定的68个乙酰化蛋白质很可能受到磷酸化的影响。这些受磷酸化和乙酰化修饰的蛋白参与碳代谢、压力防御和转录/翻译等代谢过程。此外,计算机模拟也发现绝大多数赖氨酸乙酰化位点的定点突变都有可能影响其附近的磷酸化、甲基化和泛素化位点的修饰状态[66]。这也表明了这些翻译后修饰之间可能存在相互作用且相应影响,协同调控生物过程。随着蛋白质修饰位点的种类和数量增多,PTMs之间的交互作用及其调控机制的复杂性随之增加,检测的难度也相应增大[67]。迄今大量研究已经证实了蛋白激酶、磷酸酶和泛素连接酶等在信号传导过程中存在磷酸化和泛素化修饰的交互作用[62,68]。然而,有关植物中涉及非组蛋白的乙酰化修饰参与的PMTs的交互作用的系统研究仍然缺乏。今后,多种翻译后修饰系统动态分析技术的发展将推动这一领域研究的研究。
7 问题与展望
随着植物乙酰化蛋白质组的不断解析,夯实了乙酰化修饰的广泛性和重要性。赖氨酸乙酰化修饰调控不仅仅发生在细胞核的组蛋白,更多的是全面参与叶绿体和线粒体等亚细胞器以及细胞质中的多种代谢和功能的调控。非组蛋白乙酰化修饰通过多种机制影响蛋白质功能,包括调节酶活性、蛋白质稳定、亚细胞定位、调控蛋白质-蛋白质互作,蛋白质-DNA互作、与其他翻译后修饰的共调控作用等[3]。然后,对于乙酰化修饰能否协同调节不同蛋白质参与特定生物学过程或者胁迫响应仍不清楚。今后,针对特定生物过程中乙酰化修饰的全面动态分析可能有助于了解乙酰化修饰在生长发育或应对环境变化中不同蛋白质中的协同调控过程。
毫无疑问,系统的非组蛋白赖氨酸乙酰化翻译后修饰的研究将为调控机制和功能研究提供更多可靠的依据。目前的乙酰化蛋白质组学解析的乙酰化蛋白很可能只是细胞内乙酰化修饰的一部分。Liu等[22]建立的CDG的蛋白质分离和二甲基标记的4C定量翻译后修饰组学解析到更多的膜蛋白翻译后修饰,这在其它常规的植物乙酰化蛋白质组中没有被发现。因此,该方法也为后续的植物非组蛋白乙酰化修饰的研究提供一个参考。但是,该方法步骤繁琐,对实验室仪器要求较高。因此,快速灵敏低成本的乙酰化蛋白质组学技术仍有待开发。高效的检测手段将加快推进这一研究领域的进展。
蛋白质不仅可被赖氨酸乙酰化修饰,同时也受到泛素化、SUMO(Small ubiquitin modifier)、甲基化等多种蛋白质翻译后修饰的调节[62-63,67-68]。这些翻译后修饰过程相互影响相互作用,而且一直处于高度动态变化中。过去受检测技术的限制,这些PTMs的交互作用没有被系统的解析。因此,亟需提高基于质谱的检测手段在时间和空间的分辨率来实现多种PTMs的高通量检测。今后,多种PTMs的交互作用的解析将为我们理解植物PTMs参与植物生长发育和应对环境变化的调控机制提供全新的信息。
目前,植物应对生物或非生物逆境胁迫的赖氨酸乙酰化修饰蛋白质组学受到越来越多的关注。这些研究不仅可以揭示了植物如何快速有效应对环境胁迫,更可能为遗传改良和育种提供了一种新的途径。例如,植物中很多碳代谢和光合作用的代谢酶活力受到乙酰化修饰状态的精密调控[19-21,23,32-33]。其中,Rubisco是光合作用的CO2固定的限速酶,其大亚基活性位点的乙酰化修饰状态控制着其酶活力,通过设计非酶促乙酰化修饰的代谢物可以控制Rubisco酶活力进而提高植物的CO2固定效率[69]。因此,剖析关键蛋白在翻译后修饰水平的调控机制是今后乙酰化相关研究中的重要问题之一,包括赖氨酸修饰的动态变化以及与其他PTMs的交互作用。我们希望可以通过定点突变或者CRISPR/Cas技术将赖氨酸乙酰化位点改为乙酰化或非乙酰化的类似物,进而改变代谢酶活力等,最终实现植物的生长、产量或抗逆性的提高。

