新城疫病毒通过影响细胞微丝骨架对宫颈癌HeLa细胞增殖、迁移和侵袭的抑制作用
金燕,王静,庞淼,张晓雪,刘开扬
宫颈癌是许多发展中国家的女性患癌死亡的常见原因,也是全球女性中最常见的恶性肿瘤[1]。溶瘤病毒(oncology virus,OVs)疗法是一种相对安全有效的治疗方法,可以在恶性肿瘤细胞中选择性复制而不损害正常细胞[2]。新城疫病毒(newcastle disease virus,NDV)则是天然溶瘤病毒的成员之一,属于Avulavirus属,副黏病毒科,可以用于癌症的治疗[3]。细胞骨架是维持真核细胞基本形态的重要结构,可承受细胞外界压力以及保持细胞内部结构的有序性[4]。NDV在肿瘤细胞中识别、感染、释放等过程均会对细胞骨架结构造成损伤[5]。研究发现,细胞骨架重塑可导致微丝及中间丝迅速解聚,使微管结构重组,形成凋亡微管网,凋亡微管网与微丝共同包裹细胞器进而形成凋亡小体[6-7]。NDV是否以细胞微丝骨架为靶点,通过各种途径影响细胞的增殖、迁移与侵袭尚不明确。为此,本实验用NDV F3株感染宫颈癌HeLa细胞,探究NDV抗肿瘤与细胞微丝骨架的关系。
1 材料与方法
1.1 实验材料宫颈癌HeLa细胞及NDV F3株由生命科学中心P2实验室保存。DMEM基础培养基、胰酶及细胞松弛素D(Cytochalasin D)购自美国Gibco公司;胎牛血清购自上海ExCellBio公司;CCK-8试剂盒购自日本同仁公司;Matrigel胶购自美国BD公司;GAPDH抗体购自武汉ABclonal公司;RhoA、Rho激酶(ROCK)2、F-肌动蛋白(F-actin)抗体及辣根过氧化物酶标记的二抗购自北京博奥森公司;Transwell3422购自美国康宁公司;TUNEL凋亡检测试剂盒和Hoechst33258购自上海碧云天生物技术有限公司;考马斯亮蓝-R250购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 HeLa细胞培养用含10%胎牛血清和1%双抗(青霉素和链霉素)的MEM培养基在37℃、体积分数5%CO2、饱和温度条件下常规培养。NDV F3原液感染复数(multiplicity of infection,MOI)为100,用DMEM无血清培养基稀释NDV F3,MOI分别为10、1、0.1、0.01、0.001。用NDV F3(终浓度MOI=0.1)分别作用细胞12、24和36 h,然后普通倒置显微镜下观察细胞形态改变。
1.2.2 HeLa细胞微丝骨架染色考马斯亮蓝染色用于骨架形态及完整性研究,TritonX-100可以溶解脂膜大部分非骨架蛋白,细胞骨架系统的蛋白不被溶解,考马斯亮蓝染液进行染色,即可显示骨架结构。选取生长状态良好的HeLa细胞,消化为细胞悬液,接种于6孔板中爬片,CO2培养箱中继续培养细胞融合至30%。每孔加1%Tritonx-100并没过玻片,37℃静置18 min,用M缓冲液洗3次,每次3 min;用戊二醛固定20 min,PBS洗3次;考马斯亮蓝R-250染液染色30 min,PBS洗3次。设置对照组;病毒组为NDV F3(终浓度MOI=0.1)作用24 h;Cytochalasin D组为5 mmol/L Cytochalasin D作用24 h。以上实验均重复3次,倒置显微镜下观察NDV F3感染细胞后的形态变化及微丝骨架结构变化并摄片。
1.2.3 CCK-8法检测HeLa细胞的增殖情况选取对数生长期的HeLa细胞,胰蛋白酶消化为细胞悬液,接种于96孔板中,CO2培养箱中继续培养细胞融合至70%~80%。细胞培养至12、24、36、48、60和72 h后每孔各加入10μL CCK-8,CO2培养箱中孵育4 h。酶标仪于450 nm波长下测定各孔光密度(OD)值。设置对照组;病毒组MOI分别为1、0.1、0.01、0.01、0.001的NDV F3。增殖率(%)=OD实验组/OD对照组×100%。以上实验均重复3次。
1.2.4 Hoechst33258染色检测HeLa细胞凋亡情况选取对数生长期的HeLa细胞,胰酶消化为细胞悬液,接种于6孔板中爬片,CO2培养箱中培养至细胞融合至70%~80%。培养24 h后用4%多聚甲醛固定15 min,PBS洗3次,每次3 min。加入Hoechst33258染液染色8 min,PBS洗3洗,每次3 min。抗荧光淬灭封片剂封片,荧光显微镜摄片。设置对照组;病毒组为NDV F3(终浓度MOI为0.1、0.01)作用24 h。以上实验均重复3次。
1.2.5 TUNEL检测细胞凋亡将细胞接种于24孔板中,CO2培养箱中培养至细胞融合至70%~80%。用4%多聚甲醛固定30 min,0.3%Triton X-100室温孵育30 min,然后0.3%H2O2室温孵育20 min。根据试剂盒说明书配置生物素标记液,每孔50μL生物素标记液37℃避光孵育60 min,然后每孔加200μL标记反应终止液室温孵育10 min。配置Streptavidin-HRP工作液及DAB显色液,每孔加50μL Streptavidin-HRP工作液室温孵育30 min,然后每孔加200μL DAB显色液室温孵育15 min,PBS洗3次。显微镜下观察摄片。设置对照组;病毒组为NDV F3(终浓度MOI为0.1、0.01)作用24 h。以上实验均重复3次。
1.2.6 划痕实验检测HeLa细胞迁移能力选取对数生长期的HeLa细胞,胰蛋白酶消化为细胞悬液,接种于6孔板中,CO2培养箱中继续培养细胞融合至90%。用10μL移液器在每孔中各划3条水平的直线,PBS洗去划掉的漂浮细胞,在划痕0、24、48 h后倒置显微镜下观察摄片并测量划痕宽度。设置对照组;病毒组为NDV F3(终浓度MOI=0.1);Cytochalasin D组为5 mmol/L Cytochalasin D。细胞迁移率(%)=24 h或48 h划痕宽度/0 h划痕宽度×100%。以上实验均重复3次。
1.2.7 Transwell实验检测HeLa细胞侵袭能力将Matrigel胶置于4℃冰箱中使其变为液态,用无血清DMEM培养基稀释(1∶3),每孔60μL Matrigel胶均匀地加入预冷的Transwell板,37℃放置1 h使其凝固;HeLa细胞先用无血清DMEM培养基饥饿12 h,胰酶消化并离心,PBS洗3次,细胞计数为(1~5)×107个/L,每孔200μL细胞悬液接种于上室孔中,下室加入500μL DMEM完全培养基。置于CO2培养箱中培养24 h;吸弃小室内培养基,用棉签将Matrigel胶轻轻擦拭,4%多聚甲醛固定20 min,PBS洗3次,0.1%结晶紫染色20 min,PBS洗3次;风干,置于倒置显微镜下观察摄片。设置对照组;病毒组为NDV F3(终浓度MOI=0.1)作用24 h;Cytochalasin D组为5 mmol/L Cytochalasin D作用24 h。以上实验均重复3次。
1.2.8 Western blot分析细胞骨架相关蛋白F-actin、RhoA和ROCK2的表达收集NDV F3(终浓度MOI=0.1)作用时间分别为24、36和48 h的细胞及对照组的正常细胞,并提取蛋白。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后转膜;5%脱脂奶粉室温封闭1 h;一抗4℃室孵育过夜;二抗在室温孵育2 h。GAPDH作为内参。DAB显色液显色,AI600上机检测条带,用Image J分析并计算灰度值。以上实验均重复3次。
1.3 统计学方法 本实验数据均使用SPSS 26.0软件进行处理,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析和重复测量方差分析,组间多重比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 NDV F3对HeLa细胞形态的影响倒置显微镜下观察,对照组HeLa细胞贴壁良好,形态正常,呈铺路石状,折光性佳;NDV F3感染12 h后,细胞失去正常形态,边缘逐渐模糊,胞浆内出现颗粒,部分细胞有融合现象;感染24 h后,细胞变圆并脱落,细胞破裂,并可见一些圆形空泡;感染36 h后,贴壁细胞剩余较少,大量细胞碎裂、悬浮,失去折光性。见图1。

Fig.1 Observation of the morphology of HeLa cells infected by NDV under an ordinary inverted microscope(×100)图1 普通倒置显微镜下观察NDV感染HeLa细胞后形态(×100)
2.2 HeLa细胞微丝骨架染色NDV F3对细胞微丝骨架有极大的破坏作用。对照组的正常细胞微丝骨架无聚集且均匀排列,细胞表面结构正常。病毒感染后可引起细胞骨架重组,微丝骨架有聚合的现象,呈小团块聚集,形成网络空洞状态,并且细胞的边界更加明显。Cytochalasin D作用后,可见微丝骨架排列紊乱,聚集成团,见图2。

Fig.2 Observation of the microfilament skeleton of HeLa cells under an ordinary inverted microscope(Coomassie Brilliant Blue Staining,×200)图2 普通倒置显微镜下观察HeLa细胞微丝骨架(考马斯亮蓝染色,×200)
2.3 HeLa细胞的增殖情况CCK-8结果显示,不同浓度的NDV F3对HeLa细胞增殖均有抑制作用,病毒浓度越大对细胞增殖作用抑制的越明显(P<0.05),在NDV F3终浓度为MOI=1和MOI=0.1时抑制效果较明显;NDV F3作用不同时间之间的差异有统计学意义(P<0.05)。见表1。
2.4 HeLa细胞凋亡情况Hoechst33258染色结果显示,对照组细胞核形态及大小较均一,边界完整清晰,荧光染色呈匀质状。与对照组相比,NDV F3感染后的HeLa细胞可见细胞核聚集固缩,部分细胞核呈碎块状,形成凋亡小体,为细胞凋亡的特征性改变。荧光染色呈高亮。见图3。TUNEL检测结果显示,对照组的正常细胞未被DAB染成棕色,为阴性,NDV F3组细胞凝集成团的部分与DAB结合显示为棕色,细胞发生凋亡,并且MOI=0.1时凋亡发生结果更为显著。见图4。
2.5 HeLa细胞迁移能力细胞划痕实验结果显示NFV F3对细胞的迁移能力有抑制作用。与对照组相比,NDV F3终浓度MOI=0.1作用24 h和48 h时对细胞迁移能力均有抑制作用,并且病毒作用48 h的抑制效果较24 h更加显著。Cytochalasin D组与对照组相比也有明显的抑制作用,随着作用时间的增加,抑制效果更加显著。见图5、表2。

Tab.1 Effects of different groups and different duration time on the proliferation of HeLa cells表1 不同分组及不同作用时间对HeLa细胞增殖的影响
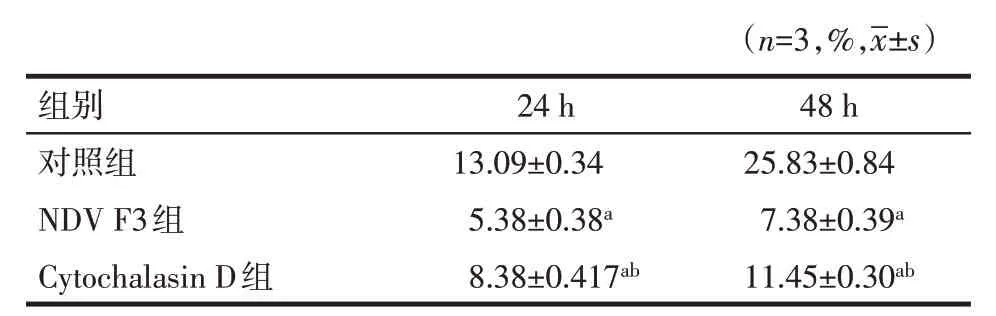
表2各组在划痕24 h和48 h的迁移率比较Tab.2 The mobility of different groups at 24 h and 48 h after scratch
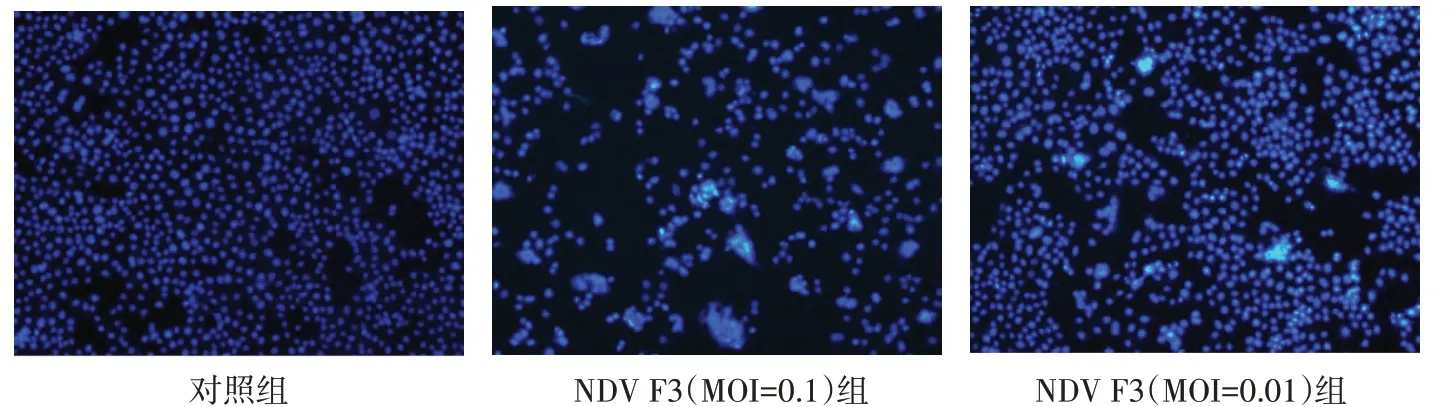
Fig.3 The effect of NDV F3 on HeLa cell apoptosis(Hoechst33258 Staining,×100)图3 NDV F3对HeLa细胞凋亡的影响(Hoechst33258染色,×100)

Fig.4 NDV F3 induced apoptosis of HeLa cells(DAB Staining,×100)图4 NDV F3诱导HeLa细胞发生凋亡(DAB染色,×100)
2.6 HeLa细胞侵袭能力Transwell实验结果显示NFV F3对细胞的侵袭能力有抑制作用。与对照组[(548.333±26.951)个/视 野]相 比,NDV F3组[(61.333±23.159)个/视 野]和Cytochalasin D组[(238.667±32.808)个/视野]穿过小室的数目均明显减少(n=3,F=233.760,P<0.01)。见图6。
2.7 NDV F3对HeLa细胞骨架相关蛋白F-actin、RhoA和ROCK2表达的影响Western blot结果显示,在NDV F3作用HeLa细胞24 h时,F-actin、RhoA和ROCK2表达量较对照组均无明显差异,而36 h和48 h时3种蛋白的表达量均较对照组降低(P<0.01)。见图7、表3。

Tab.3 Comparison of expression levels of cytoskeletonrelated proteins F-actin,RhoA and ROCK2 between four groups表3 各组间F-actin、RhoA、ROCK2蛋白表达量比较
3 讨论
3.1 NDV治疗肿瘤的潜力溶瘤病毒的应用是具有潜力的癌症治疗策略。溶瘤病毒可分为基因工程或天然存在的毒株,其通过选择性感染癌细胞而不损害未转化的细胞和正常组织,从而诱导有效的适应性抗肿瘤免疫[8-9]。截至目前,溶瘤病毒Onyx-015(中国)和T-VEC(美国)分别被批准用于头颈部鳞状细胞癌[10]和转移性黑素瘤[11]受试者。除此之外,许多其他溶瘤病毒已用于临床前研究和早期临床试验。临床试验表明在各种类型实体瘤的癌症患者中使用野生型NDV毒株进行抗肿瘤治疗未见严重的不良反应[12]。因此,溶瘤性NDV用于癌症治疗可能是一种安全有效的策略。
3.2 NDV F3可通过微丝骨架影响肿瘤细胞的增殖倒置光学显微镜下观察NDV感染后的HeLa细胞有明显的融合现象,随着感染时间的延长,细胞不再贴壁生长并且大量漂浮死亡。CCK-8实验和Hoechst33258染色确定NDV感染细胞后的细胞活性受抑,NDV感染后可以使细胞膜受损,释放乳酸脱氢酶,抑制了细胞增殖,并且细胞核发生了固缩、碎裂以及形成凋亡小体,细胞发生凋亡。进一步用TUNEL检测法特异性地观察到凝集的细胞团可以被DAB特异性结合,显示为棕色,证明细胞发生凋亡。以上实验结果均证明NDV F3感染能抑制HeLa细胞增殖并诱导其凋亡。Cytochalasin D是一种源于真菌代谢产物的肌动蛋白聚合抑制剂,通过与肌动蛋白纤维正端的结合来抑制亚基的聚合和解离,从而干扰细胞的运动、生长及吞噬等多种细胞生理过程。细胞骨架由微管、微丝、中间丝构成。微丝由Actin和与其结合的蛋白组成。细胞的运动、分裂、质膜的流动等多种功能都需要Actin的协调流动和重建[13]。本研究以Cytochalasin D作为细胞骨架异常的阳性对照,通过对细胞微丝骨架的染色发现NDV F3作用HeLa细胞后细胞微丝骨架发生聚集现象且排列紊乱。Rho家族蛋白是Actin的上游调控因子。研究显示,Rho家族蛋白具有促进肿瘤细胞增殖并抑制凋亡的作用,对肿瘤的发生发展起着促进作用[14]。细胞发生凋亡时,细胞骨架内的结构会发生变化,细胞骨架重组,形成凋亡微管网及凋亡小体[15]。
3.3 NDV F3可通过微丝骨架影响肿瘤细胞的迁移与侵袭恶性肿瘤致死率高主要是因为肿瘤细胞具备了迁移和侵袭的能力,能够穿透基底膜并到达间质,完成上皮间质转化(EMT)这一癌变过程,然后随着血液和淋巴转移[16]。细胞骨架与肿瘤的迁移与侵袭密切相关[5]。RhoA/ROCK信号通路是参与微丝骨架改变的一条重要通路。RhoA不仅与肿瘤细胞的增殖有关,还可以通过与GTP酶结合活化下游效应蛋白调节细胞骨架,从而影响细胞迁移[17]。ROCK是RhoA蛋白重要的下游效应器,通过磷酸化肌球蛋白轻链(MLC)和肌球蛋白磷酸酶亚基1(MYPT1),影响肌动蛋白与肌球蛋白的交联以及肌动蛋白微丝骨架的聚合,进一步调控细胞骨架微丝和伪足等Factin样结构形态改变,导致微丝骨架重组等多种生物学行为[18-19]。本研究中,划痕和Transwell实验发现NDV F3对HeLa细胞的迁移率和侵袭数目均有抑制作用,Western blot检测F-acin、RhoA和ROCK的蛋白表达量均有降低的趋势,提示NDV的作用可能破坏了细胞骨架内的结构,影响微丝骨架的聚合,从而破坏了细胞的迁移及侵袭能力。其机制可能与RhoA/ROCK信号通路有关。
综上所述,NDV F3可抑制宫颈癌HeLa细胞的增殖并诱导凋亡,其机制可能与破坏细胞微丝骨架等结构的完整性与功能有关。此外,NDV F3作用HeLa细胞后对细胞的迁移与侵袭能力均有抑制作用,其机制可能与细胞微丝骨架蛋白相关的RhoA/ROCK信号通路有关。

Fig.5 Changes in migration distance of each group of cells after scratching(×100)图5 各组细胞划痕后迁移距离的变化(×100)

